Производные гемоглобина
Оксигемоглобин HbO2.Молекулярный кислород присоединяется к каждому гему Hb при помощи координационных связей железа. Присоединение каждой молекулы кислорода облегчает присоединение последующей. Эта аллостерическая зависимостьполучила название эффекта Бора.Оксигемоглобин, попадая в ткани, теряет кислород, становясь дезоксигемоглобином.
Карбгемоглобин HbCO2 соединение гемоглобина с углекислым газом. Он нестоек и быстро диссоциирует в легочных капиллярах с отщеплением СО2.
Карбоксигемоглобин HbCO - продукт присоединения оксида углерода CO (угарного газа) к гемоглобину. Гемоглобин имеет высокое сродство к СО и прочно с ним связывается. Гемоглобин теряет способность связывать кислород, и наступает смерть от удушья.
Метгемоглобин MtHb -форма гемоглобина, в которой железо гема находится в трёхвалентном состоянии.Не способен переносить кислород. Образуется из свободного гемоглобина под действием различных окислителей, а в организме - при некоторых отравлениях.
Метгемоглобинемия - появление в крови метгемоглобина. Выделяют наследственные и приобретенные метгемоглобинемии. Наследственные развиваются в результате наличия нестабильных или аномальных гемоглобинов. Среди приобретенных могут быть токсические метгемоглобинемии экзогенного происхождения, возникающие при воздействии ряда химических веществ (нитраты, нитриты, анилин, некоторые лекарственные препараты), и эндогенного происхождения, развивающиеся вследствие нарушения продукции и всасывания нитратов при энтероколитах. При значительной метгемоглобинемии возникает кислородное голодание (гипоксия).
Методом качественного определения различных производных гемоглобина является исследование их спектров поглощения.
Миоглобин- глобулярный белок, осуществляющий в мышцах запасание молекулярного кислорода и передачу его окислительным системам клеток. Состоит из одной полипептидной цепи. Как и в гемоглобине, активным центром молекулы, связывающим O2, является гем. Миоглобин определяет цвет мышц.
К хромопротеинам относятся также ферменты каталаза, пероксидаза, цитохромы.
Флавопротеины –хромопротеины, простетические группы которых представлены производными изоаллоксазина - флавинмононуклеотидом (ФМН) и флавинадениндинуклеотидом (ФАД). Флавопротеины входят в состав оксидоредуктаз - ферментов, катализирующих окислительно-восстановительные реакции в клетке.
2. Липопротеинысостоят из белка и простетической группы, представленной каким-либо липидом (нейтральные жиры, свободные жирные кислоты, фосфолипиды, холестериды). Липопротеины широко распространены и выполняют разнообразные биологические функции. Представители липопротеинов - белок ткани легких, липовителлин желтка куриного яйца и т.д.
Липопротеины присутствуют в свободном состоянии (главным образом в плазме крови). Липопротеины сыворотки крови содержат гидрофобное липидное ядро, окруженное полярными липидами и оболочкой из белков, получивших название апобелки. Они обеспечивают транспорт водонерастворимых липидов.
Липиды, ковалентно связанные с белком, служат якорем, с помощью которого белки прикрепляются к мембране. Это т.н. структурированные липопротеины (липиды мембран клетки, миелиновой оболочки нервных волокон).
3. Фосфопротеины- сложные белки, в состав которых в качестве небелкового компонента входит фосфорная кислота, присоединенная к полипептидной цепи сложноэфирной связью через остатки серина или треонина. Возможен также ионный тип связи.
К фосфопротеинам относятся казеиноген молока, овальбумин белка куриного яйца, ряд ферментов, например, РНК-полимеразы. Большое количество фосфопротеинов содержится в клетках ЦНС.
Фосфопротеины являются ценным источником энергетического и пластического материала в процессе эмбриогенеза и постнатального роста и развития организма, участвуют в регуляции ядерной активности клетки, транспорте ионов и окислительных процессах в митохондриях.
4. Гликопротеины -сложные белки, содержащие, помимо простого белка или пептида, линейные или разветвленные гетероолигосахаридные цепи, содержащие от 2 до 15 остатков гексоз, пентоз и конечный углевод (N-ацетилгалактозамин или др.). Углеводный компонент соединяется с белком ковалентными связями.
Гликопротеины - белки плазмы крови (кроме альбуминов), некоторые ферменты, муцин слюны, белки хрящевой и костной тканей. Гликопротеины являются важным структурным компонентом клеточных мембран. Они обеспечивают клеточную адгезию, молекулярное и клеточное узнавание. Углеводные компоненты, помимо информативной функции, повышают стабильность молекул, в состав которых они входят, к различного рода химическим, физическим воздействиям и предохраняют их от действия протеиназ.
Гликопротеины мембран эритроцитов предопределяют группу крови у человека. К типичным гликопротеинам относятся интерфероны, иммуноглобулины.
Интерфероны- ингибиторы размножения многих типов вирусов. Они образуются в клетке в ответ на внедрение вирусной нуклеиновой кислоты. Интерфероны считаются основными защитными белками не только против вирусной инфекции, но и при опухолевых поражениях.
Иммуноглобулины,или антитела, выполняют защитную функцию, обезвреживая поступающие в организм чужеродные вещества - антигены любой химической природы. Выделяют три основных класса иммуноглобулинов: IgG, IgA, IgM; минорные классы иммуноглобулинов плазмы человека обозначаются как IgD и IgE. Иммуноглобулины разных классов отличаются по молекулярной массе, по концентрации в крови, по биологическим свойствам.
При ревматоидных артритах часто синтезируются аномальные антитела с необычайно короткими сахарными цепями, что вызывает стимуляцию иммунной системы против самого организма.
Протеогликаны - комплексы белка и гликозаминогликанов. Углевод в этих соединениях составляет основную часть молекулы (до 95 %). Типичными гликозаминогликанами являются гиалуроновая кислота (ее основная функция - в соединительной ткани - связывание воды) и гепарин, участвующий в регуляции свертывания крови.
5. Металлопротеины, помимо белка, содержат ионы какого-либо одного металла или нескольких металлов.
1. Белки, содержащие негемовое железо.
Ферритин (около 20% железа) сосредоточен главным образом в селезенке, печени, костном мозге. Выполняет роль депо железа в организме.
Трансферрин сыворотки крови (около 0,13% железа) транспортирует ионы железа в ретикулоциты, в которых осуществляется биосинтез гемоглобина.
2. Металлоферменты. Это белки, обладающие ферментативной активностью и содержащие катионы металлов. В металлоферментах связь белка с металлом более прочная. Ферменты, активируемые ионами металлов, менее прочно связаны с металлами.
АТФ-аза содержит Na, К, Са, Мg, алкогольдегидрогеназа – Zn, цитохромоксидаза – Cu, протеиназы - Mg, К.
6. Нуклеопротеины (НП) - устойчивые комплексы нуклеиновых кислот с белками.
Нуклеиновые кислоты (НК) - ДНК и РНК – полимеры нуклеотидов.
ДНК находится в основном в ядре клетки и в митохондриях.
РНК обнаруживается во всех частях клетки. Различают мРНК (синтезируется на ДНК, определяет порядок аминокислот в молекуле белка), рРНК (входит в состав рибосом), тРНК (транспортирует аминокислоты к месту синтеза белка). НК обеспечивают хранение и передачу наследственной информации путем программирования синтеза клеточных белков.
В состав нуклеиновых кислот входят азотистые основания (ДНК - аденин, гуанин, цитозин, тимин, РНК - аденин, гуанин, цитозин, урацил), углеводы (дезоксирибоза и рибоза соответственно), остатки фосфорной кислоты.
Нуклеотиды (рис. 7) состоят из трех компонентов: пиримидинового или пуринового основания, пентозы (рибозы) и фосфорной кислоты. Нуклеотиды – нуклеозидфосфаты.
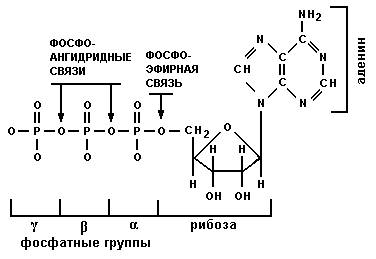
|
| Рис. 7. Строение нуклеотида |
ДНК, выделенная из разных тканей одного и того же вида, имеет одинаковый состав азотистых оснований. Закономерности состава и количественного содержания азотистых оснований установлены впервые Э. Чаргаффом и были названы правилами Чаргаффа:
1. Молярная доля пуриновых оснований равна молярной доле пиримидиновых оснований: А + Г = Ц + Т.
2. Количество аденина и цитозина равно количеству гуанина и тимина:
А + Ц = Г + Т.
3. Количество аденина равно количеству тимина, количество гуанина равно количеству цитозина: А = Т, Г = Ц.
4. Коэффициент специфичности равен (Г + Ц)/(А + Т)(у животных 0,54-0,94, у микроорганизмов 0,45-2,57).
Дата добавления: 2016-07-27; просмотров: 3243;











