ИЗУЧЕНИЕ АДСОРБЦИИ УКСУСНОЙ КИСЛОТЫ ИЗ РАСТВОРОВ НА ТВЁРДОМ АДСОРБЕНТЕ СТАТИЧЕСКИМ МЕТОДОМ
Цель работы: 1) построение кривых изотерм адсорбции ПАВ из водного раствора на твёрдом адсорбенте; 2) определение предельного значения адсорбции; вычисление удельной поверхности адсорбента, 3) определение характера адсорбции.
Адсорбция представляет собой процесс самопроизвольного перераспределения компонентов системы между поверхностным слоем и объёмной фазой. Причём в поверхностный слой переходит компонент сменьшим поверхностным натяжением.
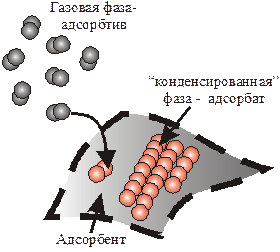 Вещество, на поверхности которого происходит адсорбция,называется адсорбентом. Адсорбент может быть твёрдым ижидким.
Вещество, на поверхности которого происходит адсорбция,называется адсорбентом. Адсорбент может быть твёрдым ижидким.
Вещество, которое перераспределено в поверхностном слое адсорбента (обычно находится в газообразной или жидкой фазе) называется адсорбатом.
Фаза, из которой в данный момент идет адсорбция (газ или жидкость), называется адсорбтивом. Молекулы перераспределяемого вещества, удерживаемые на поверхностном слое адсорбента, по сумме статистических состояний отличаются от фазы, из которой идет адсорбция – в этом различие между адсорбатом и адсорбтивом. Р и с. 1. К понятиям «адсорбент»,
«адсорбат», «адсорбтив»
Величину адсорбции выражают двумя способами.
Абсолютнаявеличинаадсорбции А определяется количеством вещества в поверхностном слое, приходящимся на единицу поверхности или единицу массы адсорбента.
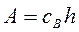 (1)
(1)
где А - величина адсорбции, кмоль/м (кмоль/кг);
cВ - концентрация компонента в поверхностном слое толщиной h.
Избыточная (Гиббсовская) адсорбция Г - это избыток вещества в поверхностном слое по сравнению с его количеством в таком же объёме фазы, отнесённьй к единице площади поверхности.
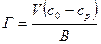 (2)
(2)
где Г - гиббсовская адсорбция, кмоль/м;
V - объём фазы, м3;
со, ср - исходная и равновесная концентрация компонента в объёме кмоль/м3;
В- площадь поверхности, м2.
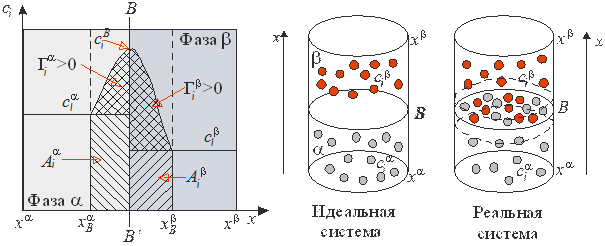
Р и с. 2. Величины адсорбции А и Г, связь между ними, В-В’ – разделяющая поверхность
При большом избытке адсорбата, когда сВ >> cp, величины А и Г приблизительно равны.
Графическая зависимость адсорбции от концентрации адсорбируемого вещества в объёмной фазе при данной температуре называется изотермой адсорбции 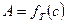 (рис. 3, а).
(рис. 3, а).
Зависимость величины адсорбции от температуры при постоянной концентрации вещества называется изопикной 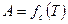 (рис. 3, б).
(рис. 3, б).
Зависимость величины адсорбции от температуры при постоянном давлении называется изобарой 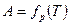 (рис. 3, в).
(рис. 3, в).
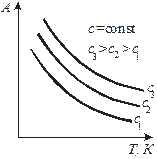
Зависимость концентрации вещества в объёме от температуры при постоянной величине адсорбциии называется изостерой 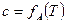 (рис. 3, г). Эти зависимости можно построить из серии изотерм, полученных при различных температурах.
(рис. 3, г). Эти зависимости можно построить из серии изотерм, полученных при различных температурах.
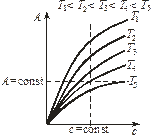
| 
| 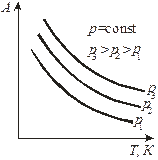
| 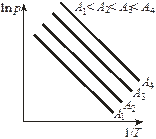
|
| а) изотермы | б) изопикны | в) изобары | г) изостеры |
Р и с. 3. Адсорбционные графические зависимости
Молекулярная адсорбция из растворов зависит от природы поверхности адсорбента, природы адсорбата и его концентрации, природы растворителя, температуры.
Типичные поверхностно-активные вещества (ПАВ) состоят из активной гидрофильной полярной группы (o) и неполярной гидрофобной группы – углеводородного радикала (¾ или ÙÙÙ): 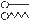 .
.
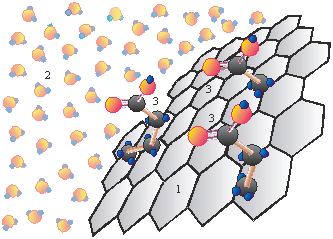
Такие дифильные молекулы, взаимодействующие одновременно с полярными и неполярными средами, самопроизвольно накапливаются на границе раздела фаз, образуя адсорбционный слой определённой структуры. В адсорбционных слоях молекулы ПАВ ориентируются полярными группами в сторону полярной среды, а гидрофобной частью - в сторону менее полярной фазы (воздух, углеводородная жидкость, твёрдая неполярная фаза). Полярные гидрофильные поверхности - минеральные вещества (глина, силикагель) хорошо адсорбируют ПАВ из углеводородных сред. Неполярные гидрофобные твёрдые адсорбенты такие, как уголь, сажа, некоторые полимерные материалы, хорошо адсорбируют ПАВ из полярных жидкостей (рис. 4). По истечении определённого времени в системе «адсорбент-водный раствор ПАВ» устанавливается равновесие между количеством адсорбируемого вещества А и его равновесной концентрацией ср в объёме.
| 
|
| Р и с. 4. К вопросу об ориентации молекул ПАВ в системе «адсорбент-растворитель»: 1 – неполярный адсорбент (уголь); 2 – полярная среда (вода); 3 – молекулы ПАВ (представители гомологического ряда) | Р и с. 5. Р и с. 5. Изотерма мономолекулярной адсорбции Ленгмюра |
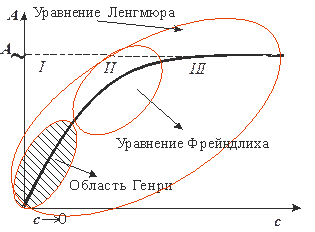
Это равновесие может быть описано уравнением Ленгмюра (рис. 5)
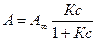 , (3)
, (3)
где А – величина адсорбции, кмоль/кг;
А¥ - предельная мономолекулярная адсорбция (ёмкость монослоя);
К – константа адсорбционного равновесия (имеет смысл отношения констант адсорбции и десорбции и характеризуют энергию взаимодействия адсорбата с адсорбентом);
с – концентрация адсорбата в растворе, кмоль/м3.
1. При с®0 получим: 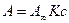 и адсорбция из предельно разбавленного раствора подчиняется закону Генри (рис. 5 – область Генри, I):
и адсорбция из предельно разбавленного раствора подчиняется закону Генри (рис. 5 – область Генри, I):
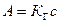 , (4)
, (4)
где КГ – константа Генри (коэффициент распределения третьего компонента в двух фазах, не зависящий от концентрации).
2. При больших концентрациях, когда 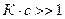 , уравнение (3) переходит в соотношение
, уравнение (3) переходит в соотношение 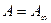 . (5)
. (5)
Это соотношение отвечает насыщению, когда вся поверхность адсорбента покрывается мономолекулярным слоем адсорбата (рис. 5, область III).
Таким образом, константа Генри связана с константой уравнения Ленгмюра:
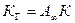 .
.
Экспериментальные результаты адсорбции обрабатывают спомощью уравнения Ленгмюра, записанного в линейной форме:
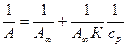 (6)
(6)
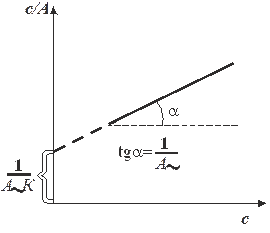
Графическая зависимость 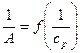 выражается прямой, пересекающей ось ординат (рис. 6). Отрезок, отсекаемый на оси ординат, определяет величину, обратную ёмкости монослоя
выражается прямой, пересекающей ось ординат (рис. 6). Отрезок, отсекаемый на оси ординат, определяет величину, обратную ёмкости монослоя 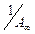 . Тангенс утла наклона прямой равен
. Тангенс утла наклона прямой равен 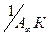 , что позволяет найти константу адсорбционного равновесия К.
, что позволяет найти константу адсорбционного равновесия К.
Количество адсорбируемого вещества в области средних заполнений можно найти по эмпирическому уравнению Фрейндлиха (рис. 5, область II):
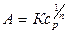 , (7)
, (7)
где К и n - постоянные.
По физическому смыслу константа К представляет собой величину адсорбции при равновесной концентрации адсорбата, равной кмоль/м. Показатель 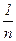 характеризует степень приближения изотермы к прямой.
характеризует степень приближения изотермы к прямой.
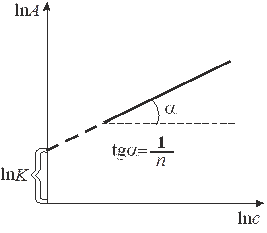
При обработке экспериментальных адсорбционных данных уравнение Фрейндлиха применяется в логарифмической форме:
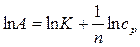 , (8)
, (8)
что позволяет построить линейную зависимость 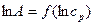 и графически определить постоянные К и n (рис. 7). Экстраполяция прямой до оси ординат даёт отрезок, равный lnК. Тангенс угла наклона прямой
и графически определить постоянные К и n (рис. 7). Экстраполяция прямой до оси ординат даёт отрезок, равный lnК. Тангенс угла наклона прямой 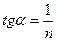 .
.
Если экспериментальные данные дают линейную зависимость по уравнениям (6) и (8), то адсорбция имеет мономолекулярный характер.
| 
| |
| Р и с. 6. Изотерма адсорбции в координатах линейной формы уравнения Ленгмюра | Р и c. 7. Определение констант в уравнении Фрейндлиха |
Экспериментальное определение предельной адсорбции А позволяет рассчитать удельную поверхность адсорбента:
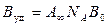 , (9)
, (9)
где Вуд - удельная поверхность адсорбента, м/кг;
NA - число Авогадро;
Во- площадь, занимаемая одной молекулой ПАВ, м2.
Исследования показали, что площадь, занимаемая одной молекулой большинства одноосновных жирных кислот и спиртов, составляет 0,2 - 0,3 нм2. Для уксусной кислоты 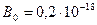 м2.
м2.
Таким образом, экспериментальные данные позволяют рассчитать следующие величины: адсорбцию ПАВ на межфазной границе «раствор-твёрдый адсорбент»; предельную адсорбцию поверхностного мономолекулярного слоя; удельную поверхность твёрдого адсорбента, катализатора.
Порядок выполнения работы
Для проведения работы необходимы:
1. Встряхивающая машина;
2. Конические колбы ёмкостью 200 мл – 12 шт. (двойной комплект);
3. Стеклянные воронки – 6 шт.;
4. Фильтровальная бумага;
5. Цилиндр ёмкостью 50 мл;
6. Бюретка стеклянная;
7. Аналитические пипетки ёмкостью 5, 10, 20 мл;
8. Активированный уголь (6 таблеток массой по 0,25 г);
9. Растворы уксусной кислоты (на рабочем месте);
10. Раствор едкого натра с=0,1 кмоль/м3;
11. Индикатор: фенолфталеин.
В шесть конических колб мерным цилиндром отмерить и налить по 50 мл растворы уксусной кислоты, концентрации которых указаны в таблице. В каждую колбу вносят навеску адсорбента (одну растертую в порошок таблетку активированного угля). Все колбы одновременно перемешивать на встряхивающей машине в течение 30 минут, или оставить на 1 час, периодически взбалтывая растворы до установления адсорбционного равновесия в системе. Для этого встряхивающую машину включить в сеть, медленно и плавно перевести «флажок» ЛАТРа на значение «60». По окончании перемешивания «флажок» ЛАТРа плавно перевести до значения «0» и выключить машину из сети.
Затем растворы отфильтровать, отделяя адсорбент. Из полученныхфильтратов отобрать на титрование определенные объёмы кислоты, указанные в таблице.
Их титровать раствором щёлочи концентрацией 0,1 кмоль/м3 в присутствии фенолфталеина(1-2 капли) до слабо-розового окрашивания.
Таблица 1
Дата добавления: 2020-11-18; просмотров: 395;











