Обработка результатов эксперимента
Определить равновесную концентрацию ср уксусной кислоты в растворах после адсорбции:
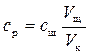 . (10)
. (10)
Вычислить величину адсорбции А для каждого раствора уксусной кислоты по формуле:
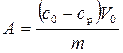 , (11)
, (11)
где А - величина адсорбции, кмоль/кг;
со и ср концентрация адсорбата до и после адсорбции, кМоль/м3,
V0 - объём раствора до адсорбции, м;
m - масса адсорбента, кг.
1. Вычислить функции, приведённые в таблице, полученные результаты занести в таблицу.
2. Построить график изотермы адсорбции 
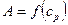 .
.
3. Построить график зависимости 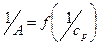 (уравнение 6) для определения величины А¥ и константы адсорбционного равновесия К.
(уравнение 6) для определения величины А¥ и константы адсорбционного равновесия К.
4. По величине предельной адсорбции А¥ рассчитать удельную поверхность адсорбента Вуд (уравнение 9), записать значение на графике прямой.
5. Построить график линейной зависимости 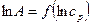 (уравнение 8 ), определить постоянные параметры К и n.
(уравнение 8 ), определить постоянные параметры К и n.
Используя полученные данные, сделать вывод.
Ионный обмен
Цель работы: определение концентрационной константы обмена, изучение зависимости Г=f(c).
Изменение электролитного состава дисперсионной среды приводит к определенным, более или менее глубоким изменениям в структуре двойного слоя и сопровождается ионным обменом - переходом части вновь вводимых ионов в двойной слой и выходом в объем раствора части ионов, находившихся ранее в двойном слое. Характер изменения двойного слоя определяется свойствами добавляемых в раствор противоионов и коионов, в том числе их способностью к вхождению в состав твердой фазы, к специфической адсорбции на поверхности раздела фаз и соотношением зарядов вновь вводимых ионов и ионов, образующих двойной слой (в основном противоионов). Можно выделить два крайних случая - индифферентные электролиты, которые не изменяют j0-потенциал, и неиндифферентные электролиты, способные к его изменению. Последние обычно содержат ионы, способные входить в состав решетки твердого тела, в том числе при изоморфном замещении ионов, образующих решетку твердого тела.
В зависимости от природы вводимого электролита ионный обмен затрагивает различные части двойного электрического слоя: как его диффузную часть, так и адсорбционную и даже слой потенциалопределяющих ионов. Наиболее легко обмениваются ионы диффузного слоя.
Закономерности ионного обмена для индифферентных электролитов в самом общем случае описываются уравнением Никольского, которое для достаточно концентрированных (неидеальных) растворов имеет вид:
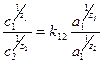 , (12)
, (12)
где а1, а2и с1, с2, z1, z2 -активности (в растворе), концентрации (в двойном слое) и заряды соответствующих ионов, константа обмена ионов k12).
Дисперсные системы, состоящие из положительно заряженных частиц или макромолекул, окруженных диффузным слоем, образованным анионами, способными к обмену, называют анионитами; а с отрицательными частицами, обменивающими катионы, - катионитами. В высокодисперсных системах изменение состава слоя потенциалопределяющих ионов или слоя противоионов может приводить к существенному изменению состава мицеллы.
При обменной молекулярной адсорбции из растворов происходит перераспределение компонентов между объёмом раствора и поверхностным слоем. Обмен одного компонента в объёме раствора или поверхностном слое на другой можно представить как квазихимическую обменную реакцию между компонентами В (компонент1) и С (компонент 2)с константой обмена Ка
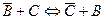 ;
; 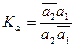 13)
13)


 где В и С - компоненты, находящиеся в поверхностном слое; ai и аi - активности компонентов в поверхностном слое и объеме соответственно.
где В и С - компоненты, находящиеся в поверхностном слое; ai и аi - активности компонентов в поверхностном слое и объеме соответственно.
Если выразить активность компонентов через молярную долю х и коэффициент активности g, то уравнение (2) примет вид
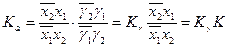 (14)
(14)
где Кg - коэффициент, учитывающий изменения коэффициентов активности с изменением состава раствора (их отклонения от единицы); К - концентрационная константа обмена.
Константа К равна
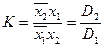 (15)
(15)
 где
где 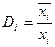 - коэффициент распределения компонента между поверхностным слоем и объемом раствора; хi, хi - молярные доли компонента в поверхностном слое и в объеме раствора.
- коэффициент распределения компонента между поверхностным слоем и объемом раствора; хi, хi - молярные доли компонента в поверхностном слое и в объеме раствора.
Выразим молярную долю компонента 1 через молярную долю компонента 2( 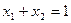 ), тогда уравнение (15)примет вид
), тогда уравнение (15)примет вид
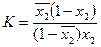 (16)
(16)
Из этого уравнения найдем молярную долю компонента 2в поверхностном слое:
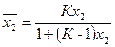 (17)
(17)
 Рис. 8. Изотермы адсорбции из бинарного раствора в соответствии с уравнением (17): 1- К>1;2 – K<1; 3 - иллюстрация адсорбционной азеотропии
Рис. 8. Изотермы адсорбции из бинарного раствора в соответствии с уравнением (17): 1- К>1;2 – K<1; 3 - иллюстрация адсорбционной азеотропии
| - общее уравнение изотермы адсорбции из бинарных растворов с константой обмена.
Константа К является также коэффициентом разделения компонентов 1 и 2, т. е. отношением коэффициентов распределения второго и первого компонентов (15).Концентрационная константа обмена равна термодинамической константе обмена Ка только при условии 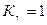 . Если коэффициенты активности компонентов и соответственно Кgизменяются при изменении состава раствора, то не останется постоянной и К (3).Выражение концентраций в молярных долях позволяет графически представить изотерму при всех соотношениях компонентов, даже для неограниченно смешивающихся веществ (рис. 8). . Если коэффициенты активности компонентов и соответственно Кgизменяются при изменении состава раствора, то не останется постоянной и К (3).Выражение концентраций в молярных долях позволяет графически представить изотерму при всех соотношениях компонентов, даже для неограниченно смешивающихся веществ (рис. 8).
|
Проведем анализ зависимости (17). Если х2®0, то при любом значении К в знаменателе уравнения (17) можно пренебречь величиной (К-1)х2, и тогда изотерма приобретает вид закона Генри:
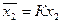 . (18)
. (18)
 Поэтому в начале изотермы наблюдается линейная зависимость х2 от х2. При К>1 изотерма идет выше диагонали (рис. 1, кривая 1), при K<1 — ниже диагонали (рис. 8, кривая 2), при K= 1 - по диагонали.
Поэтому в начале изотермы наблюдается линейная зависимость х2 от х2. При К>1 изотерма идет выше диагонали (рис. 1, кривая 1), при K<1 — ниже диагонали (рис. 8, кривая 2), при K= 1 - по диагонали.
Проанализируем ход изотермы адсорбции из растворов с ростом концентрации при К>>1 и К<<1. При таких условиях можно не учитывать влияние изменения Кg. Если К>>1, то разность (К-1) имеет положительный знак и уравнение (17) принимает вид, аналогичный уравнению Ленгмюра:
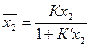 . (19)
. (19)
где К'» К при K>>1.
 Из соотношения (19) следует, что знаменатель растет с увеличением концентрации компонента 2в объеме, и первоначальный прямолинейный участок зависимости х2 от х2 переходит в кривую выпуклой формы - рост величины адсорбции замедляется с увеличением концентрации компонента в объеме (рис. 8, кривая 1).
Из соотношения (19) следует, что знаменатель растет с увеличением концентрации компонента 2в объеме, и первоначальный прямолинейный участок зависимости х2 от х2 переходит в кривую выпуклой формы - рост величины адсорбции замедляется с увеличением концентрации компонента в объеме (рис. 8, кривая 1).
Если K<<;1, то К-1<0, и уравнение (17) переходит в соотношение:
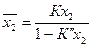 . (20)
. (20)
Следовательно, при увеличении концентрации компонента 2в объеме знаменатель уравнения (20)уменьшается и более быстро возрастает величина адсорбции (см. рис. 8,кривая 2). Зависимость приобретает вид вогнутой кривой. Изотермы при К>1 и К<1 сходятся в точке, для которой справедливо соотношение
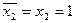 . (21)
. (21)
Оно также следует из уравнения (17).
Если константа К мало отличается от единицы, т. е. величины сродства компонентов к адсорбенту близки, то на форму изотермы могут влиять изменения коэффициента Kg. Наиболее интересной зависимостью является изменение знака величины (К-1) с изменением состава раствора. Например, при малых концентрациях изотерма может проходить выше диагонали, а при больших - ниже ее, пересекая в точке K=1. Это соответствует проявлению адсорбционной азеотропии.
Молярные доли компонентов в поверхностном слое практически определить так же трудно, как и абсолютную величину адсорбции А. Если один из компонентов адсорбируется значительно лучше другого, то можно принять величину адсорбции А равной величине гиббсовской адсорбции Г. Она экспериментально определяется по разности количества вещества в объеме до и после адсорбции.
Дата добавления: 2020-11-18; просмотров: 203;










