Адиабатический процесс. Политропный процесс
Адиабатическим называется процесс, при котором отсутствует теплообмен ( 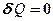 ) между системой и окружающей средой. К адиабатическим процессам можно отнести все быстропротекающие процессы. Например, адиабатическим процессом можно считать процесс распространения звука в среде, так как скорость распространения звуковой волны настолько велика, что обмен энергией между волной и средой произойти не успевает. Адиабатические процессы применяются в двигателях внутреннего сгорания (расширение и сжатие горючей смеси в цилиндрах), в холодильных установках и т. д.
) между системой и окружающей средой. К адиабатическим процессам можно отнести все быстропротекающие процессы. Например, адиабатическим процессом можно считать процесс распространения звука в среде, так как скорость распространения звуковой волны настолько велика, что обмен энергией между волной и средой произойти не успевает. Адиабатические процессы применяются в двигателях внутреннего сгорания (расширение и сжатие горючей смеси в цилиндрах), в холодильных установках и т. д.
Из первого начала термодинамики ( 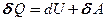 ) для адиабатического процесса следует, что
) для адиабатического процесса следует, что
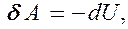 (55.1)
(55.1)
т. е. внешняя работа совершается за счет изменения внутренней энергии системы.
Используя выражения (52.1) и (53.4), для произвольной массы газа перепишем уравнение (55.1) в виде
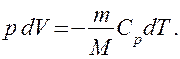 (55.2)
(55.2)
Продифференцировав уравнение состояния для идеального газа 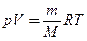 , получим
, получим
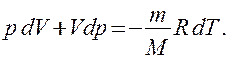 (55.3)
(55.3)
Исключим из (55.2) и (55.3) температуру Т:
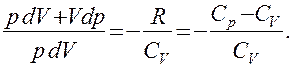
Разделив переменные и учитывая, что 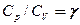 (см. (53.8)), найдем
(см. (53.8)), найдем
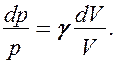
Интегрируя это уравнение в пределах от 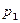 до
до 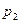 и соответственно от
и соответственно от 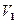 до
до 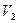 , а затем потенцируя, придем к выражению
, а затем потенцируя, придем к выражению
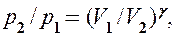 или
или 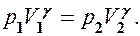
Так как состояния 1 и 2 выбраны произвольно, то можно записать
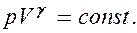 (55.4)
(55.4)
Полученное выражение естьуравнение адиабатического процесса, называемое такжеуравнением Пуассона.
Для перехода к переменным Т, V или р, Т исключим из (55.4) с помощью уравнения Клапейрона — Менделеева
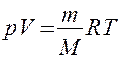
соответственно давление или объем:
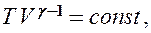 (55.5)
(55.5)
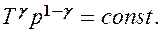 (55.6)
(55.6)
Выражения (55.4) — (55.6) представляют собой уравнения адиабатического процесса. В этих уравнениях безразмерная величина (см. (53.8) и (53.2))
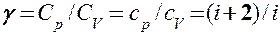 (55.7)
(55.7)
называетсяпоказателем адиабаты (или коэффициентом Пуассона). Для одноатомных газов (Ne, He и др.), достаточно хорошо удовлетворяющих условию идеальности, i = 3, g = 1,67. Для двухатомных газов (Н2, N2, O2 и др.) i = 5, g = 1,4. Значения g, вычисленные по формуле (55.7), хорошо подтверждаются экспериментом.
Диаграмма адиабатического процесса (адиабата) в координатах р, V изображается гиперболой (рис.83). На рисунке видно, что адиабата (pVg = const) более крута, чем изотерма (pV = const). Это объясняется тем, что при адиабатическом сжатии 1—3 увеличение давления газа обусловлено не только уменьшением его объема, как при изотермическом сжатии, но и повышением температуры.
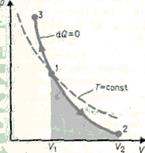
Рис. 83
Вычислим работу, совершаемую газом в адиабатическом процессе. Запишем уравнение (55.2) в виде
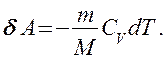
Если газ адиабатически расширяется от объема V1 до V2, то его температура уменьшается от Т1 до T2 и работа расширения идеального газа
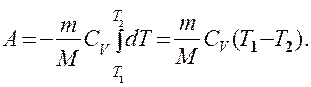 (55.8)
(55.8)
Применяя те же приемы, что и при выводе формулы (55.5), выражение (55.8) для работы при адиабатическом расширении можно преобразовать к виду
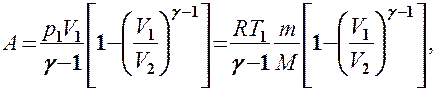
где 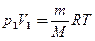 .
.
Работа, совершаемая газом при адиабатическом расширении 1—2 (определяется площадью, выполненной в цвете на рис. 83), меньше, чем при изотермическом. Это объясняется тем, что при адиабатическом расширении происходит охлаждение газа, тогда как при изотермическом — температура поддерживается постоянной за счет притока извне эквивалентного количества теплоты.
Рассмотренные изохорный, изобарный, изотермический и адиабатический процессы имеют общую особенность — они происходят при постоянной теплоемкости. В первых двух процессах теплоемкости соответственно равны СV и Ср, в изотермическом процессе (dT = 0) теплоемкость равна ± 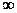 , в адиабатическом (dQ = 0) теплоемкость равна нулю. Процесс, в котором теплоемкость остается постоянной, называетсяполитропным.
, в адиабатическом (dQ = 0) теплоемкость равна нулю. Процесс, в котором теплоемкость остается постоянной, называетсяполитропным.
Исходя из первого начала термодинамики при условии постоянства теплоемкости (C = const) можно вывести уравнение политропы:
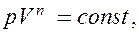 (55.9)
(55.9)
где n = (С—Ср)/(С— СV) — показатель политропы. Очевидно, что при С = 0, п = g из (55.9) получается уравнение адиабаты; при С = 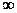 , п = 1 — уравнение изотермы; при С = Ср, n = 0 — уравнение изобары; при С = СV, n = ±
, п = 1 — уравнение изотермы; при С = Ср, n = 0 — уравнение изобары; при С = СV, n = ± 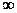 — уравнение изохоры. Таким образом, все рассмотренные процессы являются частными случаями политропного процесса.
— уравнение изохоры. Таким образом, все рассмотренные процессы являются частными случаями политропного процесса.
Дата добавления: 2016-07-27; просмотров: 2158;











