Из-за «стекания» заряда эти преобразователи используются только для измерения быстро изменяющихся величин (переменных усилий, давлений, вибраций, ускорений и т. д.)
§ 16. Гальванические преобразователи (преобразователи рН – метров).
Реакция растворов (кислая, нейтральная, щелочная) зависит от концентрации водородных ионов, которую можно определить по разности потенциалов на электродах, опущенных в исследуемый раствор.
Рассмотрим зависимость свойств раствора от концентрации водородных ионов.
Дистиллированная вода имеет слабую, но вполне определённую электрическую проводимость, что объясняется ионизацией воды, которая происходит по схеме
 H2O H+ + OH-
H2O H+ + OH-
При равновесии процессов диссоциации (образования ионов) и воссоединения из ионов молекул воды произведение концентраций положительных [Н+] и отрицательных [ОН-] ионов в воде практически постоянно (при постоянной температуре) и равно:
[Н+]*[ОН-] = 10-14.
Так как из одной молекулы воды получается один положительный и один отрицательный ион, то в чистой воде:
[Н+] = [ОН-] = 10-7.
Таким образом, растворы, в которых число ионов водорода [H+] и гидроксила [ОН-] одинаково, являются нейтральными.
Если в воде растворить вещество (кислоту), образующее при диссоциации ионы [H+], то концентрация [H+] в растворе увеличится. При этом согласно закону действующих масс концентрация [ОН-] станет меньше, чем в нейтральном растворе, за счет воссоединения части образовавшихся ионов [H+] с ионами [ОН-] именно в таком количестве, чтобы выполнялось условие постоянства произведения концентраций ионов [H+] и [ОН-].
При растворении в воде щелочей концентрация [ОН-]становится больше, а концентрация [H+] соответственно уменьшается.
Таким образом, концентрацией водородных ионов можно характеризовать любые растворы: кислые, нейтральные и щелочные.
Концентрацию водородных ионов удобно численно характеризовать водородным показателем:
pН =-1g[Н+].
Если, например, [Н+] = 10-5, то рН = 5. Для измерения концентрации водородных ионов, т. е. для определения рН, широко применяется метод, основанный на измерении электродного (пограничного) потенциала.
Если какой-либо металл погрузить в раствор, содержащий его одноименные ионы, то металл приобретает потенциал, зависящий от концентрации его ионов в растворе, в соответствии с уравнением
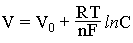
где V0 - потенциал электрода при концентрации его ионов в растворе, равной единице; R - газовая постоянная; T - абсолютная температура; n - валентность ионов металла; P - число Фарадея; С - концентрация в растворе ионов металла электрода.
Аналогично ведет себя и водород.
Для получения электродного потенциала между водородом и раствором, содержащим ионы [Н+], необходимо иметь так называемый водородный электрод. Водородный электрод можно создать, воспользовавшись свойством водорода адсорбироваться на поверхности платины, иридия и палладия. Обычно водородным электродом служит покрытый платиновой чернью платиновый электрод, к которому непрерывно подводится газообразный водород. Потенциал такого электрода зависит от концентрации водородных ионов в растворе.
Практически измерить абсолютное значение пограничного потенциала нельзя; его можно измерить относительно другого потенциала. Поэтому гальванический преобразователь всегда состоит из двух полуэлементов, электрически соединенных друг с другом: рабочего (измерительного) полуэлемента, представляющего собой исследуемый раствор с электродом, и сравнительного (вспомогательного, образцового) полуэлемента с неизменным пограничным потенциалом, состоящего из электрода и раствора с постоя иной концентрацией.
В качестве сравнительного полуэлемента может быть использован водородный электрод с нормальной постоянной концентрацией водородных ионов. При промышленных измерениях применяется более удобный сравнительный каломельный электрод.
На рис. показано устройство гальванического преобразователя для измерения концентрации водородных ионов. Образцовым полуэлементом служит каломельный электрод. Он представляет собой стеклянный сосуд 4, на дно которого помещено небольшое количество ртути, а поверх нее - паста из каломели (Нg2Сl2). Сверху пасты налит раствор хлористого калия (КС1). Потенциал возникает на границе каломель - ртуть. Для контакта с ртутью в дно сосуда вставлен платиновый электрод 5.
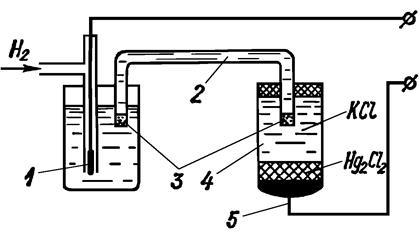 Потенциал каломельного электрода зависит от концентрации ртути в каломели, а концентрация ионов ртути, в свою очередь, зависит от концентрации ионов хлора в растворе хлористого калия. В исследуемый раствор погружен водородный электрод 3. Оба полуэлемента соединены электролитическим ключом, представляющим собой трубку, обычно заполненную насыщенным раствором КС1 и закрытую полупроницаемыми пробками 3. Э.д.с. такого преобразователя является функцией рН.
Потенциал каломельного электрода зависит от концентрации ртути в каломели, а концентрация ионов ртути, в свою очередь, зависит от концентрации ионов хлора в растворе хлористого калия. В исследуемый раствор погружен водородный электрод 3. Оба полуэлемента соединены электролитическим ключом, представляющим собой трубку, обычно заполненную насыщенным раствором КС1 и закрытую полупроницаемыми пробками 3. Э.д.с. такого преобразователя является функцией рН.
При измерении рН с помощью гальванических преобразователей необходимо вносить поправки на влияние температуры.
§ 17. Кулонометрические преобразователи– основаны на явлении электролиза. Связь между выделившимся веществом и количеством электричества, пропущенным через
преобразователь, определяется уравнением:
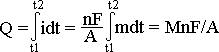
, где М – масса вещества, n – валентность ионов,
F = 96484,5 Кл/моль – постоянная Фарадея,
А – молекулярная масса вещества.
Кулонометрические преобразователи получили наиболее широкое применение для измерения времени работы различных электротехнических устройств.
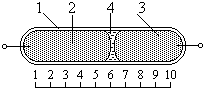 На рис. изображен ртутно-капиллярный кулонометрический преобразователь, состоящий из капиллярной трубки 1 диаметром 0,2 – 0,3 мм, заполненной двумя столбиками ртути 2 и 3, разделёнными каплей раствора солей ртути 4 (например, HgI2). При прохождении через преобразователь постоянного тока происходит электролиз, в результате которого ртуть на аноде растворяется (окисляется): Hg + 4I- → HgI4-- + 2e, а на катоде – восстанавливается: HgI4 + 2e → Hg + 4I. В результате электролиза ртуть с анода переносится на катод, что приводит к перемещению капли электролита вдоль капилляра на величину Δl, пропорциональную интегралу от тока за время интегрирования. Состав электролита при этом остаётся неизменным. Уравнение преобразователя можно представить в виде:
На рис. изображен ртутно-капиллярный кулонометрический преобразователь, состоящий из капиллярной трубки 1 диаметром 0,2 – 0,3 мм, заполненной двумя столбиками ртути 2 и 3, разделёнными каплей раствора солей ртути 4 (например, HgI2). При прохождении через преобразователь постоянного тока происходит электролиз, в результате которого ртуть на аноде растворяется (окисляется): Hg + 4I- → HgI4-- + 2e, а на катоде – восстанавливается: HgI4 + 2e → Hg + 4I. В результате электролиза ртуть с анода переносится на катод, что приводит к перемещению капли электролита вдоль капилляра на величину Δl, пропорциональную интегралу от тока за время интегрирования. Состав электролита при этом остаётся неизменным. Уравнение преобразователя можно представить в виде:
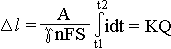
, где A, γ, n – молекулярная масса, плотность и валентность ртути
S – площадь капилляра
Установка указателя в нулевое положение производится изменением направления тока через преобразователь. Считывание показаний производится визуально по переднему или заднему менискам капли или с помощью считывающих устройств.
Дата добавления: 2020-10-14; просмотров: 379;











