Лекция №2: Основные законы общей химии. Стехиометрия. Химический эквивалент.
1. Закон постоянства состава. Соотношение масс элементов, формирующих данное соединение, постоянно и не зависит от способа получения этого соединения.
2. Закон кратных отношений. Установлен Дальтоном в 1803г. В случае, когда два элемента образуют между собой несколько химических соединений, тогда имеет место отношение массы одного из элементов, приходящееся в этих соединениях на одну и ту же массу другого, как небольших целых чисел. Таким образом, элементы способны входить в состав соединений только в определенных пропорциях. Открытие этого закона явилось подтверждением атомной теории строения вещества. Только теперь идеи М.В. Ломоносова о строении вещества получили опытное подтверждение, и разработка атомно-молекулярного учения получила своё дальнейшее развитие.
Законы постоянства состава и кратных отношений не носят всеобщего характера, в отличии, например, от закона сохранения массы, основательность которого доказывается открытиями, сделанными после его установления. Дело в том, что после открытия изотопов получил подтверждение факт о постоянстве соотношения между массами элементов, образующих данное вещество, но только при условии постоянства изотопного состава этих элементов. Так, например, тяжелая вода содержит порядка 20% по массе водорода, тогда как обычная – только около 11%. Закон кратных отношений неприменим и в случае соединений переменного состава, открытых академиком Н.С. Курнаковым в начале ХХ века (пример: оксиды титана переменного состава TiO1,46-1,56 и TiO1,9-2,0), а также в случае, когда молекула вещества состоит из большого числа атомов (например, углеводороды состава С20Н42 и С21Н44).
3. Закон объёмных отношений. Этот закон в качестве обобщения вывел французский ученый Гей-Люссак (второе название закона – «химический»). Объёмы газов, участвующих в акте химического взаимодействия, относятся друг к другу и к объёмам образующихся газообразных продуктов реакции как небольшие целые числа. Так, например, при взаимодействии 2 объёмов водорода и 1 объёма кислорода, образуются 2 объёма водяного пара.
4. Закон Авогадро. Установлен итальянским физиком Авогадро в 1811 г. Одинаковые объемы любых газов, отобранные при одной температуре и одинаковом давлении, содержат одно и тоже число молекул. Таким образом, можно сформулировать понятие количества вещества: 1 моль вещества содержит число частиц, равное 6,02*1023 (называемое постоянной Авогадро) или содержит столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится атомов в 12г изотопа углерода 12С. Следствием этого закона является то, что 1 моль любого газа занимает при нормальных условиях (Р0 =101,3кПа и Т0=298К) объём, равный 22,4л.
Под относительной атомной массой элемента понимают массу его атома, выраженную в атомных единицах массы (а.е.м.). В качестве относительной молекулярной массы элемента понимают массу его молекулы, выраженную в атомных единицах массы. Масса 1 моль данного вещества называется его мольной массой (выражается в г/моль). Относительной плотностью первого газа по отношению ко второму называется отношение массы первого газа к массе того же объёма второго газа, взятого при одной температуре и одинаковом давлении.
Под эквивалентом элемента понимают такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Масса 1 эквивалента элемента называется его эквивалентной массой. Эквивалент водорода ЭН всегда равен 1, а эквивалент кислорода ЭО=8.
Эквивалент элемента равен: Эм=  , где: М – мольная масса элемента; СО – степень окисления элемента (валентность) в соединении.
, где: М – мольная масса элемента; СО – степень окисления элемента (валентность) в соединении.
Эквивалент кислоты равен: Эм= 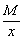 , где: М – мольная масса кислоты; х – основность кислоты.
, где: М – мольная масса кислоты; х – основность кислоты.
Эквивалент основания равен: Эм= 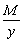 , где: М – мольная масса основания; у – кислотность основания.
, где: М – мольная масса основания; у – кислотность основания.
Эквивалент соли равен: Эм= 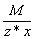 , где: М – мольная масса соли; z – валентность катиона; х – количество атомов катиона в соединении.
, где: М – мольная масса соли; z – валентность катиона; х – количество атомов катиона в соединении.
Примеры:эквивалент кислорода равен: Эо= 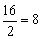 г-экв; эквивалент угольной кислоты Н2СО3 равен: ЭН2СО3=
г-экв; эквивалент угольной кислоты Н2СО3 равен: ЭН2СО3= 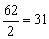 г-экв; эквивалент едкого натра NaOH равен: ЭNaOH=
г-экв; эквивалент едкого натра NaOH равен: ЭNaOH=  г-экв; эквивалент хлорида кальция CaCl2 равен: ЭCaCl2=
г-экв; эквивалент хлорида кальция CaCl2 равен: ЭCaCl2=  г-экв.
г-экв.
Закон эквивалентов. Отношение масс (или объёмов) взаимодействующих друг с другом веществ прямо пропорционально их эквивалентным массам (объёмам). Математически это можно записать следующим образом:
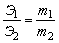 , где Э1,Э2 – эквиваленты (эквивалентные массы) элементов; m1,m2 – реальные массы (не мольные массы) веществ, например в граммах.
, где Э1,Э2 – эквиваленты (эквивалентные массы) элементов; m1,m2 – реальные массы (не мольные массы) веществ, например в граммах.
Приближенное значение мольной массы атомов элемента позволяет определить правило Дюлонга и Пти: Атомная теплоёмкость большинства простых веществ в твёрдом состоянии лежит в пределах 22-29 Дж/(моль*К) [в среднем около 26 Дж/(моль*К)]. Отсюда следует, что разделив 26 на удельную теплоёмкость простого вещества, легко определить приближённое значение мольной массы атомов соответствующего элемента.
Понятие валентности возникло в химии в середине 19 века. Д.И. Менделеев установил связь между валентностью элемента и его положением в периодической системе. Валентность элемента – это способность его атомов соединяться с другими атомами в определённых соотношениях. Способность атомов данного элемента соединяться друг с другом или с атомами других элементов может выражаться и другими способами – ковалентностью (число химических связей, образуемых атомом данного соединения) или координационным числом (число атомов, непосредственно окружающих данный атом).
Дата добавления: 2020-10-14; просмотров: 491;











