Эстафета длиной в девяносто лет
|
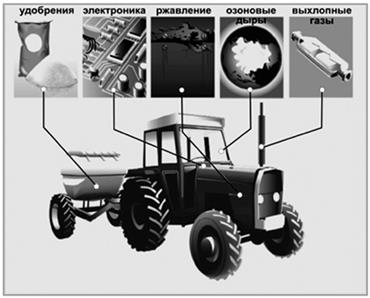
| Конкретные примеры применения результатов работ Г. Эртля |
Премированная работа связано с производством удобрений.

| 
|
| Фриц Габер (1868–1934) | Карл Бош (1874–1940) |
Крупной победой химии считают созданный немецкими химиками Ф. Габером и К.Бошем процесс, позволяющий превратить атмосферный азот в смеси с водородом в аммиак:
N2 + 3H2 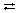 2NH3.
2NH3.
Процесс проходит в присутствии катализатора – металлического железа с примесями оксидов алюминия и калия – при температуре 400–600 °С и давлении до 1000 атмосфер. Найти катализатор оказалось совсем непросто. Для этого Габер испробовал несколько тысяч (!) различных соединений, в результате решение очень остро назревшей проблемы было найдено. Скромная экспериментальная установка Габера со временем превратилась в крупные заводы по производству аммиака. За создание этого процесса Габер был удостоен в 1918 г. Нобелевской премии по химии (К.Бош получил Нобелевскую премию по химии позже, в 1931 г., за развитие методов высокого давления в химии).

|
| Экспериментальная установка Ф.Габера |
Итак, главная задача – химически связать атмосферный азот. Далее полученный аммиак каталитически окисляют до оксидов азота, в конечном итоге получают азотную кислоту и нитраты, столь необходимые всем упомянутым ранее производствам. Несмотря на то, что условия каталитического синтеза аммиака за долгие годы были всесторонне изучены, все еще оставалось неясным, как именно протекает процесс.
За решение этой задачи взялся Г.Эртль, который волею судьбы оказался сотрудником института, носящего имя Фрица Габера. Впрочем, такая преемственность в направлении исследований, скорее всего, не случайна, и эстафетная палочка, представляющая собой процесс получения аммиака, спустя почти девяносто лет перешла из рук одного нобелевского лауреата к другому.
Эртль исследовал поведение молекул азота на поверхности чистого железа и обнаружил, что эти молекулы вначале адсорбируются (иными словами, прилипают к поверхности), а затем частично распадаются на атомы, т.е. диссоциируют: N2 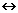 2N, этот процесс проходит крайне медленно. Точно так же на поверхности железа распадаются на атомы молекулы водорода, но этот процесс, как установил Эртль в предыдущих исследованиях, проходит заметно легче. Самая медленная стадия, лимитирующая весь процесс синтеза аммиака, т. е. определяющая его итоговую скорость, – диссоциация молекул азота.
2N, этот процесс проходит крайне медленно. Точно так же на поверхности железа распадаются на атомы молекулы водорода, но этот процесс, как установил Эртль в предыдущих исследованиях, проходит заметно легче. Самая медленная стадия, лимитирующая весь процесс синтеза аммиака, т. е. определяющая его итоговую скорость, – диссоциация молекул азота.
Итак, первичная стадия была установлена. Затем Эртль стал изучать процесс на реальном катализаторе: железо, содержащее в качестве примеси оксид калия. После проведения процесса и удаления образовавшегося аммиака на поверхности катализатора оставались только атомы азота. Оказалось, что чем выше было давление водорода в процессе синтеза, тем меньше оставалось на поверхности адсорбированных атомов азота, а количество адсорбированных молекул азота практически не менялось. Эртль сделал вывод, что синтез проходит с участием отдельных атомов N, а не молекул N2. Ранее полагали, что в реакции участвуют двухатомные молекулы. Если бы водород реагировал не с атомарным, а молекулярным азотом, то неизменным было бы содержание атомарного азота при различных давлениях водорода. Рассуждения простые и достаточно строгие.
Для того чтобы отличить друг от друга находящиеся на поверхности атомарный и молекулярный водород, Эртль использовал современные спектральные методы, которые позволяют анализировать излучение, испускаемое возбужденными электронами при возвращении на исходные орбитали. Другой способ, который он использовал, состоял в бомбардировке поверхности электронами, что позволяло определить текстуру поверхности и соответственно «увидеть», где находятся молекулы или атомы. Именно поэтому необходимо было исследовать исключительно чистую исходную поверхность, иначе вся картина оказалась бы сильно искаженной и «трудно читаемой».
Детально исследуя процесс, он установил, что присоединение атомов водорода проходит ступенчато, т.е. вначале присоединяется один атом, затем два, потом три:
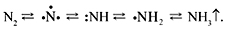
Напомним, что стадии обратимы. Точками у атомов азота обозначают неспаренные электроны, показывая таким образом, что на промежуточных стадиях образуются радикалы. Самая медленная стадия, определяющая общую скорость процесса, первая – распад молекулы азота на атомы. Оказалось, что наименее прочно адсорбируется на поверхности катализатора молекула аммиака, что и позволяет ей легко отделяться от катализатора (схема).
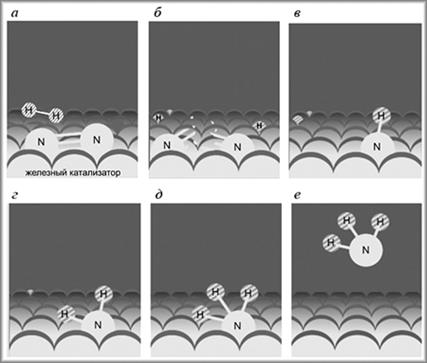
|
| Стадии синтеза аммиака на поверхности железного катализатора: а – адсорбция; б – диссоциация с образованием радикалов; в, г, д – присоединение атомов водорода к атому азота; е – отделение молекулы аммиака от поверхности катализатора |
Эртлю удалось не только качественно описать всю схему, но и охарактеризовать ее количественно, т.е. определить энергетические параметры (тепловые эффекты) на каждой стадии. При изучении первой стадии (диссоциация молекулы азота на атомы) особых трудностей не возникло, поскольку она протекает сравнительно медленно, но зато остальные стадии протекали столь быстро, что «разглядеть» их не удавалось. Эртль нашел выход – стал изучать эти стадии при протекании реакции в обратном направлении (такое происходит при понижении давления). Удалось также объяснить «стимулирующую» роль примесей оксида калия в металлическом железе: эта добавка облегчает протекание самой важной стадии – распада молекул азота на атомы, делая процесс энергетически более выгодным. Итак, Эртль сумел зафиксировать все промежуточные стадии процесса синтеза аммиака и количественно их охарактеризовать – определить скорости этих реакций и их энергетические параметры.
Дата добавления: 2016-05-30; просмотров: 1989;











