КЛЕТОЧНАЯ ИНЖЕНЕРИЯ
Как отмечено в начале раздела, клеточной инженерией называют генетические манипуляции с изолированными клетками животных и растений. Эти манипуляции часто осуществляют in vitro, а главной целью они имеют получение генотипов этих организмов с заданными свойствами, в первую очередь, хозяйственно полезными. Что касается человека, то клеточная инженерия оказалась применимой к его половым клеткам.
Клеточная инженерия у человека
И животных
Предпосылкой к развитию клеточной инженерии у человека и животных явилась разработка методов культивирования их соматических клеток на искусственных питательных средах, а также получение гибридов соматических клеток, включая межвидовые гибриды. В свою очередь, успехи в культивировании соматических клеток оказали влияние на изучение половых клеток и оплодотворение у человека и животных. Начиная с 60-х гг., в нескольких лабораториях мира были выполнены многочисленные эксперименты по пересадке ядер соматических клеток в яйцеклетки, искусственно лишенные ядер. Результаты этих экспериментов часто были противоречивы, но в целом они привели к открытию способности клеточных ядер обеспечивать нормальное развитие яйцеклеток (см. гл. VIII).
На основе результатов изучения развития оплодотворенных яйцеклеток в 60-е гг. были начаты также исследования по выяснению возможности оплодотворения яйцеклеток вне организма матери. Очень быстро эти исследования привели к открытию возможности оплодотворения яйцеклеток сперматозоидами в пробирке и дальнейшего развития образованных таким путем зародышей при имплантации их в матку женщины. Дальнейшее совершенствование разработанных в этой области методов привело к тому, что рождение «пробирочных» детей стало реальностью. Уже к 1981 г. в мире было рождено 12 детей, жизнь которым была дана в лаборатории, в пробирке. В настоящее время этот раздел клеточной инженерии получил большое распространение, а количество «пробирочных» детей составляет уже десятки тысяч. В нашей стране работы по получению «пробирочных» детей были начаты в 1986 г. В 1993 году была разработана методика получения монозиготных близнецов человека in vitro, путем разделения эмбрионов на блас-томеры и доращивания последних до 32 клеток, после чего они могли быть имплантированы в матку женщины.
Под влиянием результатов, связанных с получением «пробирочных» детей, у животных тоже была разработана технология, получившая название трансплантации эмбрионов. Она связана с разработкой способа индукции полиовуляции, способов искусственного оплодотворения яйцеклеток и имплантации зародышей в организм животных — приемных матерей. Суть этой технологии сводится к следующему. Высокопродуктивной корове вводят гормоны, в результате чего наступает полиовуляция, заключающаяся в созревании сразу 10—20 клеток. Затем яйцеклетки искусственно оплодотворяются мужскими половыми клетками в яйцеводе. На 7-8-й день зародышей вымывают из матки и трансплантируют в матки другим коровам (приемным матерям), которые затем дают жизнь телятам-близнецам. Телята наследуют генетический статус своих подлинных родителей.
Другой областью клеточной инженерии у животных является получение трансгенных животных. Наиболее простой способ получения таких животных заключается во введении в яйцеклетки исходных животных линейных молекул ДНК. Животные, развившиеся из оплодотворенных таким образом яйцеклеток, будут содержать в одной из своих хромосом копию введенного гена. Больше того, они и будут передавать этот ген по наследству. Более сложный способ получения трансгенных животных разработан на мышах, различающихся по окраске шерстного покрова и сводится к следующему. Вначале из организма беременной серой мыши извлекают четырехдневных зародышей и измельчают их на отдельные клетки. Затем из эмбриональных клеток извлекают ядра, переносят их в яйцеклетки черных мышей, предварительно лишенные ядер. Яйцеклетки черных мышей, содержащие чужие ядра, помещают в пробирки с питательным раствором для дальнейшего развития. Развившиеся из яйцеклетки черных мышей зародыши имплантируют в матки белых мышей. В выполненных по этой методике экспериментах от пяти белых мышей («приемных матерей») было получено 36 мышей, среди которых трое были серыми. Таким образом, в этих экспериментах удалось получить клон мышей с серой окраской шерстного покрова, т. е. клонировать эмбриональные клетки с заданными свойствами. В § 35 мы рассмотрели результаты оплодотворения искусственно лишенных ядер яйцеклеток овец ядерным материалом соматических клеток животных этого же вида. В частности, из яйцеклеток овец удаляли ядра, а затем в такие яйцеклетки вводили ядра соматических клеток (эмбриональных, плодовых или клеток взрослых животных), после чего оплодотворенные таким образом яйцеклетки вводят в матки взрослых овец. Рождающиеся ягнята оказались идентичными овце-донору. Как было отмечено в § 35, такое получение трансгенных животных представляет собой прямой путь клонирования животных с хозяйственно-полезными признаками, включая особей определенного пола.
Трансгенные животные получены также при использовании исходного материала, принадлежащего разным видам, в частности, известен способ передачи гена, контролирующего гормон роста, от крыс в яйцеклетки мышей, а также способ комбинирования блас-томеров овцы с бластомерами козы, что привело к получению гибридных животных (ковец). Эти эксперименты указывают на возможность преодоления видовой несовместимости на самых ранних этапах развития. Особенно заманчивые перспективы открываются (если видовая несовместимость будет преодолена полностью) на пути оплодотворения яйцеклеток одного вида ядрами соматических клеток другого вида. Речь идет о реальной перспективе получения хозяйственно-ценных гибридов животных, которых невозможно получить путем скрещиваний.
Следует отметить, что ядерно-трансплантационные работы еще не очень эффективны. Эксперименты, выполненные на земноводных и млекопитающих, в целом показали, что их результативность является небольшой, причем она зависит от несовместимости между донорскими ядрами и реципиентными овоцитами. Кроме того, препятствием на пути к успехам являются также образующиеся хромосомные аберрации в трансплантированных ядрах в ходе дальнейшего развития, которые сопровождаются гибелью трансгенных животных.
На стыке работ по изучению гибридизации клеток и иммуноло-гических исследований возникла проблематика, связанная с получением и изучением так называемых моноклональных антител. Как отмечено выше (см. § 96), антитела, продуцируемые организмом в ответ на введение антигена (бактерии, вирусы, эритроциты и т. д.), представляют собой белки, называемые иммуноглобулина-ми и составляющие фундаментальную часть защитной системы организма против возбудителей болезней. Но любое чужеродное тело, вводимое в организм, представляет собой смесь разных антигенов, которые будут возбуждать продукцию разных антител. Например, эритроциты человека обладают антигенами не только для групп крови А (II) и В (III), но и многими другими антигенами, включая резус-фактор. Далее, белки клеточной стенки бактерий или капси-да вирусов также могут действовать в качестве разных антигенов, вызывающих образование разных антител. В то же время лимфо-идные клетки иммунной системы организма обычно представлены клонами. Значит, даже только по этой причине в сыворотке крови иммунизированных животных антитела всегда представляют собой смесь, состоящую из антител, продуцируемых клетками разных клонов. Между тем для практических потребностей необходимы антитела только одного типа, т.е. необходимы так называемые моноспецифические сыворотки, содержащие антитела только одного типа, или, как их называют, моноклональные антитела.
В поисках методов получения моноклональных антител швейцарскими исследователями в 1975 г. был открыт способ получения гибридов между лимфоцитами мышей, иммунизированных тем или иным антигеном, и культивируемыми опухолевыми клетками костного мозга. Такие гибриды получили название «гибридомы». От «лим-фоцитарной» части, представленной лимфоцитом одного клона, одиночная гибридома наследует способность вызывать образование необходимых антител, причем одного типа, а благодаря «опухолевой (миэломной)» части она становится способной, как и все опухолевые клетки, бесконечно долго размножаться на искусственных питательных средах, давая многочисленную популяцию гибридом. На рис. 229 показана схема выделения клеточных линий, синтезирующих моноклональные антитела. Линии мышиных клеток, синтезирующих моноклональные антитела, выделяют путем слияния миеломных клеток с лимфоцитами из селезенки мыши, иммунизированной за пять дней до этого желаемым антигеном. Слияние клеток достигают смешиванием их в присутствии полиэтиленгликоля, который индуцирует слияние клеточных мембран, а затем в высеве их на питательную среду, позволяющую рост и размножение только гибридных клеток (гибридом). Размножение гибридомы разводят в жидкой среде, где они растут далее и секретируют антитела в культуральную жидкость, причем только одного типа, к тому же в неограниченных количествах. Эти антитела получили название моноклональных.
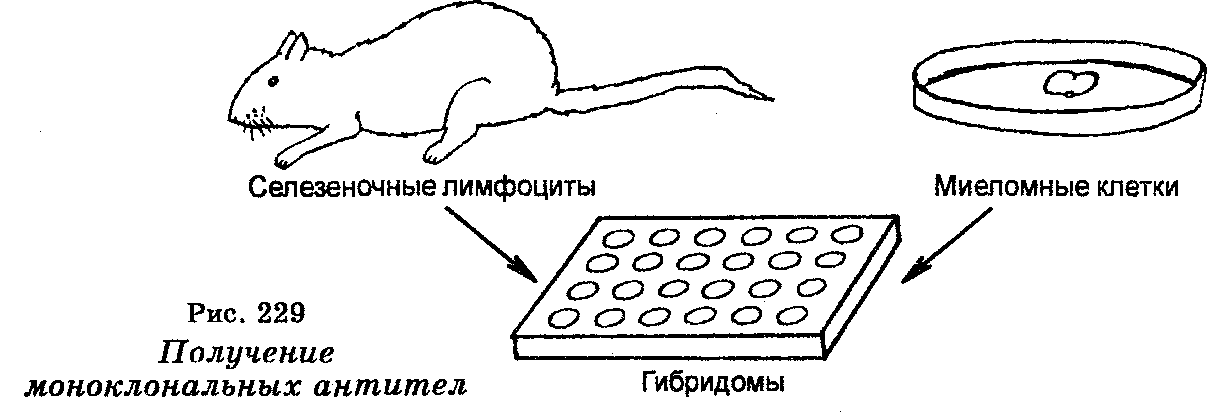
Чтобы повысить частоту образования антител, прибегают к клонированию гибридом, т. е. к селекции отдельных колоний гибридом, способных вызывать образование наибольшего количества антител желаемого типа. Моноклональные антитела нашли широкое применение в медицине для диагностики и лечения ряда болезней (см. § 115). В то же время важнейшее преимущество моноклональной технологии заключается в том, что с ее помощью могут быть получены антитела против материалов, которые невозможно очистить. Напротив, можно получить моноклональные антитела против клеточных (плазматических) мембран нейронов животных. Для этого мышей иммунизируют выделенными мембранами нейронов, после чего их селезеночные лимфоциты объединяют с миеломными клетками, а дальше поступают, как описано выше.
Дата добавления: 2016-05-30; просмотров: 4698;











