А. Отщепление С- и N-концевых пептидных последовательностей
Внеклеточные специфичные протеиназы, отщепляют на N- и С- концах последовательности аминокислот с молекулярной массой 20 и 30-35 кДа, соответственно. Образовавшуюся трехспиральную молекулу коллагена часто называют тропоколлагеном.
При низком уровне активности специфических протеиназ концевые пептиды не отщепляются, что препятствует дальнейшему формированию фибрилл коллагена и приводит к развитию синдрома Эйлерса-Данло-Русакова: снижению роста, искривлению позвоночника, частым вывихам, высокой растяжимости кожи.
Б.Формирование фибрилл незрелого коллагена
Образованные молекулы тропоколлагена содержат примерно 1000 аминокислотных остатков в каждой цепи и собираются в коллагеновые фибриллы, неотличимые по внешнему виду от вполне зрелых фибрилл, присутствующих в тканях. Образование фибрилл происходит вблизи клеточной поверхности, часто в глубоких складках плазматической мембраны, что может влиять на скорость и ориентацию молекул при сборке фибрилл. Особенностью структурной организации фибрилл является параллельное расположение тройных спиралей тропоколлагена, причем на стыках молекулы тропоколлагена не примыкают друг другу вплотную, между ними остаются промежутки длиной в 35-40 нм. При такой величине этого промежутка продольное расположение молекул повторяется через каждые пять рядов, так что, например, молекулы в рядах 1 и 6 лежат точно друг против друга.
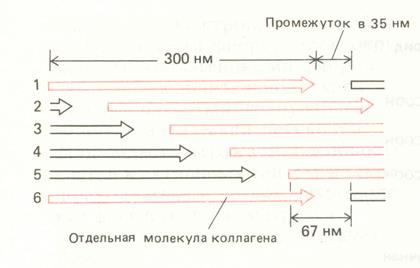
Молекулы сдвинуты относительно друг друга на ¼ своей длины, что составляет приблизительно 67 нм. В электронном микроскопе фиксированные и окрашенные фибриллы коллагена выглядят поперечно исчерченными с периодом 67 нм (см.схему). Такое расположение, по-видимому, максимально повышает прочность на растяжение и создает бороздки, которые в костной ткани, возможно, играют роль центров минерализации.
В.Окисление аминогрупп лизильных остатков до альдегидов и образование внутри- и межмолекулярных сшивок между полипептидными цепями
Образовавшиеся фибриллы не являются зрелыми, не обладают прочностью зрелых коллагеновых фибрилл, и требуется образование дополнительных связей, укрепляющих взаимодействие между молекулами коллагена. В дальнейшем прочность фибрилл сильно возрастает благодаря созданию ковалентных сшивок между остатками лизина внутри коллагеновых молекул и между ними. Ковалентные связи такого типа встречаются только в коллагене и эластине. Если блокировать их образование, содержащие коллаген ткани становятся хрупкими, и такие структуры, как кожа, сухожилия и кровеносные сосуды будут легко разрываться. Количество и тип сшивок изменяются от ткани к ткани. Например, в ахилловом сухожилии, для которого прочность на разрыв очень важна, такие сшивки в коллагене особенно многочисленны.
Чтобы обеспечить создание укрепляющих связей, необходимо наличие в полипептидных цепях реакционноспособных альдегидных групп. Внеклеточный медь-зависимый фермент лизилоксидаза катализирует реакцию превращения в коллагене и эластине e-аминогрупп отдельных лизильных и гидроксилизильных остатков в альдегидные группы:
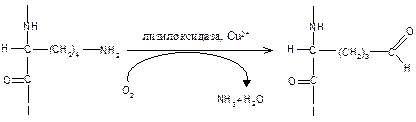
| Остаток лизина | Остаток аллизина |
Модифицированные остатки лизина называются аллизином, поскольку вместо e-аминогрупп они содержат альдегидные группы. Молекула лизилоксидазы состоит из двух доменов: медь-связывающего и каталитического, содержащего в качестве кофермента тирозилхинон, который в ходе ферментативной реакции образует комплекс с аминокислотными остатками лизина. Этот обнаруженный сравнительно недавно кофермент образуется в результате постсинтетической модификации аминокислотного остатка тирозина в полипептидной цепи фермента. Экспериментальные данные показывают, что его образование происходит в молекуле синтезированного белка в аэробных условиях в присутствии ионов меди без добавления каких-либо дополнительных молекул. На экспрессию лизилоксидазы влияет ряд ростовых факторов, ангиотензин II, ретиноевая кислота, а также последствия стресса от повреждения тканей.
Возникшие в результате реакции окислительного дезаминирования альдегидные группы участвуют в образовании ковалентных внутри- и межмолекулярных связей, которые стабилизируют фибриллы коллагена. Альдольная конденсация двух аллизиновых остатков приводит к формированию сшивки лизин-норлейцин (см. схему - а), а путем взаимодействия лизильного и альлизильного остатков образуются альдиминные связи, называемые также основаниями Шиффа (см. схему -б):
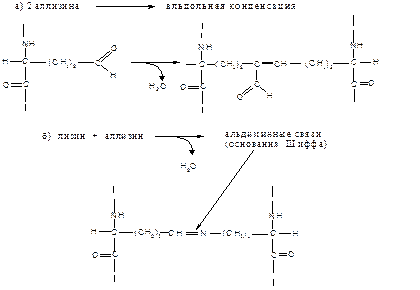
Сшивки, образованные тремя или четырьмя остатками лизина, называются пиридиновыми или пиридинолиновыми (если сшивки образуют аминокислотные остатки гидроксилизина, их называют гидроксипиридинолиновыми), поскольку они включают пиридиновое кольцо.
На следующем далее рисунке схематически представлены трехспиральные молекулы тропоколлагена после наложения внутри и межмолекулярных сшивок, которые изображены в виде стрелок.
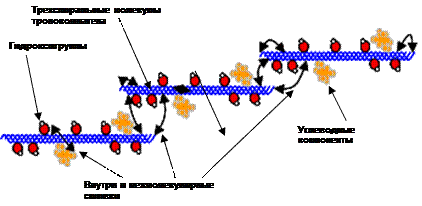
При недостаточно высокой активности лизилоксидазы, а также при явных нарушениях обмена меди в организмеобразуется недостаточное число поперечных сшивок между белковыми цепями, в результате чего снижается прочность коллагеновых фибрилл и развивается наследственное заболевание cutis laxa (вялая кожа), сопровождающееся непрочностью кожи, сухожилий, кровеносных сосудов.
Имеется определенная зависимость между возрастом человека и количеством поперечных сшивок. С возрастом количество сшивок увеличивается, обновление молекул коллагена замедляется, и ткани становятся более грубыми.
В фибриллообразующих типах коллагенов после превращения незрелых фибрилл в зрелые путем формирования сшивок, фибриллы укладываются параллельно друг другу (на схеме слева), и далее они объединяются в коллагеновое волокно (на схеме справа).
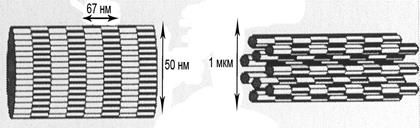
| Фибрилла коллагена | Коллагеновое волокно |
Около 95% коллагенов организма (I, II, III, V и XI типа) объединяются в фибриллы и составляют структурную основу органов и тканей, которые испытывают сильную механическую нагрузку, таких как кости, зубы, хрящи, кровеносные сосуды. Нужно отметить, что некоторые типы коллагена (IV, VIII, Х) образуют не фибриллярные, а сетеподобные структуры. О способах укладки молекул коллагена, а также о заболеваниях, связанных с нарушениями синтеза и созревания коллагена можно прочитать в разделе 15 учебника «Биохимия» под ред.чл.-корр.РАН, проф. Е.С.Северина, М.: издательский дом «ГЭОТАР-МЕД», 2003.
Дата добавления: 2020-10-01; просмотров: 822;











