Кинетика тепловой гибели клеток и спор
Активность клеток, спор и вирусов в воздухе или жидких средах может снижаться в результате их разрушения (под воздействием тепла, радиации, химических агентов или механических сил), при механическом отделении (фильтрованием или центрифугированием) или за счет ингибирования (при переохлаждении, высушивании, обезвоживании, воздействии химических реагентов). Жидкости стерилизуют в основном путем нагревания (в промышленности) или хлорирования (для бытовых нужд), а для стерилизации воздуха применяют главным образом фильтрование. В двух последних процессах большую роль играют эффекты массопередачи, рассматриваемые в следующей главе; этот раздел посвящен кинетике инактивации клеток и спор.
На рис. 7.33 изображены результаты экспериментального изучения воздействия повышенной температуры на вегетативные клетки и споры. В общем случае по сравнению со спорами клетки погибают при нагревании гораздо быстрее. Это и понятно, если учесть, что образование эндоспор, как мы уже отмечали ранее, представляет собой защитный механизм. Тепловая обработка приводит также к инактивации вирусов и бактериофагов, поэтому использующаяся в микробиологической промышленности тепловая стерилизация снижает как численность популяции жизнеспособных микроорганизмов, так и концентрацию (титр) вирусов в подаваемом в реактор потоке питательных веществ.
Прежде чем перейти к изучению уравнений, описывающих скорость снижения численности популяции в процессе стерилизации, необходимо сделать ряд замечаний. Гибель каждой конкретной клетки, по-видимому, обусловливается термической денатурацией одного или нескольких жизненно важных для этой клетки белков, например ферментов. Кинетика подобных кооперативных превращений столь сложных молекул может изменяться во времени самым неожиданным образом. К тому же скорость молекулярных процессов, приводящих в конце концов к гибели клетки,, зависит от состава среды, в том числе и от концентрации растворителя. Например, как показано в табл. 7.9, температура, при которой наступает коагуляция (денатурация с последующей интенсивной необратимой сшивкой молекул денатурированного белка) альбумина яичного белка, повышается с уменьшением содержания в системе воды.

Эти данные и ряд других экспериментально обнаруженных фактов свидетельствуют о том, что в случае сравнительно обезвоженных организмов и структур (например, вирусов или спор) их инактивацию правильнее рассматривать как двухэтапный процесс, при котором сначала происходит гидратация, а затем, возможно, и денатурация. Такому механизму отвечает зависимость скорости гибели от относительной влажности, обнаруженная в случае бактериофагов [34].
Совместное влияние нескольких инактивирующих факторов не обязательно носит аддитивный характер; так, совместные обезвоживание и тепловая обработка могут быть менее эффективными, чем можно было бы предположить, судя по эффективности каждого из этих факторов в отдельности.
 Как мы упоминали выше, популяция состоит из множества клеток различного возраста. Природа клеточной стенки и относительная важность любого из путей метаболизма зависят от возраста, данной клетки и культуры в целом. Следовательно, устойчивость клеток к тепловой или индуцированной иными факторами инактивации будет зависеть от их истории, т. е. от довольно неопределенного фактора, который далеко не всегда удается охарактеризовать количественно.
Как мы упоминали выше, популяция состоит из множества клеток различного возраста. Природа клеточной стенки и относительная важность любого из путей метаболизма зависят от возраста, данной клетки и культуры в целом. Следовательно, устойчивость клеток к тепловой или индуцированной иными факторами инактивации будет зависеть от их истории, т. е. от довольно неопределенного фактора, который далеко не всегда удается охарактеризовать количественно.
В частности, клетки популяции, находящейся в фазе экспоненциального роста, имеют относительно проницаемые стенки, что способствует эффективному обмену растворенными веществами между внутриклеточным объемом и средой. Если эти растворенные вещества влияют на устойчивость белков, то можно ожидать, что их присутствие окажет влияние и на рост клеток в экспоненциальной фазе. Поэтому наиболее надежные данные о поведении популяции могут быть получены только в результате экспериментов в условиях, максимально приближенных к условиям предполагаемого практического проведения процесса.
Анализ кинетики скорости гибели клеток мы начнем с замечания о том, что линейная зависимость логарифма доли оставшихся в живых клеток от времени указывает на первый порядок процесса снижения численности популяции жизнеспособных клеток n:
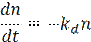
Отсюда следует, что при постоянном k
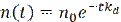
Здесь n0 – концентрация клеток при t=0.
Зависимость kd от температуры может быть выражена уравнением аррениусовского типа:
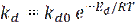
Для многих спор и вегетативных клеток величина параметра Еd лежит в диапазоне от 50 до 100 ккал/моль. Другой ранее применявшийся параметр Dr, равный 2,303/kd и называемый временем децимальной редукции (десятичным коэффициентом снижения численности популяции), представляет собой не что иное, как время, в течение которого численность популяции жизнеспособных клеток снижается в 10 раз.
Приведенные выше кинетические уравнения справедливы только при том условии, что количество спор или клеток в популяции достаточно велико с точки зрения статистики (разд. 7.1). По мере снижения числа клеток или спор (n) вероятность отклонений от величин, предсказываемых указанными уравнениями, возрастает, поскольку, например, при нормальном распределении стандартное отклонение возрастает пропорционально 1/n. Из предыдущего уравнения детерминистической модели следует, что оставшаяся жизнеспособной доля популяции (если допустить, что в данных летальных условиях роста клеток не происходит) определяется уравнением
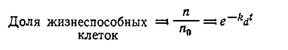
Если судьба каждого организма не зависит от других организмов, если организмы не самовоспроизводятся и если летальные условия одинаковы для каждого организма, то стохастический анализ процесса стерилизации показывает, что вероятность наличия в популяции N жизнеспособных организмов в любой момент времени t равна [33]
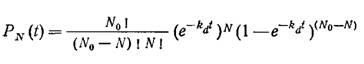
Здесь No — численность жизнеспособных организмов в стерилизуемой жидкости непосредственно, перед началом стерилизации.
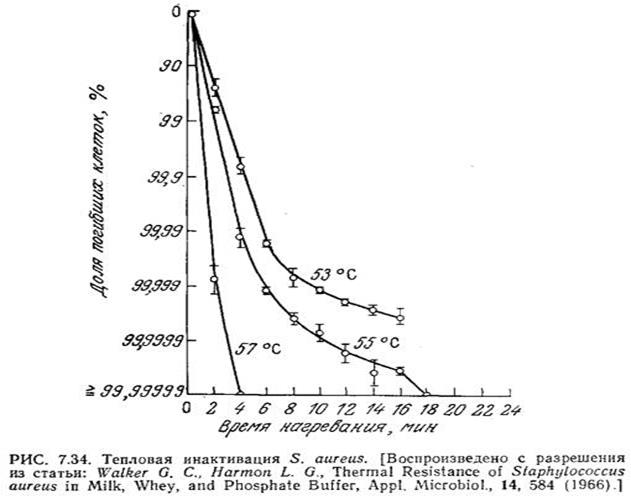
В этом уравнении параметр kd имеет тот же смысл, что и константа скорости в уравнении (7.124); в стохастической модели kd можно интерпретировать как величину, обратную средней продолжительности жизни организма. По мере того как число организмов снижается до некоторой сравнительно малой величины, допущение о гомогенной популяции, достаточно полно описываемой одним параметром kd, становится все менее и менее обоснованным. Так, приведенные на рис. 7.34 данные, характеризующие поведение Staphylococcus aureus в нейтральном фосфатном буфере, свидетельствуют об отклонении от поведения, предсказываемого стохастическим распределением, в положительную сторону; следовательно, большей устойчивостью к тепловой обработке отличается небольшая доля популяции.
Иногда допускается, чтобы после стерилизации оставалось довольно значительное количество жизнеспособных организмов (так, в пастеризованном молоке высшего качества концентрация живых бактерий не должна превышать 30 000 клеток в 1 мл). В других ситуациях, например при выращивании чистых культур, к стерилизации предъявляются значительно более жесткие требования
В таких случаях важно оценить вероятность гибели популяции, т. е. вероятность инактивации всех организмов. Подставляя в уравнение (7.128) N = 0, получаем
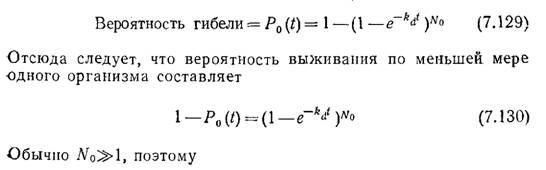
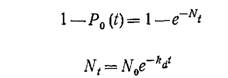
Величину (1—P0) можно интерпретировать как долю стерилизаций, которые не должны приводить к полной гибели всех организмов.
Заключение
Как мы упоминали во введении к настоящей главе, конечной целью изучения кинетики клеточного роста является математическое количественное описание совместного влияния генетической природы организмов и среды на скорости процессов, осуществляющихся в популяции этих организмов. В настоящее время мы располагаем целым рядом частных моделей, одни из которых учитывают незначительные генетические изменения, другие — небольшие отклонения в составе среды, а третьи описывают гетерогенность клеток культуры. Учитывая ограниченную применимость каждой из таких моделей, специалист в области биохимической технологии должен прежде всего четко определить предполагаемую сферу использования данной кинетической модели и в соответствии с этим придать ей необходимую форму и глубину.
Громадные успехи фундаментальных биологических наук и вычислительной техники в будущем позволят создать более надежные, более глубокие и более механистические модели кинетики клеточного роста.
В этой главе мы изучили зависимости между ростом биомассы, утилизацией субстрата и образованием продуктов жизнедеятельности клеток. Экспериментальные данные помогли нам выяснить основные характеристики роста популяций клеток и филаментозных организмов. Мы рассмотрели также математические модели роста популяций микроорганизмов, необходимые для анализа и проектирования технологических процессов с их участием.
Вопросы для самоконтроля.
1. Охарактеризуйте особенности идеального реактора периодического действия для изучения кинетики клеточного роста.
2. Охарактеризуйте идеальный проточный реактор с полным перемешиванием (ПРПП)
3. Опишите уравнение Моно для кинетики клеточного роста микроорганизмов в естественных системах и промышленных процессах.
4. Опишите кинетику сбалансированного ростапроцессов утилизации субстрата, образования продуктов метаболизма и биомассы в культурах клеток.
5. Охарактеризуйте влияние эндогенного метаболизма и метаболизма поддержания на кинетику клеточного роста
6. Какие уравнения кинетики клеточного роста Вам известны? Проведите сравнительный анализ данных уравнений с выражением предложенным Моно.
7. Перечислите параметры среды, влияющие на кинетику клеточного роста.
8. Опишите особенности фаз роста клеток в реакторах периодического действия.
9. Охарактеризуйте кинетику клеточного роста в переходном состоянии.
10. Дайте характеристику неструктурной модели клеточного роста в периодических процессах.
11. Опишите особенности роста филаментозных организмов
12. Дайте характеристику структурной модели клеточного роста.
13. Охарактеризуйте компартментальные модели
14. Опишите кинетику процессов утилизации субстрата, образования продуктов метаболизма и биомассы в культурах клеток при использовании компартментальной модели
15. Опишите кинетику процесса утилизации субстрата, образования продуктов метаболизма и биомассы в культурах клеток.
16. Проведите анализ кинетики процессов утилизации субстрата, образования продуктов метаболизма и биомассы в культурах клеток.
17. В чем заключается необходимость моделирования клеточного роста при оптимизации биотехнологического процесса.
18. Опишите кинетику процесса утилизации субстрата, образования продуктов метаболизма и биомассы в культурах клеток.
19. Опишите кинетику образования продуктов жизнедеятельности филаментозными организмами
20. Опишите кинетику тепловой гибели клеток и спор при утилизации субстрата, образования продуктов метаболизма и биомассы в культурах клеток.
Дата добавления: 2020-10-01; просмотров: 745;











