Вопрос 2.Фенол, его строение, свойства и применение.
Ответ.Фенолы – органические вещества, производные ароматических углеводородов, в которых гидроксильные группы (одна или несколько) связаны с бензольным кольцом.
Простейший представитель этой группы веществ – фенол, или карболовая кислота С6Н5ОН. В молекуле фенола π-электроны бензольного кольца оттягивают на себя неподеленные пары электронов атома кислорода гидроксильное группы, вследствие чего увеличивается подвижность атома водорода этой группы.
Физические свойства
Твердое бесцветное кристаллическое вещество, с резким характерным запахом, при хранении окисляется на воздухе и приобретает розовый цвет, плохо растворим в холодной воде, но хорошо растворяется в горячей воде. Температура плавления – 43 °C, кипения – 182 °C. Сильный антисептик, очень ядовит.
Химические свойства
Химические свойства обусловлены взаимным влиянием гидроксильной группы и бензольного кольца.
Реакции по бензольному кольцу
1. Бромирование:
C6H5OH + 3Br2 = C6H2Br3OH + 3HBr.
2,4,6-трибромфенол (белый осадок)
2. Взаимодействие с азотной кислотой:
C6H5OH + 3HNO3 = C6H2(NO2)3OH + 3H2O.
2,4,6-тринитрофенол (пикриновая кислота)
Эти реакции проходят в обычных условиях (без нагревания и катализаторов), тогда как для нитрования бензола требуется температура и катализаторы.
Реакции по гидроксигруппе
1. Как и спирты, взаимодействует с активными металлами:
2C6H5OH + 2Na = 2C6H5ONa + H2↑.
фенолят натрия
2. В отличие от спиртов взаимодействует со щелочами:
C6H5OH + NaOH = C6H5ONa + H2O.
Феноляты легко разлагаются слабыми кислотами:
а) C6H5ONa + H2O + CO2 = C6H5OH + NaHCO3;
t, кат.
б) C6H5ONa + CH3I + CO2 = C6H5OСH3 + NaI.
метилфениловый эфир
3. Взаимодействие с галогенопроизводными:
KOH
C6H5OH + C6H5I = C6H5OC2H5 + HI
этилфениловый эфир
4. Взаимодействие со спиртами:
t
C6H5OH + HOC2H5 = C6H5OC2H5 + H2O.
5. Качественная реакция:
3C6H5OH + FeCl3 = (C6H5O)3Fe↓+ 3HCl.
фенолят железа (III)
Фенолят железа (III) имеет коричнево-фиолетовый цвет с запахом туши (краски).
6. Ацелирование:
C6H5OH + CH3COOH = C6H5OCOCH3 + H2O.
7. Сополиконденсация:
t, p, кат.
C6H5OH + СH2 O + … → -[HOC6H3CH2C6H3OH]n.–.
метаналь –Н2О фенолоформальдегидная смола
Получение
1. Из каменноугольной смолы.
2. Получение из хлорпроизводных:
p, 300 °C
C6H5Cl + NaOH = C6H5ONa + HCl,
2C6H5ONa + H2SO4 = 2C6H5OH + Na2SO4.
3. Кумольный способ:
C6H6+ CH2CHCH3 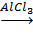 C6H5CH(CH3)2,
C6H5CH(CH3)2,
C6H5CH(CH3)2 + O2 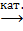 С6H5C(CH3)2OOH
С6H5C(CH3)2OOH 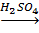 C6H5OH +CH3COCH3.
C6H5OH +CH3COCH3.
фенол ацетон
Применение
1. Как антисептик используется в качестве дезинфицирующего средства.
2. В производстве пластмасс ( фенолформальдегидная смола).
3. В производстве взрывчатых веществ ( тринитрофенол).
4. В производстве фотореактивов ( проявители для черно- белой бумаги).
5. В производстве лекарств.
6. В производстве красок ( гуашь).
7. В производстве синтетических материалов.
Вопрос 3.Через 200г 40-% раствора КОН пропустили 1,12л СО2. Определите тип и массу образовавшейся соли.
Ответ.
Дано: Найти: тип и массу соли.
m(KOH)= 200г,
ω(KOH)=40%,
V(CO2)= 1,12 л.
Решение
m(KOHбезводн)= 200*0,4=80г.
х1 г 1,12 л x2 г
2KOH + CO2= K2CO3+H2O.
v: 2 моль 1 моль 1 моль
M: 56 г/моль – 138 г/моль
m: 112 г -- 138 г
VM: 22,4 л
x1= m(KOH) = (1,12* 112)/22,4=5,6 г,
x2=m(K2CO3)=138*1,12/22,4=6,9 г.
Поскольку КОН взят в избытке, то образовалась средняя соль К2СО3 , а не кислая КНСО3.
Ответ: m(K2CO3)= 6,9 г.
БИЛЕТ №3
Вопрос 1.Теория строения органических соединений. Значение теории для развития науки.
Ответ.В 1861 г. Русский учёный Александр Михайлович Бутлеров сформулировал основные положения теории строения органических веществ.
1.Молекулы органических соединений состоят из атомов, связанных между собой в определённой последовательности согласно их валентности ( C-IV,H-I, O-II, N-III, S-II).
2.Физические и химические свойства вещества зависят не только от природы атомов и их количественного соотношения в молекуле, но и от порядка соединения атомов, то есть от строение молекулы.
3. Химические свойства вещества можно определить, зная его строение молекулы. И наоборот, строение молекулы вещества можно установить опытным путём, изучая химические превращения вещества.
4.В молекулах имеет место взаимное влияние атомов или групп атомов друг на друга:
CH3- CH3 ( tкип =88,6 0С), CH3- CH2 – CH3 ( tкип,= 42,1 0С)
этан пропан
На основе своей теории Бутлеров предсказал существование изомеров соединений, например двух изомеров бутана ( бутана и изобутана):
CH3-CH2- CH2-CH3 ( tкип.=0,5 0C),
бутан
CH3-CH(CH3)- CH3 ( tкип = -11,7 0С).
2-метилпропан или изобутан
Изомеры – вещества, имеющий одинаковый состав молекулы, но различное химическое строение и по этому обладающие различными свойствами.
Зависимость свойств веществ от их структур- одна из идей, лежащих в основе теории строения органических веществ А.М. Бутлерова.
Значение теории А.М .Бутлерова
1.ответила на основные «Противоречия» органической химии:
а) Многообразие соединений углерода
б) кажущееся несоответствие валентности и органических веществах:
в) различные физические и химические свойства соединений, имеющих одинаковую молекулярную формулу ( С6Н12O6 – глюкоза и фруктоза).
2. Позволила предсказать существование новых органических веществ, и также указать пути их получения.
3. Дала возможность предвидеть различные случаи изомерии, предугадывать возможные направления реакций.
Вопрос 2.Виды Химической связи в органических и органических соединениях.
Ответ: Основная движущая сила, проводящая к образованию химической связи,- стремление атомов к завершению внешнего энергетического уровня.
Ионная связь – химическая связь, осуществляемая за счёт электростатического притяжения между ионами. Образование ионных связей возможно только между атомами, значения электроотрицательности которых очень сильно различаются.
К ионным соединениями относят галогениды и оксиды щелочных и щелочно-земельных металлов ( NAI, KF,CACI2,K2O,LI2O).
Ионы могут состоять и из нескольких атомов, связи между которыми не ионные:
NаOH = Nа+ + OH-,
Nа2SO4= 2Nа+ + SO42-.
Следует отметить, что свойства ионов существенно отличаются от свойств соответствующих им атомов и молекул простых веществ: Na- металл бурно реагирующий с водой, ион Na+ растворяется в ней; H2- растворяется в ней; H2 - газ без цвета, вкуса и запаха, ион H+ придает раствору кислый вкус, изменяет цвет лакмуса (на красный).
Свойства ионных соединений
1.Соединения с ионной связью являются электролитами. Электрический ток проводят только растворы и расплавы.
2. Большая хрупкость кристаллических веществ.
Ковалентная связь- химическая связь, осуществляемая за счет образования общих (связывающих) электронных пар.
Ковалентная неполярная связь-связь, образующаяся между атомами, проявляющими одинаковую электроотрицательность . При ковалентной неполярной связи электронная плотность общей пары электронов распределяется в пространстве симметрично относительно ядер общих атомов ( H2,I2,O2,N2).
Ковалентная полярная связь- ковалентная связь между атомами с различной ( но не сильно отличающейся друг от друга) электроотрицательностью ( H2S, H2O,NH3).
По донорно-акцепторному механизму образуется:NH+4, H3, O+, SO3, NO2. В случае возникновения иона NH+4 атом азота-донор, предоставляющий в общее пользование не поделённую электронную пару, а ион водорода – акцептор, принимающий эту пару и предоставляющий для этого свою орбиталь. При этом образуется донорно-акцепторная (координационная) связь. Атом акцептора приобретает большой отрицательный заряд, а атом донора- положительный.
У Соединений с ковалентной полярной связью температуры кипения и плавления выше, чем к веществ с ковалентной неполярной связью.
В молекулах органический соединений связь атомов ковалентная полярная.
В таких молекулах происходит гибридизация ( смешение орбиталей и выравнивание их по формуле и энергии) валентных ( внешних) орбиталей атомов углерода.
Гибридные орбитали перекрываются, и образуются прочные химические связи.
Металлические связи- связь, осуществляемая относительно свободными электронами между ионами металлов в кристаллической решетке. Атомы металлов легко отдают электроны, превращаясь в положительно заряженные ионы. Оторвавшиеся электроны свободно перемещаются между положительными ионами металлов , т.е. они обобществлены ионами металлов, т.е. они обобществлены и передвигаются по всему куску металла, в целом электронейтрального .
Свойства металлов.
1. Электропроводимость. Обусловлено наличием свободных электронов, способных создавать электрический ток.
2. Теплопроводность. Обусловлена тем же.
3. Ковкость и пластичность. Ионы и атомы металлов в металлической решетке непосредственно не связаны друг с другом, и отдельные слои металла могут свободно перемещаться один относительно другого.
Водородная связь- может быть межмолекулярной и внутримолекулярной.
Межмолекулярная водородная связь образуется между атомами водорода одной молекулы и атомами сильноэлектроотрицательного элемента (F,O,N)другой молекулы. Такая связь определяет аномально высокие температуры кипения и плавления некоторых соединений (HF,H2O). При испарении этих веществ происходит разрыв водородных связей, что требует затрат дополнительной энергии.
Причина водородной связи : при отдаче единственного электрона «своему» атому электроотрицательного элемента водород приобретает относительно сильный положительный заряд, который затем взаимодействует с неподеленной электронной парой «чужого» атома электроотрицательного элемента.
Внутримолекулярная водородная связь осуществляется внутри молекулы. Эта связь определяет структуру нуклеиновых кислот (двойная спираль) и вторичную ( спиралевидную) структуру белка.
Водородная связь гораздо слабее ионной или ковалентной, но сильнее, чем межмолекулярное взаимодействие.
Вопрос 3. Решить задачу. 20г нитробензола подвергли реакции восстановления. Найти массу образовавшегося анилина, если выход реакции составляет 50%.
Ответ.
Дано: Найти: m(C6H6NH2).
m(C6H6NO2) = 20г,
Ƞ=50%
Решение
20 г х г
(C6H6NO2) + 3H2= C6H6NH2+2H20.
v: 1 моль 1 моль
M: 123г/моль 93 г /моль
m: 123 г 93 г
х= mтеор (C6H6NH2) =20*93/123=15г,
mпракт= 15*0,5=7,5 г.
Ответ: 7,5 г.
Билет № 4
| Свойства Металл | Li, K, Rb, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb, (H), Cu, Hg, Ag, Pt, Au | |||
| Восстановительная способность ( отдавать электроны) | Возрастает | |||
| Взаимодействие с кислородом воздуха | Быстро окисляются при обычной температуре | Медленно окисляются при обычной температуре или при нагревании | Не окисляются | |
| Взаимодействие с водой | Выделяется Н2 и образуется гидроксид | При нагревании выделяется водород и образуется гидроксид | Не вытесняют водород из воды | |
| Взаимодействие с кислотами | Вытесняют водород из разбавленных кислот | Не вытеснят водород из разбавленных кислот | ||
| Окислительная способность (присоединять электроны) | Возрастает | |||
Вопрос 1.Общие свойства металлов . Особенности строение атомов .
Ответ. Атомы металлов сравнительно легко отдают валентные электроны и превращаются при этом в положительно заряженные ионы. Поэтому металлы являются восстановителями. В этом и состоит главная и наиболее общая химическая свойства металлов. Соединениях металлы проявляют только положительные степень окисления. Восстановительная способность разных металлов не одинакова и возрастает в электрохимическом ряду напряжений металлов от Au и до Li.
Физические свойства
1.Электропроводность . Обусловлена наличием в металлах свободных электронов, образующих электрический ток(направленное движение электронов).
2.Теплопроводность.
3.Ковкость и пластичность.
Металлы c ρ <5 г /см3 – легкие, c ρ > 5 г/см3 – тяжелые.
Легкоплавкие металлы: c t пл < 1000 0 C ,тугоплавкие – c t пл >10000C.
Схемы взаимодействия металлов с серной кислотой.
Разбавленная H2SO4 растворяет металлы расположенные в ряду стандартных электродных потенциалов (ряд активности металлов)до водорода:
M + H2SO4 (разб.) → соль + H2↑
(M = (Li →Fe) в ряду активности металлов).
При этом образуются соответствующая соль и вода.
С Ni разбавленная H2SO4 реагирует очень медленно, с Ca, Mn, и Pb кислота не реагирует. При действии кислоты на поверхности свинца образуется пленка PbSO4, защищающая его от дальнейшего взаимодействия с кислотой.
Концентрированная H2SO4 при обычной температуре со многими металлами не взаимодействует. Однако при нагревании концентрированная кислота реагирует почти со всеми металлами (кроме Pt ,Au и некоторых других). При этом кислота восстанавливается до H2S,или SO2:
t
M + H2SO4 (конц.) → соль + H2O + H2S↑ (S ,SO2).
Водород в этих реакциях не выделяется, а образуется вода.
Схемы взаимодействия металлов с азотной кислотой.
При взаимодействии металлов с HNO3 водород не выделяется; он окисляется, образуя воду. В зависимости от активности металла кислота может восстанавливаться до соединений.
+5 +4 +2 +1 0 -3 -3
HNO3→NO2→ NO→ N2O→N2→NH3(NH4NO3).
При этом образуется также и соль азотной кислоты.
Разбавленная HNO3 реагирует со многими металлами (исключение: Ca ,Cr ,Pb, Au) чаще всего с образованием NH3,NH4NO3,N2 или NO:
M + HNO3 (разб.) → соль + H2O + NH3 (NH4NO3, N2 ,NO).
Концентрированная HNO3 взаимодействует в основном с тяжелыми металлами с образованием N2O или NO2:
M + HNO3(конц.) → соль + H2O + N2O(NO2).
При обычной температуре эта кислота (сильный окислитель) не реагирует с Al ,Cr, Fe и Ni. Она легко переводит их в пассивное состояние (на поверхности металла образуется плотная защитная оксидная пленка, препятствующая контакту металла со средой.)
Вопрос 2. Крахмал и целлюлоза. Сравнить их строение и свойства. Их применение.
Ответ.Строение крахмала: структурное звено – остаток молекулы
α-глюкозы. Строение целлюлозы: структурное звено-остаток молекулы β-глюкозы.
Физические свойства
Крахмал-белый хрустящий порошок ,нерастворимый в холодной воде. В горячей воде образует коллоидный раствор-клейстер.
Целлюлоза-твердое волокнистое вещество ,нерастворимое в воде и органических растворителях.
Химические свойства
1. Крахмал целлюлоза подвергаются гидролизу:
(C6H10O5)n + nH2O=nC6H12O6.
При гидролизе крахмала образуется альфа-глюкоза, при гидролизе целлюлоза бета-глюкоза.
2. Крахмал с йодом дает синие окрашивание(в отличие от целлюлозы).
3. Крахмал переваривается в пищеварительной системой человека ,а целлюлоза не переваривается.
4. Для целлюлозы характерна реакция этерификации:
[(C6H7O2)(OH)3]n +3nHONO2(конц.) 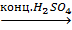 [(C6H7O2)(ONO2)3]n +3nH2O.
[(C6H7O2)(ONO2)3]n +3nH2O.
тринитроцеллюлоза
5. Молекулы крахмала имеют как линейную, так и разветвленную структуру. Молекулы же целлюлоза имеет линейное (то есть не разветвленное) строение, благодаря чему целлюлоза легко образует волокна .Это основное различие крахмала и целлюлозы.
6.Горение крахмала и целлюлозы:
(C6H10O5)n+O2=CO2+H2O+Q.
Без доступа воздуха происходит термическое разложение. Образуются CH3O, CH3COOH, (CH3)2CO и др.
Применение
Крахмал:
1. Путем гидролиза превращают в потоку и глюкозу.
2. Как ценный и питательный продукт(основной углевод пищи человека-хлеба ,крупы ,картофеля).
3. В производстве клейстера.
4. В производстве красок (загуститель)
5. В медицине (для приготовления мазей, присыпок).
6. Для накрахмаливания белья.
Целлюлоза:
1. В производстве ацетатного волокна ,оргстекла, негорючей пленки(целлофан).
2. При изготовлении бездымного пороха(тринитроцеллюлоза).
3. В производстве целлулоида и колодита (динитроцеллюлоза).
Вопрос 3. К 500 грамм 10% раствора NACL прибавили 200 грамм 5% раствора того же вещества, потом еще 700 грамм воды. Найдите процентную концентрации полученного раствора.
Ответ.Найти :m1(NаCl)= 500г
Дано:
ω3(NаCl)=?
ω1(NаCl)=10%
m2(NаCl)=200г
ω2 (NаCl)=5%
Решение
m1 (NaCl, безв.)=500 *10\100 = 50 г,
m2 (NaCl, безв.)=200*5\100=10 г,
m (р-ра)=500+200+700=1400г,
mобщ (NaCl)=50+10=60г,
ω3 (NaCl)=60\1400 * 100 % = 4,3 %
Ответ: ω3 (NaCl)=4,3 %
БИЛЕТ № 5
Вопрос 1. Ацетилен. Его строение, свойства, получение и применение.
Ответ. Ацетилен относится к классу алкинов.
Ацетеленовые углеводороды, или алкины, -непредельные (ненасыщенные) углеводороды с общей формулой 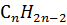 , в молекулах которых между атомами углерода есть тройная связь.
, в молекулах которых между атомами углерода есть тройная связь.
Электронное строение
Углерод в молекуле ацетилена находится в состоянии sp – гибридизации. Атомы углерода в этой молекуле образуют тройную связь, состоящую из двух -связей и одной σ-связи.
Молекулярная формула: 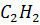 .
.
Графическая формула: H-C≡ C-H
Физические свойства
Газ, легче воздуха, малорастворим в воде, в чистом виде почти без запаха, бесцветный, 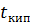 = - 83,6
= - 83,6 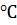 . (В ряду алкинов с увеличением молекулярной массы алкина температуры кипения и плавления увеличиваются.)
. (В ряду алкинов с увеличением молекулярной массы алкина температуры кипения и плавления увеличиваются.)
Химические свойства
1. Горение:
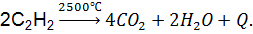
2. Присоединение:
а) водорода:
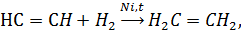
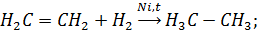
б) галогена:
C2H2 + 2Cl2 = C2H2Cl4;
1,1,2,2-тетрохлорэтан
в) галогеноводорода:
HC≡CH + HCl = 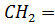 CHCl
CHCl
винилхлорид
CH2=CHCl + HCl = CH3-CHCl2
1,1-дихлорэтан
(по правилу Марковникова);
г) воды( реакция Кучерова):
HC=CH + H2O = CH2=CH-OH 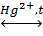 CH3-CHO
CH3-CHO
виниловый спирт уксусный альдегид
3. Замещение:
HC≡CH + 2AgNO3 + 2NH4 = AgC≡CAg↓+ 2NH4NO3 + 2H2O.
ацетиленид серебра
4. Окисление:
HC≡CH + 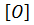 + H2O → HOOC-COOH (
+ H2O → HOOC-COOH ( 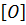 -KMnO4).
-KMnO4).
щавельная кислота
5. Тримеризация:
3HC≡CH t, кат
бензол
6. Димеризация:
HC≡CH + HC≡CH КАТ. HC≡C - HC=CH2
винилацетилен
Получение
1. Дегидрирование алканов (крекинг жидких нефтяных фракций):
C2H6 = C2H2 + 2H2↑.
2. Из природного газа (термический крекинг метана):
2CH4 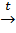 C2H2 + 3H2↑
C2H2 + 3H2↑
3. Карбидный способ:
CaC2 + 2H2O = Ca(OH)2 + C2H2↑
Применение
1.В производстве винилхлорида, ацетальдегида, винилацетата, хлоропрена, уксусной кислоты и других органических веществ.
2.В синтезе каучука и поливинилхлоридных смол.
3.В производстве поливинилхлорида (кожзаменитель).
4.В производстве лаков, лекарств.
5.При изготовлении взрывчатых веществ (ацетилениды).
Дата добавления: 2016-07-18; просмотров: 7855;











