Зависимость скорости реакций от давления в системе.
В тех случаях, когда среди реагирующих веществ имеются газы, скорость реакций зависит от давления в системе. При повышении давления пропорционально возрастает число молекул газа в единице объема, что эквивалентно повышению концентрации данного газа.
Пример 3. Как изменится скорость реакции 2NО + О2 → 2NО2 при уменьшении объема замкнутой системы в два раза при постоянной температуре?
Решение. Уменьшение объема в замкнутой системе эквивалентно пропорциональному увеличению давления, так как, согласно закону Менделеева-Клайперона РW = νRТ. (Здесь W― объем системы.)
Кинетическое уравнение данной реакции имеет вид: V = kС2NО·СО2.
При уменьшении объема системы в два раза и связанным с этим повышении давления в два раза концентрации реагирующих веществ тоже повышаются в два раза: С'NО = 2СNО С'О2 = 2СО2
Новая скорость реакции:
V' = kС'NО2·С'О2 = k(2СNО)2·(2СО2) = 8kСNО2·СО2 = 8V
Вывод. При уменьшении объема замкнутой системы в два раза при постоянной температуре скорость данной реакции повышается в 8 раз.
5. Зависимость константы скорости реакции от температуры.
Большинство реакций ускоряется при нагревании. Температура действует непосредственно на константу скорости k. Пусть V1 ― скорость реакции при температуре Т1, а V2 ― скорость этой же реакции при температуре Т2 (Т1<Т2). В таком случае имеет место эмпирическое правило Вант-Гоффа.
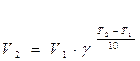
где γ – температурный коэффициент, показывающий во сколько раз повысится скорость реакции при повышении температуры на 10 0С. Для большинства реакций при температурах, близких к комнатной, γ составляет величину 2-4.
Уравнение Вант-Гоффа широко используется, однако следует помнить, что оно эмпирическое приблизительное, его можно применять только для ориентировочных расчетов.
Пример 4. При 100 0С некоторая реакция заканчивается за 20 мин. Принимая температурный коэффициент скорости реакции γ = 3,5, рассчитайте, через какое время закончится реакция при 60 0С
Решение. Скорость реакции, как и скорость всякого процесса, обратно пропорциональна времени проведения процесса. Следовательно, V2/V1 = τ1/τ2. Пусть Т1, V1иτ1 ― параметры медленного (низкотемпературного) процесса, а Т2, V2иτ2 ― параметры высокотемпературного процесса. Подставляем имеющиеся данные в уравнение Вант-Гоффа:
V2/V1 = 3,5(100 ― 60)/10 = (3,5)4 = 150. Так как V2/V1 = τ1/τ2 = 150,
τ1/τ2 = τ1/20 τ1 = 150·20 = 3000 мин = 50 часов.
Одним из методов ускорения химической реакции является катализ, который осуществляется при помощи веществ (катализаторов), увеличивающих скорость реакции, но не расходующихся в результате ее протекания. Как и при повышении температуры, при введении катализатора повышается константа скорости реакции. Механизм действия катализатора сводится к уменьшению величины энергии активации реакции, т.е. к уменьшению разности между средней энергией активных молекул (активного комплекса) и средней энергией молекул исходных веществ. Скорость химической реакции при этом резко повышается
Дата добавления: 2020-07-18; просмотров: 246;










