Генетические факторы патогенеза мультифакториальных
Заболеваний
Все существующие болезни человека (более 30 тыс.) в зависимости от роли наследственных (G) и средовых (Е) факторов в их развитии могут быть расположены на линии в данных (G-genome, геном; Е-environment, среда) координатах (рис. 5-6).
Первая группа - это наследственные болезни, при которых проявление патологического действия мутации как этиологического фактора практически не зависит от среды. Последняя может только менять выраженность симптомов болезни и тяжесть ее течения. К заболеваниям этой группы относятся хромосомные и генные наследственные болезни с полным проявлением (болезнь Дауна, нейрофиброматоз, гемофилия, фенилкетонурия, муковисцидоз, ахондроплазия и т.д.), а также врожденные аномалии развития полигенной природы. Болезнь может проявляться не обязательно в
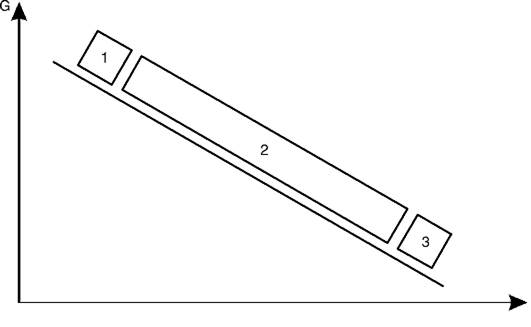
Рис. 5-6.Соотносительная роль генетических (G) и средовых (E) факторов в развитии болезней человека: 1 - «строго» наследственные болезни; 2 - болезни с наследственной предрасположенностью; 3 - ненаследственные болезни
детском, но и в любом возрасте - в соответствии с временными закономерностями генной экспрессии (например, средний возраст начала хореи Гентингтона равен 38-40 годам).
Во второй группе болезней наследственность может являться этиологическим или патогенетическим фактором, но для пенетрантности мутантных генов необходимы соответствующие факторы окружающей среды. Подобные заболевания и патологические реакции обычно проявляются неожиданно в разном возрасте при первом контакте со способствующими их развитию внешними факторами. К заболеваниям этой группы относятся сахарный диабет, атеросклероз, гипертоническая болезнь, туберкулез, экзема, псориаз, язвенная болезнь и др. Эту группу болезней называют болезнями с наследственным предрасположением или мультифакториальными заболеваниями(МФЗ).
В происхождении болезней третьей группы наследственность не играет этиологической роли (ненаследственные болезни). Сюда относятся большинство травм, инфекционных заболеваний, ожо-
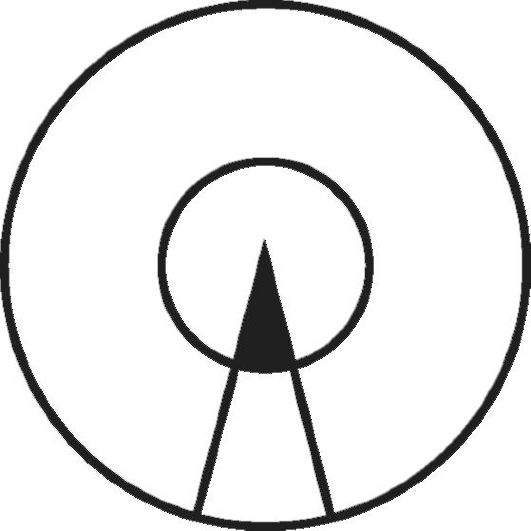 Рис. 5-7.Схема, иллюстрирующая роль генетического предрасположения и неблагоприятных факторов среды в возникновении заболевания. Площадь большого круга - популяция, площадь внутреннего круга - индивидуумы данной популяции, генетически предрасположенные к определенному типу заболевания. Сектор, ограниченный двумя радиусами, - часть популяции, находящаяся в некоторых определенных условиях среды, провоцирующих развитие данного заболевания. Закрашенная часть сектора - индивидуумы, которые действительно заболевают
Рис. 5-7.Схема, иллюстрирующая роль генетического предрасположения и неблагоприятных факторов среды в возникновении заболевания. Площадь большого круга - популяция, площадь внутреннего круга - индивидуумы данной популяции, генетически предрасположенные к определенному типу заболевания. Сектор, ограниченный двумя радиусами, - часть популяции, находящаяся в некоторых определенных условиях среды, провоцирующих развитие данного заболевания. Закрашенная часть сектора - индивидуумы, которые действительно заболевают
гов и т.д. Однако генетические факторы могут влиять на течение патологических и восстановительных процессов.
Схематически представление о роли генетических факторов и факторов среды, участвующих в возникновении и развитии МФЗ, показано на рис. 5-7. В этой схеме Г. Xарриса описана следующая ситуация: область, ограниченная внешней окружностью, - это популяция в целом; площадь внутреннего круга - те индивиды данной популяции, которые наследственно предрасположены к МФЗ определенного рода. Область, заключенная между двумя радиусами большей окружности, соответствует той части популяции, которая подвергается воздействию факторов среды, провоцирующих конкретное заболевание (в данном случае это меньшая группа); все остальные - та часть популяции (в этом случае большая), которая не подвергается воздействию этих факторов. Заболевание в действительности развивается у небольшой части популяции, т.е. у тех индивидов, у которых наследственное предрасположение сочетается с воздействием неблагоприятных условий среды.
В основе наследственной предрасположенности к болезням лежит широкий генетический балансированный полиморфизм популяций человека по ферментам, структурным и транспортным белкам, антигенам. Не менее 25-30% генетических локусов (из 80 тыс. генов) представлено в популяциях человека двумя аллелями и более. Эти гены не относятся к редким, их мутации широко распространены в популяциях человека и рассматриваются как обычные варианты аллельного полиморфизма. Индивидуальные комбинации аллелей («генетические ансамбли») невероятно многообразны.
Они обеспечивают генетическую уникальность каждого человека. Уникальность эта выражается не только в психофизиологических особенностях, но и в реакциях организма на патогенные факторы среды. Генетическая компонента наследственной предрасположенности к болезни может иметь моногенную или полигенную основу. В зависимости от этого выделяют два класса болезней с наследственным предрасположением: моно- и полигенные.
Моногенные болезни с наследственным предрасположением обусловлены мутациями отдельных генов.Эти болезни, как правило, наследуются по рецессивному типу. Причины сохранения этих форм наследственной патологии в популяциях человека, несмотря на пониженную адаптивность их носителя к тем или иным специфическим факторам среды, до конца не выяснены. Популяционногенетическое объяснение высоких концентраций таких мутаций заключается в признании сохранения полной приспособленности (в генетическом смысле) у гетерозиготных носителей. Наряду с этим у носителей таких генов должно быть селективное преимущество по сравнению с нормальными гомозиготами.
Патологическое действие «молчащих» генов проявляется под влиянием факторов окружающей среды. К настоящему времени известно более 40 локусов, мутации в которых могут вызывать болезни при дополнительном условии - действии «проявляющего» фактора, конкретного для этого гена. Некоторые примеры экопатологических реакций на факторы окружающей среды приведены в табл. 5-3.
Генные мутации, которые обусловливают возникновение таких молекулярных форм белков, патологическое действие которых выявляется не в обычных условиях, а только при взаимодействии со специфическими факторами внешней среды, называются экогенетическими вариациями.Например, у лиц с мутациями в локусе глюкозо-6-фосфатдегидрогеназы (Г-6-ФДГ) при лечении сульфаниламидными препаратами наблюдается гемолиз эритроцитов, у лиц с аномальной холинэстеразой введение дитилина приводит к длительной остановке дыхания.
Мультифакториальные болезни - это полигенные болезни с наследственным предрасположением.Они являются результатом взаимодействия генетических и средовых факторов, причем и те, и другие - многочисленны. Последнее отличает этот класс болезней от моногенных болезней с наследственным предрасположением, для которых как генетическая, так и средовая компонента пред-
Таблица 5-3.Примеры экогенетических патологических реакций на факторы окружающей среды
| Фактор окружающей среды | Провоцирующий фактор | Генетически детерминированные системы | Патологическая реакция | |
| Природноклиматические условия | Холодовое воздействие | ocj-ингибитор протеаз | Повышенный риск простудных заболеваний | |
| Солнечная радиация | Ферменты репарации ДНК | Изъязвления кожи, рак | ||
| Производственная среда | Запыленность | а,-ингибитор протеаз | Обструктивная болезнь легких | |
| Гипоксия, нитрофураны | Глюкозо-6- фосфатдегидрогеназа | Гемолиз эритроцитов | ||
| Красители бензидинового ряда | Ацетил трансфераза | Рак мочевого пузыря | ||
| Фотоактивные вещества | Трансферрин | Фотодерматоз | ||
| Бытовые вредности | Курение | а,-ингибитор протеаз | Обструктивная болезнь легких | |
| Алкоголь | Альдегиддегидрогеназа | Патологическая чувствительность к алкоголю | ||
| Пищевые продукты | Молоко | Лактоза | Лактаза | Непереносимость молока, диспепсия |
| Галактоза | Галактозо-1-фосфатури- дил трансфераза | Галактоземия | ||
| Недостаточность витамина С | L-гулонолактон- оксидаза | Цинга | ||
| Конские бобы | Глюкозо-6- фосфатдегидрогеназа | Фавизм | ||
| Фруктоза, сахароза | Альдолаза печени | Наследственная непереносимость фруктозы |
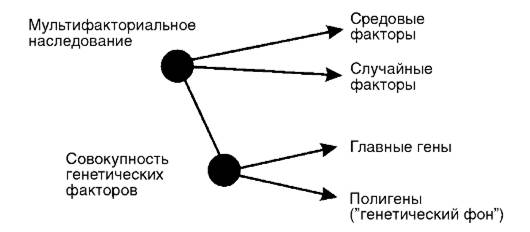 Рис. 5-8.Основные компоненты подверженности при мультифакториальных заболеваниях (по Ф. Фогелю и А. Матульски)
Рис. 5-8.Основные компоненты подверженности при мультифакториальных заболеваниях (по Ф. Фогелю и А. Матульски)
ставлены однофакторно - индивидуальный ген и специфический средовый фактор.
Взаимодействие наследственных и внешнесредовых факторов при полигенных болезнях с наследственным предрасположением представлено на рис. 5-8, где подчеркнута потенциальная роль одного или нескольких «главных» генов в структуре наследственной предрасположенности к МФЗ. Предполагается, что достаточно малое число главных генов может определять основной вклад в генетическую этиологию МФЗ. Совокупность всех других генов образует «генетический фон», который может изменять экспрессию главных генов. Важная роль в модификации всех генов полигенной системы принадлежит случайным (стохастическим) и средовым (систематическим) факторам.
Для объяснения природы болезней с наследственным предрасположением используется концепция подверженности,согласно которой подверженность имеет нормальное распределение в популяции и среди родственников первой степени родства.Кроме того, постулируется наличие «физиологического порога признака (болезни), вызываемого многими факторами», разделяющего индивидов на больных и здоровых (рис. 5-9). В рамках этой концепции разработан ряд моделей, которые позволяют оценить наследуемость как самой болезни, так и многообразных количественных признаков (биохимических, иммунологических, психофизиологических, соматических), имеющих патогенетическое значение для конкретной болезни.
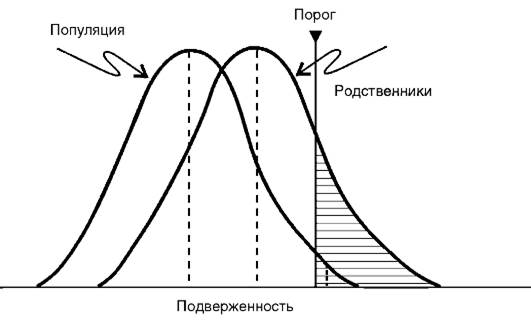 Рис. 5-9.Гипотетическое распределение порогового признака в популяции и среди родственников первой степени родства
Рис. 5-9.Гипотетическое распределение порогового признака в популяции и среди родственников первой степени родства
Под наследуемостью признаканормального или патологического понимают долю общей изменчивости его в популяции, которая может быть отнесена за счет генетических различий.Рассчитываемый коэффициент наследуемости (Н) позволяет оценить вклад генотипических факторов в детерминацию различий между больными и здоровыми. Основным материалом, анализ которого позволяет провести данные расчеты, служат сведения о распределении болезни (признака) в популяции (эпидемиологическое исследование) в семьях и среди близнецовых пар, принадлежащих данной популяции. Следовательно, генетико-эпидемиологический подход является ведущим в оценке соотносительной роли генетических и средовых факторов в развитии МФЗ. В таблице 5-4 приведены коэффициенты наследуемости для некоторых болезней и признаков.
Генетико-эпидемиологический подход в изучении МФЗ в настоящее время успешно дополнен молекулярно-генетическими исследованиями. Это стало возможным благодаря развитию технологий картирования генов, построению подробной генетической карты хромосом человека, разработке экспериментальных моделей болезней человека у животных. Результаты геномных исследова-
ний позволили обнаружить конкретные гены предрасположенности для многих МФЗ. Таким образом, появилась возможность подойти к детальному описанию структуры генетической компоненты подверженности для этой широко распространенной группы болезней. В таблицах 5-5, 5-6 приведен перечень генов предрасположенности к двум болезням мультифакториальной природы - артериальной гипертензии и бронхиальной астме.
Таблица 5-4.Коэффициент наследуемости (Н) болезней и признаков
 Таблица 5-5.Гены подверженности к эссенциальной гипертензии
Таблица 5-5.Гены подверженности к эссенциальной гипертензии
| Название признака | Символ гена | Хромосомная локализация |
| Субъединица эпителиального Na- канала (1β) | SCNN1B | 16p13-p12 |
| Субъединица эпителиального Na- канала (1γ) | SCNN1G | 16p13-p12 |
| Na+/H+- антипортер | APNH | 1p36/1-p35 |
| Ренин | REN | 1q25-q32 |
| Ангиотензин-I | AGT | 1q42-q43 |
| Ангиотензин-1-конвертирующий фермент | ACE | 17q22-q24 |
| Панкреатическая фосфолипаза А2 | PLA2 | 12q23-q24/1 |
| Гипертензия, обусловленная геном, экспрессирующимся в почке | SAN | 16p13/11 |
| Эндотелиальная синтаза окиси азота | NOS3 | 7q35-q36 |
Таблица 5-6.Гены подверженности к бронхиальной астме и атопии
| Название признака | Символ гена | Хромосомная локализация |
| Гиперреактивность бронхиального дерева | BHR1 | 5q |
| β2-адренергический рецептор | ADRB2R | 5q32-q34 |
| Интерлейкин-4 | JL4(IL36-4,-5,-9,-13,GM-CSF) | 5q31-5q33 |
| Фактор некроза опухоли α | TNFA | 6p21.3-p21.1 |
| HLA-комплекс | HLA-DR | 6p |
| Уровень общего иммуноглобулина Е | IGEL | 11q12-q13 |
| β-иммуноглобулиновый рецептор тучных клеток | FCER1b | 11q12-q12 |
| Интерферон γ | igif | 12q15-q24.1 |
| Невральная синтаза окиси азота | NOS1 | 12q24.2-q24.3 |
| Эстераза D | ESD | 13q14.2-q14.3 |
| α-Цепь антигенного рецептора Т-клеток | TCRA | 14q11-14q12 |
Однако необходимо иметь в виду, что в патогенезе мультифакториальных болезней могут участвовать аллели генов, вызывающих рецессивно передающиеся моногенные дефекты, никакого отношения к соответствующей болезни не имеющие. Такие сочетания отмечены у гетерозиготных носителей генов, вызывающих «болезни репарации» ДНК: анемию Фанкони, синдром Блюма, атаксию-телеангиэктазию и некоторые другие. У гетерозигот по этим генам существенно повышена частота возникновения рака. В этом случае такие гены играют роль генетически предрасполагающих факторов, по-видимому, через ослабление иммунологической системы элиминации соматических мутаций. Широкое распространение гетерозиготного носительства разных мутантных генов, возможно, еще недостаточно оценено как потенциальный фактор предрасположения.
Хотя в полной мере трудно количественно оценить значение наследственного предрасположения в патологии человека(заболеваемость, смертность, социальная дезадаптация), все же можно с уверенностью утверждать, что оно достаточно большое. Об этом говорят факты высокой частоты, длительности и тяжести течения широко распространенных болезней (гипертония, атеросклероз, аллергия, шизофрения, сахарный диабет, язвенная болезнь, псориаз, врожденные пороки развития). Безусловно, с возрастом значение наследственного предрасположения к развитию патологии возрастает, но и в детском возрасте оно является не менее важным. Речь идет не только о врожденных пороках развития, но и об атопических иммунных состояниях, целиакии, повышенной чувствительности к некоторым пищевым продуктам. В детском возрасте вклад наследственного предрасположения в развитие патологии составляет, по-видимому, не менее 10%, в среднем - существенно повышается, а в пожилом определяет до 25-50% болезненных состояний.
При разработке мер профилактики болезней с наследственным предрасположением и оценке их роли в патологии человека необходимо принимать во внимание, что закономерности их распространения достаточно сложны. Распространенность этой группы болезней варьирует в разных популяциях значительно. Причины вариаций можно объяснить различиями генетических и внешних факторов. В результате генетических процессов в популяциях человека (отбор, дрейф генов, миграция) гены «предрасположения» могут накапливаться или элиминироваться. Даже при равных условиях среды это может привести к разному уровню заболеваемости. В то же время при одинаковой частоте предрасполагающих аллелей или их сочетаний в популяциях частота болезней с наследственным предрасположением может быть разной, если условия среды отличаются.
Прогресс в изучении болезней с наследственным предрасположением достигнут в значительной степени благодаря осуществлению проекта «Геном человека». На основе «инвентаризации» генов предрасположенности и знания условий их патологического проявления могут разрабатываться профилактические мероприятия, включая своевременную диспансеризацию предрасположенных лиц.
Дата добавления: 2016-07-11; просмотров: 4968;











