Растения как источник биологически активных веществ (БАВ)
Растения являются продуцентами многих БАВ – соединений, способных оказывать влияние на биологические процессы в организме, к таким соединениям принадлежат сердечные гликозиды, сапонины, стерины, каротиноиды, полифенолы, алкалоиды, витамины, хиноны, а также вещества, обладающие специфическим ароматом, вкусом и окраской.
Биологически активные вещества принадлежат к продуктам вторичного обмена, которые называют вторичными метаболитами или вторичными продуктами биосинтеза. В настоящее время известно более 100000 вторичных метаболитов, продуцируемых растениями. Многие из них являются практически, экономически важными продуктами и используются в фармакологической, косметической, пищевой промышленности.
| Растительный продукт | Вид растения |
| Кодеин (алкалоид) | Papaver somniferum |
| Диосгенин (стероид) | Dioscorea deltoidea |
| Хинин (алкалоид) | Cinchona ledgeriana |
| Дигоксин (сердечный гликозид) | Digitalias lanata |
| Скополамин (алкалоид) | Datura stramonium |
| Винкристин (алкалоид) | Catharanthus roseus |

Клеточная инженерия растений рассматривает различные способы получения клеточных культур, культивирования растительных и животных клеток, выделение изолированных протопластов, биологическое конструирование, а также создание экспериментальных ассоциативных систем между культивируемыми клетками высших растений и микроорганизмами.
Десять наиболее употребляемых лекарственных веществ, получаемых из растений
| Лекарственное вещество | Активность | Растение-источник |
| Стероиды из диосгенина | Противозачаточные средства | Dioscorea deltoidea |
| Кодеин | Болеутоляющее | Papaver somniferum |
| Атропин | Антихолинэргическое | Atropa belladonna L. |
| Резерпин | Снижающее давление | Rauwolfia serpentina L. |
| Гиосциамин | Антихолинэргическое | Hyoscyamus niger L. |
| Дигоксин | Тонизирующее сердечную деятельность | Digitalis lanata L. |
| Скополамин | Антихолинэргическое | Datura metel L. |
| Дигитоксин | Сердечно-сосудистые | Digitalis purpurea L. |
| Пилокарпин | Холинэргическое | Pilocarpus jabonandi |
| Хинидин | Антималярийное | Cinchona ledgeriana |
Клеточные технологии, основанные на культивировании in vitro органов, тканей, клеток и изолированных протопластов высших растений, могут облегчить и ускорить традиционный селекционный процесс. Это, прежде всего, следующие технологии: культура семяпочек и зародышей, регенерация растений из тканей летальных гибридов, экспериментальная гаплоидия, криосохранение генофонда, клональное микроразмножение. Клеточная инженерия предлагает новые пути для создания высокопродуктивных форм растений. Это гибридизация соматических клеток, перенос чужеродных генов.
Примеры лекарственных веществ, полученные на основе каллусных культур
• Стевиозид - естественный подсластитель и заменитель сахара, успешно используется вместо искусственных подслащивающих веществ. Исходное растение - Stevia rebaudiana Bertoni.
• Арглабин – противоопухолевое соединение. Исходное растение - Artemisia glabella Kar. et Kir. Входит в состав одноименного препарата.
 Лаппаконитин - дитерпеновый алкалоид , анаритмическое средство. Исходное растение - Aconitum septentrionale Koelle. Входит в состав препарата Аллапинин
Лаппаконитин - дитерпеновый алкалоид , анаритмическое средство. Исходное растение - Aconitum septentrionale Koelle. Входит в состав препарата Аллапинин
Генная инженерия растений разработана не так хорошо, как в случае с животными и тем более, микробными клетками. Однако в настоящее время она привлекает все большее внимание, так как открывает новые перспективы в растениеводстве. Обычная селекция – процесс медленный и, кроме того, она ограничена природными видовыми барьерами. Введение новых генов с помощью техники рекомбинатнтых ДНК могло бы ускорить этот процесс и существенно расширить его возможности. Кроме того растения обладают существенной особенностью – целое растение может быть выращено из отдельной клетки. Это не относится ко всем растениям. Например, клетки злаковых или бобовых очень редко претерпевают такую редифференциацию, тогда как клетки табака, томата или моркови, как показала практика, подвергаются редифференциации сравнительно легко.
При растворении целлюлозной стенки растительной клетки ферментами-целюлазами, образуются протопласты, в которые легко проникают макромолекулы, в том числе и ДНК. Две различные клетки в виде протопластов соединяются с образованием гибридного протопласта – соматической гибридной клетки. протопласты способны восстанавливать клеточную стенку и далее давать целое растение. Растение может быть получено из протопластов, включивших чужеродную ДНК или из гибридных протопластов.
При наличии методов введения в растительные клетки определенных генов, способных к функционированию и стабильному наследованию, открываются реальные возможности создания растений с заранее полезными свойствами. Векторы для введения генов в растительные клетки могут быть основаны на репликонах растительных вирусов. Однако до настоящего времени попытки получить такие векторы, удовлетворяющие, в частности, требованию стабильного наследования, были не очень успешны.
Создан трансгенный рапс, содержащий гены отдельных нейропептидов человека, например, лей-энкефалина, связанного с геном альбумина семян рапса. С одного гектара земли, засеянного таким рапсом, можно получать до 3 кг нейропептида.
Создан новый сорт помидоров, длительно сохраняющийся без размягчения вследствие подавления активности фермента полигалактуронидазы.
Сконструированы такие генно-инженерные сорта сои, которые проявляют устойчивость к насекомым, гербицидам, вирусам и образуют больше запасных белков, обогащенных метионином.
На основе методов геномной инженерии получены межвидовые гибриды капусты, картофеля и табака с турнепсом, картофеля с помидором – «Помат», помидора дикого вида, устойчивого к некоторым вирусам, и культурного сорта.
Первое в мире генно-инженерное химерное растение «санбин» получено в США в результате переноса гена запасного белка бобов фазеолина в геном подсолнечника. В 1984-87 гг. получены трансгенные растения: табак, томаты, сельдерей, люцерна, хлопчатник. Внедрение в геном пшеницы генов, детерминирующих животные белки (миозин), может приблизить хлеб по качеству к продуктам животного происхождения.
Введение в растение гена, кодирующего белок тауматин (в 600 раз слаще глюкозы), может улучшить вкусовые качества многих фруктов, не увеличивая содержание углеводов.
В США выращиваются трансгенные растения рапса, сои, хлопчатника, устойчивые к гербицидам, созданы трансгенные томаты, содержащие гены вируса табачной мозаики, благодаря чему они устойчивы к другим вирусам.
Генно-инженерными методами в геном растения вводятся гены, кодирующие белки, токсичные для многих насекомых. Так получают сорта растений, устойчивые к вредителям. Генетическая инженерия решает проблему искусственной пищи. Уже сейчас в микроорганизмы вводятся гены, управляющие синтезом незаменимых аминокислот, ставится задача создания штаммов дрожжей, бактерий, вырабатывающих пищевые белки, причем культивировать их предполагается на отходах сахарной промышленности.
Трансгенным (или генетически модифицированным) называется растение, в геном которого методами генетической инженерии перенесены гены (их называют «трансгенами») из других организмов. Процесс переноса называется генетической трансформацией. Основными преимуществами такой технологии по сравнению с традиционной селекцией являются: возможность переноса всего одного гена, что практически не затрагивает исходный генотип; возможность придания признаков, которые нельзя перенести путем скрещивания с близкородственными видами; значительное ускорение процесса ускорения новых генотипов.
Наиболее широко используемый метод трансформации - агробактериальный был разработан на основе природного процесса. Почвенная бактерия Agrobacterium tumefaciens способна инфицировать двудольные растения, вызывая опухоли – корончатые галлы. Как выяснилось, при этом происходят перенос и встраивание в растительный геном двух групп генов: продукты одних вмешиваются в нормальный метаболизм растения и способствуют разрастанию опухоли, а продукты других синтезируют опины, вещества, ненужные растению, но используемые в пищу бактериями. Ученые модифицировали агробактерии таким образом, что они вместо собственных переносят в растения гены, нужные человеку.
Впоследствии был разработан ряд других методов трансформации растительных клеток, из которых наибольшее распространение приобрел биобаллистический. Он используется чаще всего для генетической модификации однодольных растений, нечувствительных к агробактериям. В специальных установках микрочастицы золота или вольфрама с нанесенной на них ДНК ускоряют при помощи сжатого геля, и они проникают в ДНК клеток мишени.
Признаки, которые возможно придать с помощью генной инженерии, весьма разнообразны и в основном ограничены только наличием соответствующих генов. Очень условно их можно разделить на три группы.
К первой относятся признаки, интересные производителям: устойчивость к различным факторам окружающей среды – гербицидам, болезням, вредителям, засухе, засолению, улучшение минерального питания, повышение укореняемости.
Вторая группа признаков представляет интерес непосредственно для потребителей – модификация вкуса и аромата плодов, увеличение продолжительности их хранения, изменение окраски цветков, бессемянность, улучшение питательной ценности растений.
В третью группу входят растения-«биофабрики», способные синтезировать вакцины, ферменты, биополимеры и другие полезные вещества.
Каллусная культура – это неорганизованная пролиферирующая ткань, состоящая из дифференцированных клеток. Каллус (означает мозоль) может образовываться как на изолированных кусочках ткани эксплантах, так и на целом растении при поражении. Каллусная ткань аморфна и не имеет анатомической структуры и может быть разной консистенции:
1. рыхлой, состоящей из сильно оводненных клеток, легко распадающихся на отдельные рыхлые анрегаты;
2. средней плотности с хорошо выраженными отдельными меристематическими очагами;
3. плотной, в которой дифференцируются элементы камбия и проводящей системы.
Обязательным условием дедифференцировки ткани и превращения ее в каллус является присутствие в питательной среде фитогормонов: ауксинов и цитокининов. Ауксины способствуют дифференцировке, а цитокинины вызывают пролиферацию.
Опухолевые клетки, в отличие от каллусных, могут расти на питательных средах, лишенных фитогормонов (ауксина, гетероауксина и др.). Они не могут образовывать нормально организованные вегетативные органы. И в некоторых случаях из них могут возникать уродливые органоподобные структуры, поэтому для размножения их применять нельзя.
ДНК бактерий существуют не только в виде хромосом, но и в виде маленьких кольцевых молекул (плазмид). Бактерии Agrobacterium tumefaciens помимо прочих содержат плазмиды, вызывающие опухоли (Ti-плазмиды). На такой плазмиде среди прочих генов имеется область Т-ДНК, содержащая гены, отвечающие за образование опухоли на растениях и синтез опинов. Именно этот кусочек плазмиды агробактерии встраивают в ДНК растений. Выяснилось, что агробактерии в принципе способны переносить в растения любую ДНК, которая расположена в этом месте плазмиды. Поэтому в плазмидах, используемых в генно-инженерных целях, природные гены заменяют любыми другими, представляющими интерес для человека. Как правило, это два-три гена: целевой, который придает, например, устойчивость к насекомым; селективный, который придает устойчивость к определенным веществам (чаще всего – антибиотикам), что позволяет трансформированной клетке расти в питательной среде с антибиотиками, в то время как нетрансформированные клетки в ней гибнут; и иногда репортерный ген, который позволяет качественно определить трансформированную клетку, например, по окрашиванию или свечению в ультрафиолетовом свете.
Регенерация растения из каллуса основана на тотипотентности. Это явление было открыто в лаборатории Габерланда. Тотипотентность – это свойство соматических клеток растений полностью реализовывать свой потенциал развития с образованием целого организма. Сущность его состоит в том, что если растительная клетка изолируется, она ведет себя подобно клетке зародышевого мешка, то есть образует эмбриоид и целое растение.
Тотипотентность культивируемых клеток свидетельствует том, что генетическая информация сохраняется. Но для ее реализации требуются специфические условия. К числу факторов, способных полностью или хотя бы частично восстановить замаскированную генетическую информацию, относятся свет, регуляторы роста, предшественники и элементы питания. Стимулирующее действие света на образование вторичных соединений было показано на примере каротиноидов, эфирных масел. Кроме этого важны температура, влажность, освещенность и периодическое обновление питательной среды, так как по мере роста клеток в ней накапливаются продукты метаболизма, что неблагоприятно действует на культуру. поэтому данная методика связана с пересадками, т.е. с переносом части биомассы на новую среду в другом сосуде («пассажи»). При культивировании растительные клетки имеют более низкие темпы размножения, чем микробиологические объекты, поэтому продолжительность культивирования определяется не десятками часов, а десятками суток.
Метод выращивания клеток in vitro состоит в том, что растительная, выделенная из любого органа растения ткань (эксплант), помещается на питательную среду, компоненты которой подбираются так, что они поддерживают нормальную жизнедеятельность клетки и стимулируют деление. Поэтому культивировать эти клетки можно только на сложных питательных средах, содержащих соли азота. К, Mg, P и ряд микроэлементов, из органических веществ – углеводы, аминокислоты, витамины, фитогормоны (кинетин, индолилуксусная кислота).
Каллусные клетки имеют различную форму. При каллусогенезе в мембранах возрастает содержание насыщенных жирных кислот, и исчезают ненасыщенные, имеет место процесс дифференцировки, т.е. переход клеток на уровень изолированной клетки.
Каллус можно получить из ряда растительных тканей. Молодые клетки более пригодные для этой цели, чем зрелые, это особенно заметно на листьях. Кусочки стебля древесных пород – плохой материал для каллуса. Любой вид растения дает каллус при соблюдении определенных методических приемов культивирования.
В клетках экспланта, состоящего из неделящихся специализированных клеток, в самом начале культивирования могут наблюдаться изменения в метаболизме, связанные с травматическими синтезами, с дедифференцировкой и подготовкой к процессу деления. Можно предположить, что травма приводит к высвобождению из клеток биологически активных веществ – индукторов клеточного деления, отличающихся по своей природе от известных стимуляторов роста (ауксинов, гиббереллинов).
Клональное микроразмножение – это использование техники in vitro для быстрого размножения растений, идентичным исходному, неполовым путем. Термин «клон» (от греческого – отпрыск) был предложен Вэбером в 1903 г. при изучении вегетативного размножения растений.
Клон – это совокупность клеток или особей, произошедших от общего предка путем бесполого размножения – основная единица учета в генетике микроорганизмов. В основе образования клонов лежит митоз, поэтому считается, что клон состоит из генетически однородных клеток. Однако это весьма относительно из-за спонтанных мутаций. Только клонированием удается сохранить особенности сорта. Клональное микроразмножение получения клонов растений путем выращивания их из одной клетки на основе тотипотентности клеточной культуры. Клональное размножение обладает рядом преимуществ и является чрезвычайно перспективным:
1. Коэффициент клонального размножения гораздо выше, чем при обычных методах размножения. Так, из одного растения герберы в год можно получить 50-100 растений обычным способом, при клональном размножении из культуры ткани до 1 млн.
2. Можно размножать растения круглый год.
3. Тысячи растений могут расти на относительно небольшой лабораторной площади.
4. Одновременно с размножением происходит и оздоровление растений (от вирусов и патогенных микроорганизмов).
5. Методом клонального размножения получают посадочный материал растений, которые медленно размножаются половым путем или совсем не размножаются вегетативно.
6. При клональном размножении, в отличие от полового размножения, получают генетически однородное потомство. Различают 2 вида клонального размножения:
1) маломасштабное (при селекционных работах);
2) массоклональное, коммерческое размножение;
а) освобождение от вирусов (картофель);
б) получение посадочного материала (цветы, сельскохозяйственные культуры).
При использовании в качестве эксплантов дифференцированных тканей растений возможно появление мутантных форм. Все манипуляции при клональном микроразмножении растений осуществляются в асептических условиях, то есть с соблюдением техники микробиологических работ. Работа проводится или в микробиологических боксах, облучаемых УФ-светом, или в ламинар-боксах, где асептика достигается подачей стерильного воздуха.
Весь процесс клонального микроразмножения имеет продолжительность около трех месяцев и его можно разделить на 4 этапа.
На первом этапе осуществляют выбор растения-донора, изоляцию и стерилизацию экспланта и создание условий для образования каллуса на твердой питательной среде.
Второй этап связан с увеличением числа инициалей на каллусе и формированием побега.
Третий этап – укоренение размножаемых пробирочных растений и адаптация их к условиям in vitro.
Четвертый этап – выращивание извлеченных из пробирок растений в теплице и закалка перед высаживанием в поле.
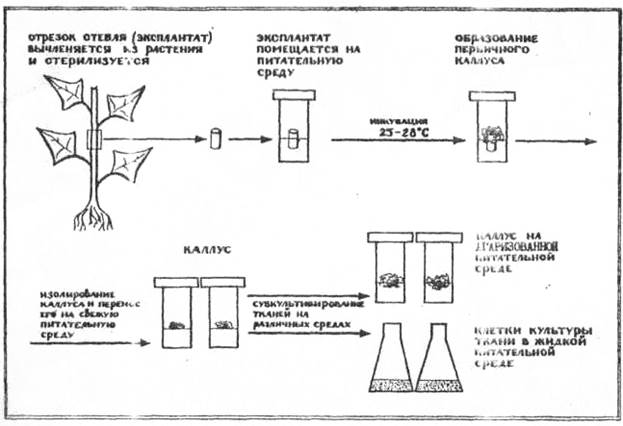 Одной из важных проблем размножения с помощью каллуса является сокращение периода каллусного роста.
Одной из важных проблем размножения с помощью каллуса является сокращение периода каллусного роста.
Рис. Схема получения культуры каллусных тканей
Получение растений через органогенез можно осуществить 3 способами:
1. Путем формирования придаточных органов на каллусе, полученном из экспланта.
2. Путем формирования придаточных органов прямо из экспланта без промежуточной фазы каллусообразования.
3. Путем формирования растений-регенерантов из побегов, образовавшихся из набухших почек.
Основные недостатки клонального микроразмножения растений:
1. Большая трудоемкость и высокие затраты. Необходима автоматизация и принципиально новые приемы. Среди них можно назвать отказ от укоренения растения in vitro и привлечение гидро- и аэропоники. В дальнейшем прогресс будет связан с автоматизацией и роботизацией трудоемких процедур.
2. Все особи данного вида происходят из единственной меристемы и обладают уменьшением генетического разнообразия. Поэтому новые болезни могут оказаться для них катастрофическими за счет одинаковой восприимчивости к патогенным микроорганизмам.
Поэтому наряду с развитием техники вегетативного размножения на основе культуры меристематических клеток необходимо иметь и коллекции семян для сохранения генотипов, необходимых для поддержания генетического разнообразия.
Дата добавления: 2016-07-11; просмотров: 3037;











