От концентрации реагентов
Так как скорость химической реакции зависит от столкновений, а количество столкновений в единице объема, очевидно, пропорционально концентрации сталкивающихся молекул, то можно предположить, что скорость реакции пропорциональна концентрациям реагентов, то есть для необратимой простой реакции
аА + bВ + .... = сС + dD + ...
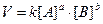
(закон действующих масс для скорости химической реакции).
Здесь k - константа скорости, то есть скорость реакции при [A] = [B] =
1 моль/л.
Эти рассуждения верны лишь в том случае, если реакция элементарная (в одном столкновении участвуют а молекул А, b молекул В) и при этом сразу образуются конечные продукты С, D и т. д. Если реакция сложная, то скорость зависит не только от [A] и [В], но и от концентраций промежуточных продуктов и скоростей их расходования, так что обычно коэффициенты в уравнении реакции не совпадают с а и b(они меньше их).В этом случае кинетическое уравнение записывается:
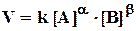 .
.
В других случаях имеют место более сложные уравнения. Например, для сложной (цепной) реакции
H2 + Br2 = 2HBr
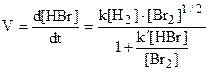 .
.
Уравнения типа вырыжающие закон действующих масс для скорости реакции называются кинетическими уравнениями химических реакций.
Коэффициенты а и bв этих уравнении носят название "молекулярность" реакции по веществу А и В, соответственно; сумма (а + b) - суммарная (общая) молекулярность простой реакции. Понятие "молекулярность" применимо только к простой реакции. Вычисления и наблюдения показывают, что (а + b) не может быть больше трех. Если для какой-либо реакции эта сумма больше трех, то можно утверждать, что реакция сложная. По количеству сталкивающихся в элементарном акте молекул реакции называют моно-, би- и тримолекулярными.
Коэффициенты aи b в уравнении для сложных реакций носят название "частный порядок" реакции по веществу А и В, соответственно, а сумма (a+b) - общий порядок реакции. Эти коэффициенты находят экспериментально, и они могут быть целыми, дробными, отрицательными и равными нулю.
Порядок и молекулярность простой реакции обычно совпадают, но если, например, концентрация одного из реагентов много больше, чем других, то скорость практически не зависит от этой концентрации и, хотя в реакции участвуют все молекулы, ее порядок будет меньше молекулярности. На этом основано нахождение порядков реакций по веществам - метод понижения порядка реакции.
Константа скорости (k) не зависит от концентраций реагентов, но зависит от природы реагентов, направления реакции (природы продуктов) и от температуры. Константу скорости находят из экспериментальных данных расчетом (известны V, [A], [B]...., a, b,...)
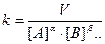 .
.
Как видно из этого выражения, единицы измерения (размерность) k зависит от порядка реакции:
для реакции первого порядка(a + b +...= 1) - с-1;
для реакции второго порядка -л·с-1·моль-1;
для реакции третьего порядка -л2·с-1·моль-2 .
Особенности кинетики гетерогенных реакций.Гетерогенные реакции идут на поверхности раздела фаз, поэтому особенностью кинетики этих реакций является влияние площади реакционной поверхности (S) на скорость реакции, при этом константа скорости
k = k¢·S.
Если в реакции участвуют твердые или жидкие вещества (не растворы), то их концентрация в кинетическом уравнении, как и в ЗДМ для равновесия, не учитывается. Например, для реакции
CaOк + CO2 (г) = CaCO3 к
кинетическое уравнение имеет вид V = k[CO2]a = k¢S[CO2]a,
а для реакции CaOк + H2Oж = Ca(OH)2 к - V = k = k¢S.
Дата добавления: 2016-07-05; просмотров: 1326;










