РЕАКЦИИ, ПРИМЕНЯЕМЫЕ В ХИМИКО-ТОКСИКОЛОГИЧЕСКОМ АНАЛИЗЕ ДЛЯ ОБНАРУЖЕНИЯ ИОНОВ МЕТАЛЛОВ
Все объявления
ЯндексДирект
Дать объявление
- Растворители в различной фасовке
Растворители 646,ацетон, у-спирит, скипидар,лак НЦ и БТ, краски МА и ПФ,в/э
www.chemservice.ru
Для обнаружения ионов металлов, содержащихся в минерализатах, применяют реакции образования осадков, микрокристаллоскопические и цветные реакции. В ряде случаев для этой цели применяются физико-химические методы.
Поскольку отравления соединениями металлов происходит после поступления в организм малых количеств различных химических соединений, содержащих металлы, в трупном материале эти металлы могут находиться только в незначительных количествах. Для обнаружения этих количеств ионов металлов в минерализатах требуются специфические и чувствительные реакции. Однако к чувствительности реакций на «металлические яды» в химико-токсикологическом анализе предъявляются и другие требования. Поскольку некоторые токсикологически важные металлы являются нормальной составной частью тканей организма (см. табл. 7), реакции, применяемые для обнаружения этих металлов в минерализатах, по чувствительности должны быть такими, которые не дают положительного результата с микроколичествами ионов металлов, входящих в состав тканей организма. Желательно, чтобы эти реакции были положительными только с относительно большими количествами ионов металлов, соединения которых вызвали отравление. Однако такие реакции в ряде случаев подобрать трудно.
Большинство окрашенных соединений, образующихся при взаимодействии ионов металлов с соответствующими реактивами, являются комплексами или ионными ассоциатами.
Ионные ассоциаты. В аналитической химии и химико-токсикологическом анализе для идентификации и фотометрического определения ряда веществ применяются реакции образования ионных ассоциатов. Особенно часто эти реакции используются для обнаружения и количественного определения алкалоидов и «металлических ядов».
Ионные ассоциаты (ионные пары) представляют собой не полностью диссоциированные солеобразные соединения. Они образуются в результате ассоциации противоположно заряженных ионов. Их не следует отождествлять с недиссоциированны-ми молекулами, так как в ассоциатах ионы удерживаются лишь слабыми силами Ван-дер-Ваальса. При усилении взаимодействия между ионами в пределах одного ионного ассоциата характер связи может изменяться от электростатического до ковалентного. Способностью образовывать ионные ассоциаты в основном обладают крупные ионы.
В анализе используются реакции образования ионных ассоциатов при взаимодействии хлорантимонатов с метиловым фиолетовым, бриллиантовым зеленым и др. Описаны ионные ассоциаты цезия с тетрародановисмутатом. Ионные ассоциаты образуются катионами основных красителей с анионами, представляющие собой ацидокомплексы металлов ([HgCl 4 ] 2-, [HgI 4 ] 2-, [BiI 4 ] — и др.). Для обнаружения мышьяка используются ионные ассоциаты, которые образуются при взаимодействии мышьяковистого водорода с диэтилдитиокарбаминатом серебра в пиридине, и т. д.
Реакции образования внутрикомплексных соединений. Для идентификации и количественного определения катионов металлов в химико-токсикологическом анализе широко используются реакции образования внутрикомплексных соединений. В качестве реактивов для указанной цели часто применяются дитизон, диэтилдитиокарбаминат аммония и др.
Дитизон (дифенилтиокарбазон) представляет собой тонкие сине-черные иглы с фиолетовым оттенком. Дитизон практически не растворим в воде, но хорошо растворяется во многих органических растворителях. В аналитической и токсикологической химии для растворения дитизона применяют четыреххлористый углерод или хлороформ. Растворы дитизона в хлороформе и в некоторых других органических растворителях обладают дихроматизмом (темно-красная окраска растворов дитизона в толстых слоях при разбавлении переходит в ярко-зеленую).
В молекуле дитизона содержится два атома водорода, которые способны замещаться на ионы металлов. Наличие в молекуле дитизона группы —С—S увеличивает подвижность ближайшего к сере атома водорода в —NH-группе, т. е. увеличивает кислотные свойства этого реактива. Поэтому дитизон в кислых растворах с катионами металлов образует только однозамещен-ные соединения. Подвижность атома водорода во второй —NH-группе дитизона значительно меньшая, чем в первой. В связи с этим замещение второго атома водорода в молекуле дитизона может происходить только в сильнощелочной среде.
Дитизон может быть в двух таутомерных формах:
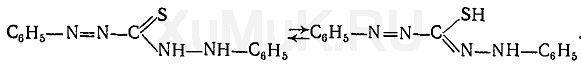
В анализе имеют значение только однозамещенные (кислые) дитизонаты.
Растворы дитизона в органических растворителях имеют два максимума поглощения в видимой области спектра. Так, спектр раствора дитизона в четыреххлористом углероде имеет две полосы поглощения с максимумами при 450 и 620 нм. Молярные коэффициенты светопоглощения дитизона в этом растворе соответственно равны 20 000 и 32 800. Более интенсивным является максимум при длине волны, равной 620 нм.
Окраска растворов однозамещенных дитизонатов, максимумы поглощения и значения рН, при которых максимально экстрагируются дитизонаты металлов, имеющих токсикологическое значение, приведены в табл. 8.
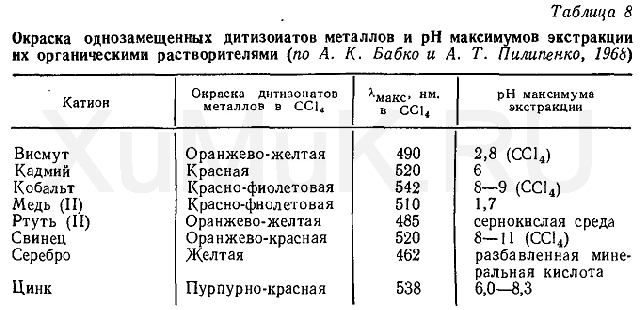
Дитизонаты железа и марганца являются нестойкими и быстро разлагаются. Дитизон при хранении подвергается окислению. Поэтому перед употреблением дитизона для аналитических целей он должен быть очищен от примесей. Способ очистки дитизона и приготовление его растворов приведен в Приложении 1, реактив 12.
Диэтилдитиокарбаматы. В химико-токсикологическом анализе для разделения и фотометрического определения ионов некоторых металлов широко используются соли диэтилдитиокарбаминовой кислоты:
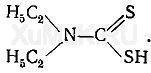
Диэтилдитиокарбаминовая кислота (ДДТК) нестойкая. Для аналитических целей в качестве реактивов применяются натриевая и аммониевая соли диэтилдитиокарбаминовой кислоты. Эти соли хорошо растворяются в воде, их растворы бесцветны. Натриевая и аммониевая соли диэтилдитиокарбаминовой кислоты с катионами тяжелых металлов образуют внутрикомплексные соединения (диэтилдитиокарбаматы):
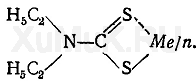
Эти соединения слабо растворяются в воде и хорошо —в некоторых органических растворителях. Большинство внутрикомплексных соединений тяжелых металлов с диэтилдитиокарбаминовой кислотой в органических растворителях бесцветны. Только некоторые растворы этих соединений имеют окраску. Так, диэтилдитиокарбамат меди имеет бурую окраску (λ макс = 440 нм), висмута — желтую (λ макс = = 370 нм), железа (II) и (III) — бурую (λ макс = 515 нм), никеля — желто-зеленую (λ макс = 395 нм), кобальта — зеленую ( λ макс = 650 нм), олова (II) и (IV)—оранжевую, хрома (III) — зеленую.
Для выделения диэтилдитиокарбаматов металлов из растворов и для разделения их смесей применяют метод экстракции. При этом в ряде случаев пользуются маскирующими средствами (цитратами, цианидами, комплексоном III и др.). Из аммиачной среды, содержащей цитраты и комплексон III, органическими растворителями экстрагируются диэтилдитиокарбаматы меди, ртути (П), серебра и висмута. При наличии цианидов экстрагируются диэтилдитиокарбаматы висмута, кадмия, свинца и галлия (III).
От прибавления минеральных кислот к диэтилдитиокарбаматам натрия и аммония они разлагаются и выделяется диэтилдитиокарбаминовая кислота, которая является нестойкой. При рH = 4 и ниже эта кислота разлагается с выделением диэтиламина и сероуглерода:
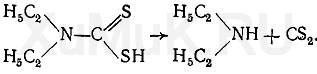
Для экстракции катионов тяжелых металлов из растворов в виде диэтилдитиокарбаматов поступают так: исследуемый раствор доводят до рН = 5 и прибавляют раствор диэтилдитиокарбамата аммония или натрия. При этом образуются диэтилдитиокарбаматы соответствующих катионов. Затем прибавляют раствор минеральной кислоты, в которой диэтилдитиокарбаматы тяжелых металлов не разлагаются, а в течение 2—3 мин разлагается избыток диэтилдитиокарбамата аммония, являющегося реактивом, с образованием диэтиламина и сероуглерода. После разложения избытка реактива минеральными кислотами экстрагируют диэтилдитиокарбаматы тяжелых металлов органическими растворителями.
Ниже описаны способы обнаружения «металлических ядов» в минерализатах, полученных после разрушения биологического материала азотной и серной кислотами.
Дата добавления: 2016-06-29; просмотров: 2167;











