Биосинтез аминокислот
Пути биосинтеза формирующих белок аминокислот (протеиноген-ных) довольно сложны, многоплановы (одна и та же аминокислота может синтезироваться разными способами) и могут существенно отличаться у разных организмов. Тем не менее существует довольно большое количество закономерностей в этих процессах, и для удобства все 20 протеиногенных аминокислот можно разделить на 5 биосинтетических семейств. Для принадлежащих к одному семейству аминокислот характерно наличие общих предшественников, которые образуются в ЦТК, в процессе гликолиза, в ходе пентозофосфатных путей.
Заменимые аминокислоты синтезируются с помощью довольно простых реакций, в то время как пути биосинтеза незаменимых аминокислот очень сложны. К незаменимым для белых крыс аминокислотам относятся: валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан, гистидин и аргинин. Восемь из десяти перечисленных аминокислот не синтезируются также организмом человека, являются ли гистидин и аргинин незаменимыми для человека, остается спорным.
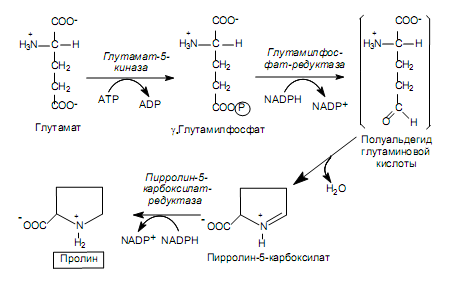
Биосинтез аминокислот семейства глутамата. К этому семейству относятся: глутамат, глутамин, пролин, и аргинин. Первые две аминoкислоты образуются из a-кетоглутарата, а аминогруппы берут свое начало из молекул аммиака (рис. 16.3). Пролин синтезируется из глутамата в ходе четырех реакций: g-карбоксильная группа глутамата реагирует с АТР, образуя ацилфосфат. Последний восстанавливается с участием NADРH до альдегида, а затем в ходе самопроизвольной дегидратации преобразуется в циклическое соединение — пирролин-карбоксилат. Этот продукт восстанавливается при участии NADPH в пролин (рис. 16.4).
Синтез аргинина (рис. 16.5) также осуществляется из глутамата, который вначале ацетилируется по аминогруппе, а затем подвергается уже описанным выше реакциям фосфорилирования и формирования полуальдегида. Однако g-полуальдегид N-ацетилглутамата не циклизуется, как в пути биосинтеза пролина, а трансаминируется с участием глутамата (Glu). В результате этой реакции образуется a-кетоглутарат (КГ) и N-ацетилорнитин. Последний подвергается деацетилированию с образованием орнитина. Орнитин превращается в аргинин в ходе нескольких реакций, представленных в цикле мочевины.
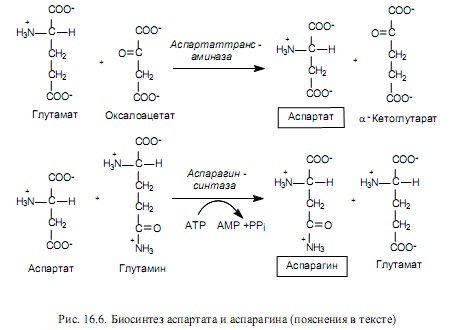
Биосинтез аминокислот семейства аспартата. К семейству аспартата относятся: аспартат, аспарагин, лизин, треонин, изолейцин и метионин. Пять последних аминокислот из этого состава синтезируются из аспартата, который, в свою очередь, образуется из оксалоацетата—промежуточного продукта ЦТК — в ходе реакции трансаминирования. Донором аминогруппы при этом выступает глутамат (рис. 16.6).
Аспартат служит предшественником для синтеза аспарагина, причем у многих бактерий может осуществляться прямое аминирование аспартата в АТР-зависимой реакции с участием аспарагинсинтетазы (16.2).
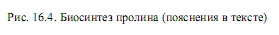
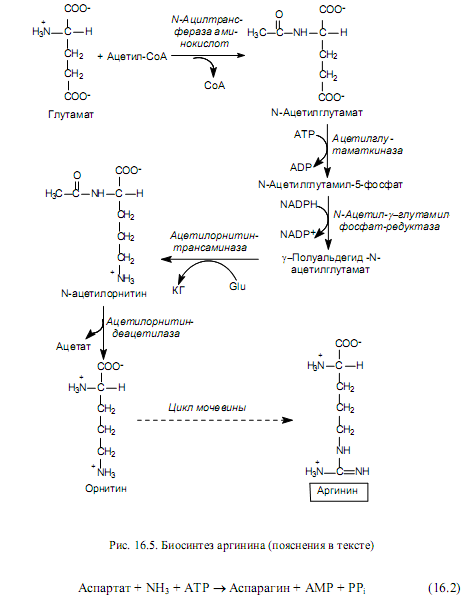
В клетках млекопитающих осуществляется другая реакция (рис. 16.6), в которой донором аминогруппы при образовании аспарагина выступает глутамин.
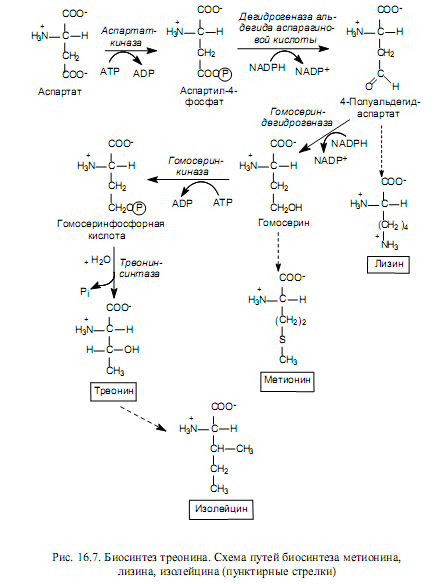
Лизин, метионин и треонин синтезируются из производных аспартата (рис. 16.7), а изолейцин — из треонина.
Лизин в клетках бактерий и растений синтезируется в ходе альдольной конденсации полуальдегида аспарагиновой кислоты и пирувата с последующим восстановлением, присоединением остатка сукцината, трансаминированием с участием глутамата, внутримолекулярной перестройкой и декарбоксилированием. В клетках грибов используется другой путь биосинтеза лизина — из a-кетоглутарата и ацетил-СоА.
Углеродный скелет метионина формируется из гомосерина, атом серы происходит от цистеина, а донором метильной группы служит N-метилтетрагидрофолиевая кислота.
Треонин служит источником четырех из шести углеродных атомов в молекуле изолейцина. На первой стадии синтеза треонин дезаминируется, превращаясь в 2-кетобутират, затем взаимодействует с пируватом, подвергается структурным перестройкам и реакции трансаминирования, в которой донором аминогруппы выступает глутамат.
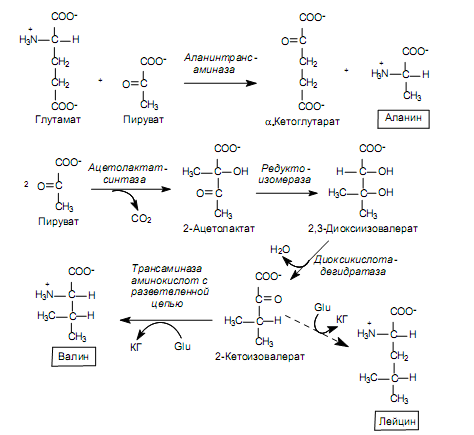
Биосинтез аминокислот семейства пирувата. Из пирувата синтезируются: аланин, валин и лейцин.
Аланин образуется в реакции трансаминирования, где донором аминогруппы служит глутамат (рис. 16.8). Синтез валина и лейцина имеет несколько общих стадий и начинается с образования ацетолактата. Этот метаболит формируется из двух молекул пирувата: одна из них декарбоксилируется, и образованный активный ацетат переносится на вторую молекулу (рис. 16.8). Эту реакцию катализирует ацетолактат-синтаза при участии тиаминпирофосфата. 2-Ацетолактат восстанавливается в диоксиизовалериановую кислоту, что сопровождается миграцией метильной группы. Диоксиизовалерат дегидратируется в 2-кетоизовалерат. Этот продукт может превращаться в валин в реакции трансаминирования с участием глутамата, а также конденсироваться с ацетил-СоА и в ходе нескольких реакций (изомеризация, восстановление, декарбоксилирование, трансаминирование) преобразовываться в лейцин. Донором аминогруппы в образовании лейцина также является глутамат (рис. 16.8).
Биосинтез аминокислот семейства серина. В семейство входят серин, цистеин и глицин. Предшественником этих аминокислот является 3- фосфоглицерат — промежуточный продукт гликолиза.
3-Фосфоглицерат окисляется в 3-фосфогидроксипируват, а затем аминируется с участием глутамата в 3-фосфосерин и дефосфорилируется в серин (рис. 16.9). Существует и альтернативный путь, когда отщепление фосфатной группы происходит до реакции окисления:
3-Фосфоглицерат→Глицерат→Гидроксипируват→Серин
Серин служит субстратом для синтеза глицина и цистеина. При образовании глицина b-углеродный атом боковой цепи серина акцептируется переносчиком одноуглеродных фрагментов — кофактором тетрагидрофолиевой кислотой при участии фермента серин-гидроксиметил-трансферазы (рис. 16.9). Существует и другой путь синтеза глицина: из СО2, NH+4 и метилентетрагидрофолиевой кислоты, который катализируется глицин-синтазой.

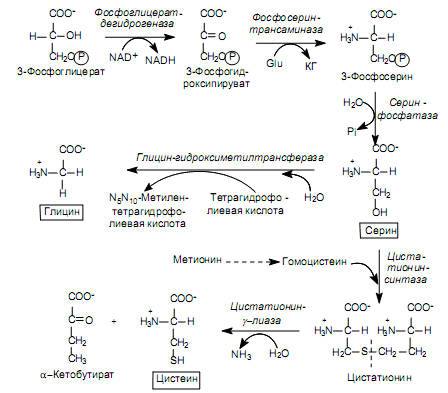

Превращение серина в цистеин связано с замещением атома кислорода боковой цепи на атом серы, донором которого является метионин. Вначале метионин в серии АТР-зависимых реакций, где образуется его активированная форма (S-аденозилметионин), теряет метильную группу при атоме серы и превращается в гомоцистеин:
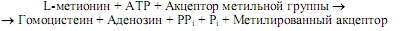
Затем гомоцистеин взаимодействует с серином, образуя цистатионин, который расщепляется цистатионин-g-лиазой на цистеин и a-кетобутират (рис. 16.9).
У некоторых микроорганизмов существует альтернативный путь синтеза цистеина, где донором атома серы служит сероводород. В этом случае серин вначале ацетилируется за счет ацетил-СоА (катализирует реакцию серинтрансацетилаза), а затем ацетилсерин взаимодействует с сероводородом при участии О-ацетилсерин-сульфгидролазы:
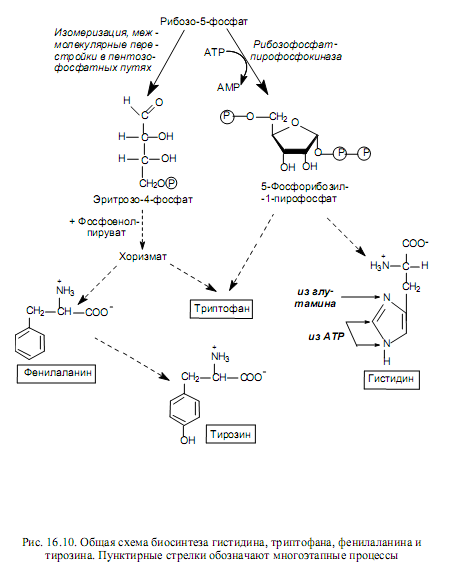
Биосинтез аминокислот семейства пентоз. Принадлежащие к этому семейству аминокислоты (гистидин, триптофан, фенилаланин и тирозин) синтезируются при участии пятиуглеродного промежуточного соединения пентозофосфатных путей — рибозо-5-фосфата, на основании чего их и объединяют в семейство пентоз. На рис. 16.10 показаны пути преобразования рибозо-5-фосфата, приводящие к формированию соединений, из которых синтезируются названные аминокислоты.
Процесс биосинтеза гистидина довольно сложен и осуществляется с участием 5-фосфорибозил-1-пирофосфата, АТР и глутамина. На рис. 16.10 в составе молекулы гистидина показано происхождение атомов углерода и азота: один атом азота имидазольного кольца происходит из амидной группы глутамина, другой атом азота и один из углеродных атомов кольца берут начало от АТР, а остальные углеродные атомы ведут происхождение от 5-фосфорибозил-1-пирофосфата.
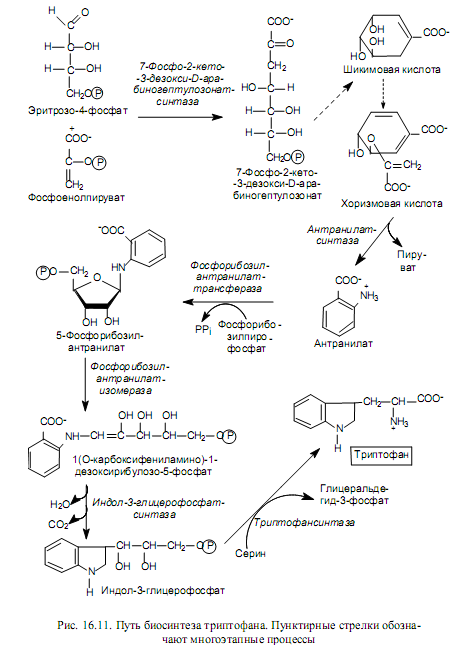
Биосинтез ароматических аминокислот начинается со стадии конденсации эритрозо-4-фосфата с фосфоенолпируватом. Образующееся семиуглеродное соединение (7-фосфо-2-кето-3-дезокси-D-арабиногептулозо-нат) дефосфорилируется, циклизуется, дегидратируется и восстанавливается при участии NADPH в шикимовую кислоту. Шикимовая кислота претерпевает еще одну конденсацию с фосфоенолпируватом и после элиминирования остатка фосфорной кислоты превращается в хоризмовую кислоту (рис. 16.11). Хоризмат служит основным предшественником пути биосинтеза триптофана, который изображен на рис. 16.11.
Хоризмовая кислота используется также для синтеза фенилаланина, т. е. на этапе ее формирования пути биосинтеза двух незаменимых ароматических аминокислот — триптофана и фенилаланина — расходят-ся (отсюда и название хоризмата, которое происходит от греческого слова, означающего «вилка»).
Фенилаланин образуется в ходе трех последовательных реакций: изомеризации хоризмата в префенат, дегидратирования и декарбоксилирования префената в фенилпируват и трансаминирования фенилпирувата с участием глутамата.
Заменимая кислота тирозин может синтезироваться из фенилаланина путем его гидроксилирования с участием фенилаланин-4-моноокси-геназы, а также из префеновой кислоты после ее декарбоксилирования и аминирования.
Закономерности биосинтеза аминокислот. Обзор путей биосинтеза протеиногенных аминокислот позволяет выявить следующие основные закономерности этих процессов: 1) углеродные скелеты аминокислот берут свое начало от промежуточных продуктов гликолиза (3-фосфоглицерат, фосфоенолпируват, пируват), пентозофосфатных путей (рибозо-5-фосфат и эритрозо-4-фосфат), ЦТК (оксалоацетат и a-кетоглутарат); 2) донором аминогрупп для большинства протеиногенных аминокислот служит глутамат, реже—глутамин; реакции, в которых аминогруппа аминокислоты переносится на кетокислоту, называются «реакции трансаминирования»; 3) биосинтез многих аминокислот осуществляется «семействами», для которых используются общие предшественники; многие аминокислоты сами служат субстратами для синтеза других аминокислот; 4) многие стадии биосинтеза аминокислот требуют притока энергии и сопровождаются гидролизом АТР (стадии синтеза гистидина, пролина, метионина, аспарагина, глутамина, аргинина); кроме этого, используется энергия активированных молекул, участвующих в синтезе; наконец, из катаболических и амфиболических процессов изымаются промежуточные продукты, которые могли бы обеспечить клетке запасание энергии; 5) многие этапы биосинтеза аминокислот требуют участия восстановительных эквивалентов (NADH и NADPH), которые могли бы быть окислены в дыхательной цепи и обусловить энергетический выигрыш.
Таким образом, биосинтез аминокислот обходится клетке достаточно дорого. Неудивительно поэтому, что данный процесс в каждом организме (клетке) подвержен очень сложной регуляции (глава 19), которая, с одной стороны, определяется сложностью и разветвленностью самого биосинтеза протеиногенных аминокислот, а с другой стороны, должна обеспечить строгую экономию клеточных ресурсов (энергии, восстановительных эквивалентов, строительных блоков). Закономерным представляется и тот факт, что при наличии экзогенных аминокислот, клетки микроорганизмов, в частности, не осуществляют их синтез самостоятельно, а используют готовые формы.
Дата добавления: 2016-05-30; просмотров: 8194;











