Электрический аккумулятор
Электрический, например, свинцовый аккумулятор как раз является таким устройством, в котором ФПВР возбуждается химической реакцией.
В пристенном слое свинцовой пластины-анода, имеющей отрицательный избыточный заряд происходит реакция
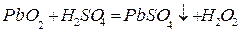 .
.
Перекись водорода тут же диссоциирует, образуя пристенную плазму:
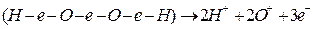 .
.
Три электрона-генератора на 4 положительных иона сразу начинают ФПВР. Образуется порядка 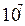 электрино на один электрон. Они вступают во взаимодействие с отрицательным потенциалом пластины и переходят в орбитальное движение вокруг анода, затем через клеммы на проводник к потребителю. Часть неиспользованного тока возвращается на катод, другая часть рассеивается у потребителя в пространство, в основном, в виде тепловых фотонов. Напряжение анодного вихря на
электрино на один электрон. Они вступают во взаимодействие с отрицательным потенциалом пластины и переходят в орбитальное движение вокруг анода, затем через клеммы на проводник к потребителю. Часть неиспользованного тока возвращается на катод, другая часть рассеивается у потребителя в пространство, в основном, в виде тепловых фотонов. Напряжение анодного вихря на 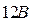 выше катодного (там плазмы нет), чем обеспечивается движение электрино – от большого напряжения к меньшему.
выше катодного (там плазмы нет), чем обеспечивается движение электрино – от большого напряжения к меньшему.
Атомы Н обращаются в нейтроны и выбывают из игры. Атомам кислорода, испытавшим дефект массы уже не образовать молекулу 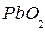 ввиду утери 82% своего положительного заряда. Эти атомы, соединяясь с отработавшими электронами-генераторами, образуют ионы
ввиду утери 82% своего положительного заряда. Эти атомы, соединяясь с отработавшими электронами-генераторами, образуют ионы 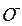 . Остальные электроны-генераторы связывают положительные молекулы воды в (
. Остальные электроны-генераторы связывают положительные молекулы воды в ( 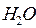 )–. Отрицательные ионы
)–. Отрицательные ионы 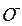 ,
, 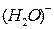 ,
, 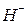 у анодной пластины с положительными электрино образуют барьер. Электрино разбиваются на вихри вокруг отрицательных ионов как вокруг атомов в металлических проводниках и по ионной дорожке – токопроводнику следуют от катода к аноду. При зарядке аккумулятора картина – обратная. Львиная доля зарядного тока расходуется на нейтрализацию отрицательных ионов.
у анодной пластины с положительными электрино образуют барьер. Электрино разбиваются на вихри вокруг отрицательных ионов как вокруг атомов в металлических проводниках и по ионной дорожке – токопроводнику следуют от катода к аноду. При зарядке аккумулятора картина – обратная. Львиная доля зарядного тока расходуется на нейтрализацию отрицательных ионов.
Как видно, источником электрино является вода, она расходуется; 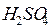 и
и 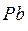 сохраняется неизменными. Однако при смене электролита выбрасывается и кислота. При зарядке полной нейтрализации
сохраняется неизменными. Однако при смене электролита выбрасывается и кислота. При зарядке полной нейтрализации 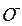 не происходит, что обеспечивает ионную электропроводность раствора. Но есть опасность полной нейтрализации и выхода аккумулятора из строя.
не происходит, что обеспечивает ионную электропроводность раствора. Но есть опасность полной нейтрализации и выхода аккумулятора из строя.
Строение атома
Атом состоит из нейтронов со слегка разбалансированными зарядами. Нейтрон описан выше в §2. Протонов нет, как нет и орбитальных электронов, поэтому порядковый номер элемента не несет смысловой нагрузки. Нейтроны и атомы – это электростатические системы, ничто в них не движется. Как было выше указано, уточнены атомные массы элементов и атомные числа, которые округлены до целого числа нейтронов.
Сложившиеся представления о валентности не соответствуют фактам. Так, валентность группы щелочных металлов считают одинаковой и равной +1. Но хорошо известно, что эти металлы обладают не одинаковой химической активностью; их реакционноспособность возрастает от лития к цезию. Обратная картина наблюдается у галогенов: реакционноспособность резко уменьшается от фтора к астату при, как считают, единой валентности группы, равной –1.
Как было показано выше, нет иных взаимодействий, кроме электростатического и электродинамического, и химические реакции также входят в этот класс взаимодействий. И именно величина и знак избыточного заряда определяют химическую активность элемента и его отношение к другим реагентам. Как было показано на примере углерода и других элементов валентность определяется свойствами этих элементов по несложным формулам. Знак заряда определяется по соединениям элемента и по его участию в реакциях.
Установление природы электрического тока и электропроводности металлов на атомном и субатомном уровне однозначно утвердило электроотрицательность атомов металлов и электроположительность диэлектриков. Полупроводники меняют эти свойства при изменении условий (температура) за счет электронов связи, которые при этом выходят за пределы кристаллической решетки.
Стало понятно, что все электроположительные атомы соединяются в молекулы с помощью электронов связи, и эти электроны надо учитывать по балансу в формулах химических реакций. При этом, как указывалось в §6, поверхность электроположительных полей превышает поверхность электроотрицательных полей на пять порядков. Поэтому связующим звеном между атомами в молекулах могут быть только электроотрицательные частицы – электроны связи. Этому способствует также то, что электрические поля структурных электронов заняты, во-первых, внутри нейтронов построением и удержанием их конструкции и, во-вторых, – внутри атомов скреплением нейтронов между собой. То есть на внешние электрические поля остается совсем немного заряда, да и тот, как видно, распределен на мизерной площади внешней поверхности атомов. Подавляющее преобладание электроположительной поверхности и приводит к тому, что соединение атомов в молекулы осуществляется только с помощью электронов связи.
Валентность подгруппы первой группы щелочных металлов периодической системы приведена в таблице 1. Она подтверждает установленные практикой факты реакционноспособности этих элементов. Валентность элементов 2-го периода также дана в таблице 1.
Кроме того, как оказалось, у благородных газов нет нарушения электронного состава – в этом их главная особенность; но электринный состав нарушен. Лишь у криптона и ксенона избыточный заряд достигает той величины, когда они способны вступить в химическое взаимодействие с самыми электроположительными элементами – кислородом и фтором.
Каждый период начинается с сильно электроотрицательных металлов (в начале – щелочной металл). Электроотрицательность постепенно уменьшается и типичные металлы, ближе к концу периода, заменяются элементами-полупровод-никами, а заканчивается период одним из галогенов – электроположительным элементом, типичным неметаллом.
Таблица 1
Дата добавления: 2016-06-29; просмотров: 2047;











