Алгоритмы первичного возмещения кровопотери
(мужчина средних лет, масса тела 70 кг, кровопотеря 20,30 и 50 % ОЦК)
| Кровопотеря 20 % ОЦК— 1000 мл: стабильное состояние, систолическое АД не ниже 100 мм рт.ст., пульс 100 в минуту, возможна ортостатическая гипотензия | ||
| вариант 1: гетерогенные коллоидные растворы - полиглюкин, макродекс, или ХАЕС-стерил); растворы Рингера, 0,9 % раствор натрия хлорида и др., содержащие Nа+ и Сl - 1800 мл; трансфузия крови, плазмы и альбумина не требуется. | вариант 2: полиглюкин 400 мл (или макродекс, ХАЕС-стерил — 800 мл, растворы электролитов — 600 мл | |
| Кровопотеря 30 % ОЦК — 1500 мл: артериальная гипотензия в положении лежа, систолическое АД ниже 100 мм рт.ст., пульс более 100 в минуту; • гетерогенные коллоидные растворы — 800—1000 мл струйно; • раствор Рингера, 0,9 % раствор натрия хлорида, ионостерил и др. - 1500-2100 мл; • возможно: плазма, альбумин; • эритроцитная масса — 250 мл или цельная кровь — 500 мл. | ||
| Кровопотеря 50 % ОЦК — 2500 мл: отсутствие пульса на периферических артериях, полиорганная недостаточность. • коллоидные растворы — 1200 мл струйно; • электролитные растворы — 2000 мл струйно; • плазма, альбумин — 800 мл; • эритроцитная масса — до 750 мл или цельная кровь — до 1000-1500 мл. | ||
При массивной кровопотере, превышающей 50 % ОЦК, препаратами выбора являются человеческий альбумин и эритроцитная масса. Удельный вес синтетических коллоидов при этом из-за риска аллергических реакций должен быть уменьшен. Кровопотеря, превышающая ОЦК, сопровождается значительным снижением содержания тромбоцитов и факторов свертывания. В связи с этим при массивной кровопотере необходимо использовать свежую тромбоцитную массу и свежезамороженную плазму. Коррекция же системы гемостаза должна проводиться в зависимости от изменений коагулограммы.
Окончательное возмещение кровопотери требует точного контроля ее объема и секторального распределения. На этом этапе важно определение как количественных, так и качественных критериев инфузионной терапии! При продолжающемся дефиците ОЦП показаны инфузии плазмы, протеина и альбумина (необходимы контроль ОЦП и КОД плазмы, концентрации общего белка и альбумина).
Окончательное возмещение кровопотери. Под окончательным возмещением кровопотери подразумевается полная коррекция всех нарушений — систем гомеостаза, секторального распределения жидкости, осмолярности, концентрации гемоглобина и белков плазмы. При продолжающемся дефиците ОЦП проводят инфузии коллоидных, преимущественно аутогенных растворов: плазмы, протеина и альбумина.
Критерии возмещения кровопотери: объем внутрисосудистой жидкости (плазмы) — 42 мл/кг массы тела, концентрация общего белка — не ниже 60 г/л, уровень альбуминов плазмы — не ниже 37 г/л, КОД плазмы — не ниже 20 мм рт.ст.
При дефиците объема циркулирующих эритроцитов, превышающем 30 %, проводят инфузии эритроцитной массы. Концентрация гемоглобина в плазме не должна быть ниже 80 г/л (при условии адекватной доставки и потребления кислорода тканями). В противном случае поддерживают концентрацию гемоглобина на уровне 100 г/л.
При дефиците интерстициальной жидкости требуется дополнительное введение изотонических растворов, содержащих натрий и хлор. При возмещении кровопотери следует учитывать потерю жидкости, связанную с перспирацией и возможной торакоабдоминальной операцией. Если кровопотеря связана с травмой или обширной операцией, общий дефицит жидкостного объема может значительно превышать приведенные расчеты, а характер водно-электролитных нарушений может быть иным. Поступление воды и натрия в клетки способствует развитию отека. Из клеток же во внеклеточное пространство перемещаются калий и фосфаты — механизм, описанный при тяжелой травме и стрессе — «трансминерализация».
При избытке интерстициальной жидкости требуется прекращение инфузии кристаллоидных растворов. При значительном превышении объема интерстициального пространства показаны диуретики. Критерии адекватного возмещения интерстициального сектора (объем его составляет в среднем 15 % массы тела и легко определяется аппаратом «спутник трансфузиолога»): осмолярность внеклеточной жидкости 280—300 мосм/л, концентрация натрия 130—150 ммоль/л, диурез 50 мл/ч.
Дефицит жидкости во внутриклеточном водном пространстве (клеточная дегидратация) может возникать при гиперосмолярном состоянии плазмы, например при избытке ионов Na+ Сl-, недостаточном их возмещении безэлектролитными растворами. Коррекция — восстановление осмолярности плазмы, инфузии растворов глюкозы с инсулином.
Избыток внутриклеточной жидкости может наблюдаться при неустраненной гипонатриемии, сниженной осмолярности плазмы, инфузиях безэлектролитных соединений. При дисбалансе K+, Mg2+ Ca2+ нарушениях КОС также необходима коррекция.
Новые подходы к лечению гиповолемического шока. Травма в сочетании с ГШ является ведущей причиной смертности людей молодого возраста. Одним из факторов отсроченной смерти является развитие синдрома полиорганной недостаточности (СПОН) в постреанимационном периоде. Первичными факторами, которые определяют риск развития СПОН вследствие травмы и кровопотери, считают нарушения микроциркуляции, вызывающие тканевую гипоксию и расстройства клеточных функций. Причинами снижения кровотока в тканях и органах служат гиповолемия и низкое перфузионное давление.
В настоящее время выделяют следующие механизмы, вызывающие СПОН:
• высвобождение различных медиаторов, особенно цитокинов (интерлейкины, интерферон, туморнекротизирующий фактор и др.), активацию макрофагов;
• нарушение микроциркуляции и повреждение эндотелия сосудов;
• снижение барьерной функции кишечника, что ведет к проникновению через поврежденную стенку кишки бактерий или эндотоксинов.
Первичная инфузия при тяжелом кровотечении обычно заключается в быстром вливании коллоидных и кристаллоидных растворов. Однако в тяжелых случаях нагрузка объемом вводимой жидкости не может восстановить трофический потенциал кровотока и клеточный гомеостаз, особенно в паренхиматозных органах, и предотвратить трансформацию шока в СПОН. При введении большого количества жидкости имеется риск развития тяжелого отека слизистой оболочки кишечника, легких, клеточных структур и нарушений микроциркуляции.
Использование гипертонического раствора натрия хлорида при ГШ, как в эксперименте, так и в клинике, показало его несомненные преимущества. Доказана способность 7,5 % солевого раствора повышать системное АД,СВ,улучшать микроциркуляцию и выживаемость. Новизна предлагаемой концепции состоит в действии на микроциркуляцию и получении немедленного улучшения центральной гемодинамики при объеме первичной инфузии из расчета 4 мл/кг массы тела у больных с гиповолемией и шоком. Внутривенная инфузия небольшого объема 7,5 % раствора натрия хлорида приводит к недолговременному, но существенному повышению осмолярности плазмы (7,5 % раствор натрия хлорида имеет осмолярность 2400 мосм/л).
Одновременно применяют гетерогенные коллоидные растворы (10 % раствор декстрана-60-70, реже гидрооксиэтилкрахмал), которые повышают онкотическое давление плазмы и тем самым оказывают гемодинамическое действие. Одновременное применение гипертонического раствора натрия хлорида и коллоидов проявляется в сочетанном эффекте, связанном с повышением осмолярности плазмы и онкотического давления. Цель применения коллоидов в этом сочетании — удержание возмещенного внутрисосудистого объема в течение длительного времени.
Основные эффекты, наблюдаемые при введении гипертонического раствора натрия хлорида приГШ:
• быстро повышает АДи СВ;
• увеличивает преднагрузку и снижаетОПСС;
• повышает эффективную тканевую перфузию;
• снижает риск отсроченной полиорганной недостаточности.
В то же время не следует забывать об опасностях применения солевых растворов. К потенциальным опасностям их использования следует отнести развитие гиперосмолярного состояния, отрицательный инотропный эффект (вследствие быстрой инфузии), усиление кровопотери в случае неостановленного кровотечения.
Главным отличием данного метода является «малообъемный принцип», т.е. общий объем жидкостного возмещения кровопотери должен быть во много раз меньше, чем при использовании изотонических кристаллоидных растворов.
Методика применения 7,5 % раствора натрия хлорида при ГШ:
• общий объем вводимого гипертонического раствора хлорида натрия должен составлять 4 мл/кг массы тела, т.е. от 100 до 400 мл;
• раствор вводят дробно болюсно по 50 мл с небольшими перерывами (10-20 мин);
• введение солевого раствора комбинируют с 10 % раствором декстрана-60-70;
• введение растворов прекращают при стабильном АД, стабильной гемодинамике и других признаках отсутствия шока.
Гемодинамический мониторинг по технологии «МЕДАСС». Мониторы параметров центральной гемодинамики (РПЦ-01, РПКА 2-01) с математическими программами обработки реосигнала «Импекард-3», «Реодин», «Реодин-орто» предназначены для бескровного динамического исследования всех важнейших показателей: ЧСС, ударного и минутного объемов сердца, СИ, индекса ударной и минутной работы левого желудочка, ДНЛЖ, ОПСС и др.
РПЦ-01, РПКА 2-01 прошли технические и клинические испытания и рекомендованы Министерством здравоохранения РФ к применению в клинической практике. Область применения очень широкая — от функциональной диагностики до мониторного контроля в интенсивной терапии.
Комплекс содержит измерительный реографический преобразователь IBM-совместимую персональную ЭВМ и программное обеспечение. В выходных документах (данные) имеются таблица основных параметров центральной гемодинамики, обозначен тип кровообращения (синтезированное заключение, основанное на анализе сочетания основных параметров гемодинамики), кривая Франка—Старлинга, временные тренды и графики перечисленных параметров. Количество исследований у пациента не ограничено.
Гидродинамический мониторинг по технологии «МЕДАСС». Анализатор оценки баланса водных секторов организма «АВС-01 МЕДАСС» предназначен для оценки и мониторирования баланса водных сред организма. Область применения анализатора — реаниматология и интенсивная терапия, анестезиология, терапия и др.
Принцип работы анализатора основан на использовании зависимости баланса вне- и внутриклеточной жидкости от соотношения электрического сопротивления тканей организма на высокой и низкой частоте. Электродная система анализатора подключается к голеням и запястьям. Обработка и представление полученных результатов осуществляются персональной ЭВМ, на экране которой и, по желанию врача, на бумажном носителе могут быть отражены содержание и тренды вне- и внутриклеточной жидкости в тканях, ОЦК в абсолютных значениях, их соотношение с должными величинами и другие параметры водно-солевого баланса.
Таблица данных экспресс-исследования содержит величину безжировой массы, измеренные и должные величины общего объема воды, объема внеклеточной и внутриклеточной воды, ОЦК и ОЦП. На основании полученных результатов врач определяет дальнейшую программу лечения. Динамическое исследование водных секторов — это контроль адекватности проводимой жидкостной терапии.
Глава 17
СЕПТИЧЕСКИЙ ШОК
Сепсис, являясь первостепенной медицинской проблемой и на сегодняшний день, продолжает оставаться одной из ведущих причин смертности, несмотря на различные открытия в патогенезе этого заболевания и применение новых принципов лечения. Тяжелым осложнением сепсиса является септический шок.
Септический шок — сложный патофизиологический процесс, возникающий в результате действия экстремального фактора, связанного с прорывом в кровоток возбудителей или их токсинов, что вызывает наряду с повреждением тканей и органов чрезмерное неадекватное напряжение неспецифических механизмов адаптации и сопровождается гипоксией, гипоперфузией тканей, глубокими расстройствами обмена.
В литературе септический шок принято обозначать как инфекционно-токсический, бактериотоксический или эндотоксический шок. Тем самым подчеркивается, что данный вид шока развивается только при генерализованных инфекциях, протекающих с массивной бактериемией, интенсивным распадом бактериальных клеток и высвобождением эндотоксинов, нарушающих регуляцию объема сосудистого русла. Септический шок может развиваться не только при бактериальных, но и при вирусных инфекциях, инвазиях простейшими, грибковом сепсисе и др.
В общеклинической практике проблема септического шока сейчас приобрела особую актуальность в связи с повсеместным ростом септических заболеваний. Число больных сепсисом за последние годы возросло в 4—6 раз [Gomez J. et al., 1995]. Этому способствовало широкое, часто нерациональное применение антибиотиков, подавляющих конкурентную флору и создающих условия для селекции нечувствительных к ним возбудителей, а также использование глюкокортикостероидов и иммунодепрессантов, угнетающих защитные механизмы. Немаловажную роль играют увеличение среднего возраста больных, а также преобладание в этиологии сепсиса «госпитальной» флоры, резистентной к антибиотикам.
Развитие внутрибольничного сепсиса и септического шока может быть обусловлено различными факторами. Вероятность инфицирования и риск развития септического шока несут с собой некоторые диагностические и лечебные процедуры, загрязнение внутривенных сред. Большой процент септических состояний связан с послеоперационными осложнениями. Повышенной вероятности развития сепсиса могут способствовать некоторые неотложные состояния, например панкреатит, жировая эмболия, геморрагический шок, ишемия и различные формы травм, сопровождающиеся повреждением тканей. Хронические заболевания, осложненные изменениями в иммунной системе, могут увеличить риск возникновения генерализованной инфекции.
В этиологии септического шока чаще всего преобладает грамотрицательная инфекция (65—70 % случаев), но он может развиться и при сепсисе, вызванном грамположительными бактериями.
Достижения в области молекулярной биологии и иммунологии предоставили возможность понять многие патогенетические механизмы развития септического шока. В настоящее время доказано, что инфекция сама по себе не является непосредственной причиной многочисленных патологических сдвигов, характерных для сепсиса. Скорее всего они возникают как результат ответной реакции организма на инфекцию и некоторые другие факторы. Этот ответ обусловлен усилением действия различных эндогенных молекулярных веществ, которые запускают патогенез сепсиса. Если при нормальном состоянии подобные молекулярные реакции можно расценить как реакции приспособления или адаптации, то во время сепсиса их чрезмерная активация носит повреждающий характер. Известно, что некоторые из этих активных молекул могут высвобождаться непосредственно на эндотелиальной мембране органа-мишени, приводя к поражению эндотелия, и вызывать дисфункцию органа.
Некоторые известные медиаторы повреждения эндотелия, вовлекаемые в септические реакции:
• туморнекротизирующий фактор (TNF);
• интерлейкины (ИЛ-1, ИЛ-4, ИЛ-6, ИЛ-8);
• фактор активации тромбоцитов (PAF);
• лейкотриены (В4, С4, D4, Е4);
• тромбоксан А2;
• простагландины (Е2, Е12);
• простациклин;
• гамма-интерферон.
Наряду с вышеперечисленными медиаторами повреждения эндотелия в патогенез сепсиса и септического шока вовлекается много других эндогенных и экзогенных медиаторов, которые становятся слагаемыми воспалительного ответа.
Потенциальные медиаторы септического воспалительного ответа:
• эндотоксин;
• экзотоксин, части клеточной стенки грамотрицательной бактерии;
• комплемент, продукты метаболизма арахидоновой кислоты;
• полиморфно-ядерные лейкоциты, моноциты, макрофаги, тромбоциты;
• гистамин, клеточные адгезивные молекулы;
• каскад коагуляции, фибринолитическая система;
• токсические метаболиты кислорода и другие свободные радикалы;
• калликреин-кининовая система, катехоламины, стрессовые гормоны.
Развитие септического процесса осложняется тем, что медиаторы сепсиса могут взаимодействовать между собой, активируя друг друга. Следовательно, в развитии септического шока в отличие от других видов шока важную роль играет взаимодействие эндотоксина с медиаторными системами организма. Общепризнанно, что септический шок, как и анафилактический, является иммунопатологическим состоянием, когда в ответ на «прорыв инфекта» нарушается или снижается фагоцитоз, в крови появляются блокирующие субстанции и развивается вторичный иммунный дефицит. Эндотоксин также выполняет роль индуктора макрофагов и каскадных систем, персистирующего и после нарушений гомеостаза. В развитии этих изменений ведущее значение принадлежит TNF, интерлейкинам (ИЛ-1, ИЛ-6, ИЛ-8) и т.д. Кроме того, микробная инвазия и токсемия быстро приводят к глубоким метаболическим, эндокринным и циркуляторным расстройствам.
Нарушения гемодинамики и транспорта кислорода при септическом шоке занимают одно из центральных мест и отличаются большой сложностью. Некоторые исследователи утверждают, что одновременное и разнонаправленное действие этиологических и патогенетических факторов при септическом шоке приводит к нарушению распределения кровотока и органной перфузии даже на фоне нормального АД и высокого СВ. На первый план при шоке выступают именно нарушения микроциркуляции, а артериальная гипотензия является поздним симптомом септического шока.
Выделяют два основных синдрома расстройств кровообращения, которые характеризуют стадии развития септического шока, — гипердинамический и гиподинамический. Для ранней стадии септического шока, сопровождающейся циркуляторной гипердинамией, как правило, характерно снижение общего сосудистого сопротивления с рефлекторно обусловленным (с барорецепторов) увеличением СВ и работы сердца. Это, возможно, связано с прямым влиянием быстро накапливающейся бактериальной флоры и эндотоксинов на сердечно-сосудистую систему и клеточный метаболизм. Причинами снижения периферической сосудистой резистентности являются открытие низкорезистентных артериовенозных шунтов и непосредственный сброс крови через них. При этом значительно увеличиваются потребление кислорода и индекс его доставки, в то время как экстракция кислорода находится в пределах нормы. Дальнейшая манифестация септического шока также характеризуется значительными изменениями в симпатико-адреналовой, гипофизарно-надпочечниковой, калликреин-кининовой и других системах регуляции гомеостаза. Для следующей стадии септического шока характерны гипердинамический режим кровообращения и нарушения транспорта кислорода. В этой стадии шока сохраняется повышенная производительность сердца: существенно увеличена работа левого желудочка, однако СИ лишь незначительно превышает норму. В результате преобладания активности норадреналина, альфа-адреномиметическое действие которого способствует вазоконстрикции, повышается общее периферическое сосудистое сопротивление. Неизбежным следствием этого является развивающаяся тканевая гипоксия. Снижаются потребление кислорода и индекс его доставки тканям, существенно увеличивается экстракция кислорода. Развивается блокада утилизации кислорода на субклеточном уровне с накоплением лактата.
В поздних стадиях развития септического шока, несмотря на продолжительную вазоконстрикцию и перераспределение крови на периферии, наблюдается снижение преднагрузки, объясняемое опустошением капиллярного функционирующего русла и, главное, жидкостной экстравазацией. Этим и определяется развитие вторичного гиповолемического синдрома. Вместе с миокардиодепрессией гиповолемия формирует гиподинамический синдром. Стадия гиподинамического режима кровообращения характеризуется низкими показателями СВ, доставки и потребления кислорода на фоне повышенной экстракции последнего. Экстракция кислорода резко падает в терминальной стадии шока. Значительное повышение экстракции кислорода на фоне сниженной его доставки и потребления обусловлено не только перфузионной недостаточностью и гипоксемией, но и значительным нарушением клеточного метаболизма и утилизации кислорода [Gutierrez G., 1991]. Компенсаторная вазоконстрикция с повышением общего сосудистого сопротивления может наблюдаться также и в гиподинамической фазе септического шока. Значительное повышение легочного сосудистого сопротивления и легочная гипертензия становятся дополнительными факторами прогрессирования миокардиальной недостаточности.
Установлено, что детерминирующим фактором в специфике нарушений гемодинамики при септическом шоке являются не особенности микрофлоры, а системная реакция организма больного, в которой большую роль играет повреждение иммунной системы [Shapiro L. et al., 1993]. Гипер- и гиподинамические синдромы как при грамположительной, так и при грамотрицательной бактериемии наблюдаются практически с одинаковой частотой.
Следует подчеркнуть, что при септическом шоке раньше всего повреждается главный орган-мишень — легкие. Основная причина дисфункции легких обусловлена повреждением эндотелия медиаторами и факторами воспаления, что увеличивает проницаемость кровеносных сосудов, приводит к их микроэмболизации и капиллярной дилатации [Shapiro L. et al., 1993]. Изменения проницаемости клеточной мембраны могут вести к трансмембранному потоку низкомолекулярных веществ и макроионов, что сопровождается нарушением функции клеток. Таким образом развивается интерстициальный отек легких.
Как только возникает повреждение эндотелия, в органах и тканях, являющихся мишенью, увеличивается вероятность развития полиорганной недостаточности. За дисфункцией легких могут последовать сначала печеночная, затем почечная недостаточность, что и формирует синдром полиорганной недостаточности (СПОН) [Gates D.M., 1994]. По мере развития СПОН каждый из органов оказывается не в состоянии адекватно функционировать, что приводит к появлению новых факторов повреждающего воздействия на другие органы и системы организма.
В патогенезе септического шока важнейшим звеном являются расстройства микроциркуляции. Они обусловлены не только вазоконстрикцией, но и значительным ухудшением агрегатного состояния крови с нарушением ее реологических свойств и развитием синдрома диссеминированного внутрисосудистого свертывания (ДВС) крови или тромбогеморрагического синдрома. Септический шок приводит к расстройствам всех метаболических систем. Нарушаются углеводный, белковый и жировой обмен, резко угнетается утилизация нормальных источников энергии — глюкозы и жирных кислот. При этом возникает резко выраженный катаболизм мышечного белка. В целом обмен веществ сдвигается на анаэробный путь.
Таким образом, в основе патогенеза септического шока лежат глубокие и прогрессирующие расстройства гуморальной регуляции, метаболизма, гемодинамики и транспорта кислорода. Взаимосвязь этих нарушений может привести к формированию порочного круга с полным истощением адаптационных возможностей организма. Предотвращение развития этого порочного круга и является основной задачей интенсивной терапии больных с септическим шоком.
Клиническая картина. Изменения функций жизненно важных органов под влиянием повреждающих факторов септического шока формируют динамический патологический процесс, клинические признаки которого выявляются в виде нарушений функцийЦНС, легочного газообмена, периферического и центрального кровообращения, а в последующем и в виде органных повреждений.
Прорыв инфекта из очага воспаления или поступление эндотоксина в кровоток запускают первичный механизм септического шока, в котором проявляется пирогенное действие инфекта и прежде всего эндотоксина. Гипертермия выше 38—39 °С, потрясающий озноб являются ключевыми признаками в диагностике септического шока. Очень часто постепенно прогрессирующую лихорадку гектического или неправильного типа, достигающую предельных величин и нехарактерную для данного возраста (40—41 °С у пожилых больных), а также полипноэ и умеренные нарушения кровообращения, главным образом тахикардию (ЧСС более 90 в минуту), считают реакцией на травму и операцию. Иногда такие симптомы служат основанием для диагноза местной инфекции. Однако эта фаза септического шока носит название «теплой нормотензии» и часто не диагностируется. При исследовании центральной гемодинамики определяется гипердинамический режим кровообращения (СИ более 5 л/мин/м2) без нарушения транспорта кислорода (РТК 800 мл/мин/м2 и более), что характерно для ранней стадии септического шока.
При прогрессировании процесса данную клиническую фазу септического шока сменяет фаза «теплой гипотензии», для которой характерны максимальное повышение температуры тела, ознобы, изменения психического состояния больного (возбуждение, беспокойство, неадекватность поведения, иногда психоз). При осмотре больного кожа теплая, сухая, гиперемированная или розовая. Нарушения дыхания выражены по типу гипервентиляции, которая в дальнейшем приводит к дыхательному алкалозу и утомлению дыхательной мускулатуры. Отмечается тахикардия до 120 ударов и более в минуту, которая сочетается с хорошим наполнением пульса и гипотензией (Адсист < 100 мм рт.ст.). Гипотензия скорее умеренная и обычно не привлекает внимание врачей. Уже в этой стадии септического шока выявляются признаки неспособности системы кровообращения обеспечить потребность тканей в кислороде и питательных веществах, а также создать возможность детоксикации и удаления токсичных метаболитов. Для того чтобы поддержать адекватность перфузии тканей и избежать анаэробного окисления, больным необходим более высокий уровень DO2 (15 мл/мин/кг вместо 8—10 мл/мин/кг в норме). Однако в этой стадии септического шока даже повышенный СВ (СИ 4,3—4,6 л/мин/м2) не обеспечивает должной потребности в кислороде.
Нередко гемодинамические и дыхательные изменения сочетаются с отчетливыми нарушениями деятельности пищеварительного тракта: диспепсические расстройства, боли (особенно в верхней части живот), понос, которые можно объяснить особенностями метаболизма серотонина, начальными изменениями кровотока в зоне чревных сосудов и активацией центральных механизмов тошноты и рвоты. В этой фазе септического шока отмечается снижение диуреза, иногда достигающее уровня олигурии (мочеотделение менее 25 мл/ч).
Клиническая картина поздней стадии септического шока характеризуется нарушениями сознания, выраженными расстройствами легочного газообмена, периферической и центральной циркуляторной недостаточностью, органной патологией с признаками печеночной и почечной недостаточности. Внешние проявления этой стадии септического шока получили название «холодной гипотензии». При осмотре больного обращают на себя внимание затемнение сознания, вплоть до развития коматозного состояния; бледность кожных покровов; акроцианоз, иногда значительный; олигоанурия. Выраженное тахипноэ (более 40 дыханий в 1 мин) сочетается с ощущением нехватки воздуха, которое не уменьшается даже на фоне оксигенотерапии; вдыхании, как правило, участвуют вспомогательные мышцы.
Озноб и гипертермия сменяются снижением температуры тела, нередко с ее критическим падением до субнормальных цифр. Кожная температура дистальных отделов конечностей даже на ощупь значительно ниже обычной. Снижение температуры тела сочетается с отчетливой вегетативной реакцией в виде проливных потов. Холодные, бледно-цианотичные, влажные кисти и стопы — это один из патогномоничных симптомов неблагоприятного течения генерализованной инфекции. Одновременно выявляются относительные признаки уменьшения венозного возврата в виде запустевания периферической венозной подкожной сети. Частый, 130—160 в минуту, слабого наполнения, иногда аритмичный, пульс сочетается с критическим снижением системного АД, нередко с малой пульсовой амплитудой.
Наиболее ранним и четким признаком органного поражения является прогрессирующее нарушение функций почек с такими тяжелыми симптомами, как азотемия и нарастающая олигоанурия (диурез менее 10 мл/ч).
Поражения желудочно-кишечного тракта проявляются в виде динамической кишечной непроходимости и желудочно-кишечных кровотечений, которые в клинической картине септического шока могут превалировать даже в тех случаях, когда он не перитонеального генеза. Поражение печени характеризуется появлением желтухи и гипербилирубинемией.
Принято считать, что снабжение организма кислородом бывает достаточно адекватным при концентрации гемоглобина >100 г/л, SаO2 > 90 % и СИ>2,2 л/мин/м2. Тем не менее у больных с выраженным перераспределением периферического кровотока и периферическим шунтированием кислородное снабжение даже при этих показателях может быть неадекватным, в результате чего развивается гипоксия с высоким кислородным долгом, что характерно для гиподинамической стадии септического шока. Высокое потребление тканями кислорода в сочетании с низким транспортом последнего свидетельствует о возможности неблагоприятного исхода, тогда как повышенное потребление кислорода в сочетании с повышением его транспорта является признаком, благоприятным практически для всех вариантов шока.
Большинство клиницистов считают, что основными объективными диагностическими критериями сепсиса являются изменения периферической крови и метаболические расстройства.
Наиболее характерные изменения крови: лейкоцитоз (12 x 109/л) с нейтрофильным сдвигом, резкое «омоложение» лейкоцитарной формулы и токсическая зернистость лейкоцитов. В то же время следует помнить о неспецифичности нарушений отдельных показателей периферической крови, их зависимости от циркуляторного гомеостаза, постоянно меняющейся клинической картины заболевания и влияния лечебных факторов. Принято считать, что для септического шока характерными объективными критериями могут быть лейкоцитоз с нарастанием лейкоцитарного индекса интоксикации (ЛИИ>10) и тромбоцитопения. Иногда динамика лейкоцитарной реакции имеет волнообразный характер: начальный лейкоцитоз сменяется лейкопенией, совпадающей по времени с психическими и диспепсическими расстройствами, появлением полипноэ, а затем вновь наблюдается быстрое нарастание лейкоцитоза. Но даже и в этих случаях величина ЛИИ прогрессивно увеличивается. Этот показатель рассчитывают по формуле [Кальф-Калиф Я.Я., 1943]:
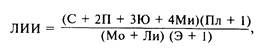
где С — сегментоядерные нейтрофилы, П — палочкоядерные, Ю — юные, Ми — миелоциты, Пл — плазматические клетки, Мо — моноциты. Ли — лимфоциты, Э —эозинофилы.
Нормальная величина индекса колеблется около 1. Повышение ЛИИ до 4—9 свидетельствует о значительном бактериальном компоненте эндогенной интоксикации, тогда как умеренное повышение индекса до 2—3 указывает на ограничение инфекционного процесса или преимущественный тканевый распад. Лейкопения с высоким ЛИИ является всегда тревожным симптомом септического шока.
В поздней стадии септического шока при гематологических исследованиях, как правило, выявляются умеренная анемия (Нb 90—100 г/л), гиперлейкоцитоз до 40x109/л и выше с предельным возрастанием ЛИИ до 20 и более. Иногда увеличивается количество эозинофилов, что уменьшает ЛИИ, несмотря на отчетливый сдвиг лейкоцитарной формулы в сторону незрелых форм нейтрофилов. Может наблюдаться лейкопения с отсутствием нейтрофильного сдвига. При оценке лейкоцитарной реакции необходимо обращать внимание на снижение абсолютной концентрации лимфоцитов, которое может быть в 10 раз и более ниже нормальной величины.
Среди данных стандартного лабораторного контроля заслуживают внимание показатели, характеризующие состояние метаболического гомеостаза. Наиболее распространена диагностика метаболических расстройств на основании контроля сдвигов КОС, газов крови и оценки концентрации лактата в крови. Как правило, характер и форма расстройств КОС, а также уровень лактата зависят от тяжести и стадии развития шока. Достаточно выражена корреляция между концентрациями лактата и эндотоксина в крови, особенно при септическом шоке.
При исследовании КОС крови на ранних стадиях септического шока нередко определяется компенсированный или субкомпенсированный метаболический ацидоз на фоне гипокапнии и высокого уровня лактата, концентрация которого достигает 1,5—2 ммоль/л и более. В ранней стадии септицемии наиболее характерен временный респираторный алкалоз. У некоторых больных отмечается метаболический алкалоз. В поздних стадиях развития септического шока метаболический ацидоз становится некомпенсированным и по дефициту оснований нередко превышает 10 ммоль/л. Уровень лактат-ацидемии достигает 3—4 ммоль/л и более и является критерием обратимости септического шока. Как правило, определяется существенное снижение РаО2, SaO2 и, следовательно, уменьшение кислородной емкости крови. Следует подчеркнуть, что выраженность ацидоза в значительной степени коррелирует с прогнозом.
В диагностике и лечении септического шока становится все более и более необходимым динамическое определение показателей центральной гемодинамики (МОС, УО, СИ, ОПСС и др.) и транспорта кислорода (a-V — разница по кислороду, СаО2, РаО2, SaО2), которые позволяют оценить и определить стадию шока и компенсаторные резервы организма. СИ в сочетании с другими факторами, характеризующими особенности транспорта кислорода в организме и тканевый обмен служат критериями не только эффективности кислородного обеспечения, но и ориентировки в прогнозе септического шока и выборе основного направления интенсивной терапии расстройств кровообращения при внешне одинаковых проявлениях этого патологического процесса — гипотензии и низком темпе диуреза.
Кроме функционального исследования, диагностика включает выявление этиологического фактора — определение возбудителя и изучение его чувствительности к антибактериальным препаратам. Проводят бактериологическое исследование крови, мочи, раневого экссудата и т.д. С помощью биологических тестов исследуют выраженность эндотоксинемии. В клиниках проводится диагностика иммунной недостаточности на основании общих тестов: Т- и В-лимфоциты, бласттрансформация, уровень иммуноглобулинов в сыворотке крови.
Диагностические критерии септического шока:
• наличие гипертермии (температура тела >38—39 °С) и ознобов. У пациентов пожилого возраста парадоксальная гипотермия (температура тела <36 °С);
• нейропсихические расстройства (дезориентация, эйфория, возбуждение, сопор);
• гипер- или гиподинамический синдром нарушения кровообращения. Клинические проявления: тахикардия (ЧСС =100—120 в минуту), Адсист< 90 мм рт.ст. или его снижение на 40 мм рт.ст. и более от среднего в отсутствие других причин гипотензии;
• расстройства микроциркуляции (холодные, бледные, иногда слегка или интенсивно желтушные кожные покровы);
• тахипноэ и гипоксемия (ЧСС>20 в минуту или PaCO2<32 мм рт.ст., акроцианоз);
• олигоанурия, мочеотделение — менее 30 мл/ч (или необходимость применения диуретиков для поддержания достаточного диуреза);
• рвота, понос;
• число лейкоцитов >12,0•109/л, 4,0•109/л или незрелые формы >10 %, ЛИИ >9-10;
• уровень лактата >2 ммоль/л.
Некоторые клиницисты выделяют триаду симптомов, которая служит продромой септического шока:нарушение сознания
Дата добавления: 2016-06-22; просмотров: 1905;











