Обмін вуглеводів в організмі.
РОЗЩЕПЛЕННЯ ВУГЛЕВОДІВ У ТРАВНОМУ ТРАКТІ ЛЮДИНИ. Основним джерелом енергії в організмі людини є засвоювані вуглеводи. У добу людина споживає 450…800 г вуглеводів. З них 35 % становлять моносахариди і дисахариди, 65 % – полісахариди. Останні представлені переважно крохмалем. Кількість глікогену в їжі невелика: 4…15 г/добу. Основними джерелами вуглеводів їжі є продукти рослинного походження: хліб, крупи, овочі, плоди, фрукти і ягоди.
Всі вуглеводи, крім клітковини і пектинових речовин, піддаються в шлунково-кишковому тракті гідролітичному розщепленню ферментами. Ферменти, які каталізують гідроліз крохмалю і дисахаридів, мають оптимум дії при слаболужній реакції і неактивні в кислому середовищі. Виключення – амілаза слини, що проявляє максимальну активність при рН 6,8.
Крохмаль і глікоген починають переварюватися в ротовій порожнині під дією α-амілази слини, при цьому утворюються "уламки" молекул – декстрини і невелика кількість мальтози, що розщеплює до глюкози мальтаза слини.
Декстрини мають редукуючі властивості, причому вони збільшуються в міру зменшення молекулярної маси, їхнє фарбування під дією йоду змінюється. Розрізняють амілодекстрини, які забарвлюються йодом у фіолетово-блакитний колір; еритродекстрини, що дають із йодом червоно-коричневе забарвлення; ахродекстрини і мальтодекстрини в реакції з йодом забарвлення не дають.
У шлунку відсутні ферменти, які каталізують гідроліз вуглеводів, що припиняється в кислому середовищі. Подальше розщеплення крохмалю й декстринів відбувається у дванадцятипалій кишці під впливом ферментів соку підшлункової залози: α-амілази, мальтази, лактази, сахарази. Кінцевий розпад полісахаридів до моносахаридів (глюкози) відбувається в тощій і підвздошній кишках.
Гідроліз дисахаридів протікає не в самому просвіті тонкої кишки, а на мембрані клітин її слизової оболонки під дією відповідних ферментів, локалізованих у щітковій облямівці епітелію. При цьому мальтоза розщеплюється на дві молекули глюкози, сахароза – на глюкозу і фруктозу, лактоза – на глюкозу і галактозу.
Особливий інтерес представляє розщеплення клітковини (целюлози). У травних соках людини відсутній фермент целюлаза. У невеликій кількості целюлоза розщеплюється в товстому кишечнику під впливом ферментів мікрофлори. Ферменти мікроорганізмів – целюлаза і целобіаза здійснюють гідроліз клітковини до глюкози, що піддається різним видам бродіння з утворенням Н2, СО2, СН4, спиртів і органічних кислот (оцтової, масляної та ін.). Частина цих продуктів всмоктується стінкою кишечнику й використовується як енергетичний матеріал, а частина витрачається як поживне середовище для мікроорганізмів і для біосинтезу ними деяких вітамінів (наприклад, К, В12, фолієвої кислоти).
Ступінь розщеплення клітковини ферментами мікроорганізмів у значній мірі залежить від зрілості плодів. Клітковина недоспілих і зрілих плодів, овочів і фруктів переварюється краще, ніж переспілих. Поживна цінність продуктів бродіння для людини дуже незначна і не враховується при розрахунках раціону. Однак клітковина є незамінним подразником секреторної і моторної функцій кишечнику.
Надлишок клітковини підсилює перистальтику кишечнику людини, що прискорює просування їжі через шлунково-кишковий тракт. Це призводить до недостатнього переварювання й усмоктування їжі, у зв'язку із чим у кал попадає багато невикористаних організмом поживних речовин. Втрати їх збільшуються ще й тому, що клітковина затримує доступ ферментів до засвоюваних вуглеводів й, отже, ускладнює переварювання їжі.
Попередня кулінарна обробка продуктів харчування й ретельне пережовування сприяють руйнуванню клітковини. При великій її кількості підсилюються процеси бродіння в кишечнику, що приводить до виникнення метеоризму. Він викликає неприємні відчуття й ряд ускладнень при захворю-ваннях кишечнику, а особливо у людей, ведучих малорухомий спосіб життя. Основна маса целюлози в незмінному виді виводиться з організму з калом.
Всмоктування вуглеводів у тонкій кишці являє собою складний біохімічний процес. Прості цукри всмоктуються шляхом трансмембранного транспорту за допомогою білків. На зовнішній поверхні мембран клітин тонкої кишки вони з'єднуються з певним вуглеводом (глюкозою або галактозою), утворюючи рухливий комплекс "переносник – вуглевод". У вигляді такого комплексу вуглевод переноситься через мембрану усередину клітини. Тут комплекс розпадається, вуглевод використовується або транспортується далі кров'ю, а білок повертається й повторно вступає в реакцію транспорту. Важлива роль у цьому належить іонам Na+, тобто цей процес є Na+-залежним. Процес відбувається з витратою енергії АТФ, його каталізує фермент гексокіназа. При цьому підсилюються окисні реакції в стінці кишечнику, що забезпечують ресинтез АТФ, яка витрачається на всмоктування моносахарів.
Всмоктування різних моносахаридів у кров з кишечнику здійснюється з різною швидкістю. Якщо швидкість всмоктування глюкози прийняти за 100 %, то всмоктування галактози буде становити 110, фруктози – 43, маннози – 19, ксилози – 15, арабінози – 9.
Моносахариди, що всмокталися, через воротну вену надходять у печінку, де піддаються різного роду перетворенням, зокрема, там відбувається взаємне перетворення мономерів: з галактози й фруктози при участі ферментів ізомераз утворюється глюкоза.
У печінці під дією ферменту фосфорилази синтезується й накопичується глікоген. При необхідності відбувається його мобілізація й розщеплення до вільної глюкози. В організмі людини запас глікогену становить 350 г, причому 250 г міститься в м'язах.
У печінці протікає й реакція глюконеогенеза: глюкоза утворюється з невуглеводів (молочної кислоти, гліцерину, амінокислот). З печінки глюкоза доставляється до різних органів, де використовується клітинами в міру необхідності. У нирках здорової людини глюкоза повністю реабсорбується і надходить у кров.
ОБМІН ВУГЛЕВОДІВ. У клітинах тканин гетеротрофних організмів вуглеводи синтезуються із глюкози і сполук невуглеводної природи. Надлишок глюкози в крові використовується для біосинтезу глікогену в печінці й м'язах. Глікоген накопичується у вигляді гранул, у яких містяться також ферменти його синтезу, розпаду і регуляції цих процесів.
Біосинтез глікогену відбувається в аеробних умовах. На початку цього процесу глюкоза фосфорилюється під впливом гексокінази (глюкокінази) з використанням АТФ з утворенням глюкозо-6-фосфату:
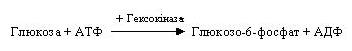
Потім глюкозо-6-фосфат при участі фосфоглюкомутази ізомеризується в глюкозо-1-фосфат:
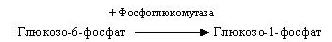
Глюкозо-1-фосфат вступає в реакцію з УТФ (урідинтрифосфатом) і утворює УДФ-глюкозу, що представляє собою активовану форму глюкози. Ця реакція каталізується глюкозо-1-фосфат-уридиліл-трансферазою (УДФГ-пірофосфорилазою).
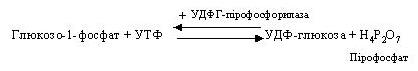
Пірофосфат піддається гідролізу, і енергія, що вивільняється, «запускає» синтез УДФ-глюкози.
На наступному етапі активований глікозидний компонент УДФ-глюкози переноситься на гідроксильну групу С-4 кінцевого залишку глюкози ланцюга, утворюючи 1,4-глікозидний зв'язок. Для синтезу глікогену необхідна наявність невеликої, «затравочної» його кількості, що містить не менш чотирьох залишків глюкози. При цьому відбувається перенос залишку глюкози з УДФ-глюкози на глікоген і подовження його ланцюга шляхом утворення зв'язку 1,4:
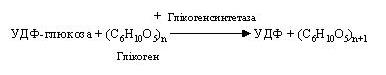
Регенерація УТФ здійснюється за рахунок АТФ:
АТФ + УДФ → АДФ + УТФ.
Розпад глікогену й вивільнення глюкози відбуваються при зростаючій потребі в ній. Цей процес здійснюється двома шляхами: фосфорилітичним і гідролітичним, які доповнюють один одного. У депо, де накопичується глікоген (печінка, м'язи, інші органи й тканини), він розпадається фосфорилітичним шляхом, у шлунково-кишковому тракті – гідролітичним.
Фосфороліз глікогену здійснюється шляхом послідовного відщіплення глюкозо-1-фосфата при участі ферменту фосфорілази:

Причому фосфорилаза каталізує відщіплення глюкозильних залишків до точки розгалуження ланцюга глікогену, потім вступає в дію декстраназа, що розриває 1-6-зв'язок глікогену й забезпечує подальшу дію фосфорилази. Фосфорилаза існує у двох формах: неактивній (b) і активній(а). Перетворення фосфорилази b у фосфорилазу а відбувається за участю АТФ, ферменту кінази, фосфорилази й ц-АМФ як коферменту. Причому із двох молекул неактивної фосфорилази виходить одна активна. Цей процес стимулюється гормонами адреналіном і глюкагоном, які сприяють утворенню ц-АМФ. Швидкість фосфорилазної реакції залежить від концентрації глікогену, фосфорної кислоти і глюкозо-6-фосфата. При зменшенні концентрації глікогену і фосфорної кислоти швидкість цього процесу знижується.
Глюкозо-1-фосфат, що виділився, перетворюється в глюкозо-6-фосфат під дією ферменту фосфоглюкомутази.
Глюкозо-6-фосфат включається в процеси гліколізу або перетворюється у вільну глюкозу, яка з «депо» надходить у кров і використовується тканинами як енергетичний матеріал.
Таким чином, постійна концентрація глюкози в крові є результатом одночасного протікання двох процесів: надходження глюкози в кров з печінки й споживання її із крові тканинами.
У тканинах органів (у тому числі печінки) розпад глюкози відбувається двома шляхами: анаеробним (при недостатньому вмісті оксигену в клітинах) і аеробним (протікає лише в присутності оксигену).
Анаеробне окиснювання субстратів – найпростіша форма утворення й акумулювання енергії у фосфатних зв'язках АТФ; в еволюційному шляху розвитку воно є більше раннім і виникло ще в безкисневому середовищі.
Вищі тварини і людина відносяться до факультативних анаеробних, тобто організмів, які можуть функціонувати в аеробних і анаеробних умовах. Однак етапу аеробного розщеплення, незалежно від присутності кисню, передує анаеробний розпад.
При анаеробному розпаді вуглеводів головним енергетичним субстратом є глюкоза. Її анаеробне перетворення може здійснюватися різними способами: гліколіз або глікогеноліз (якщо процес починається із глікогену) або спиртове бродіння з утворенням відповідно молочної кислоти або етанолу і СО2. Аеробному розщепленню піддаються, як правило, продукти анаеробного розпаду (наприклад молочна і піровиноградна кислоти).
Гліколіз (від греч. glycys – солодкий, lysіs – розкладання, розчинення) є складним ферментативним процесом, що протікає, в основному, в м'язовій тканині. Він супроводжується вивільненням енергії, що частково акумулюється в макроергічних зв'язках АТФ, а частково диспергується у вигляді теплоти. Значна частина енергії зберігається в кінцевих продуктах гліколізу і спиртового бродіння – у лактаті (молочна кислота) і етанолі.
Анаеробне розщеплення глюкози протікає у дві стадії. На першій стадії глюкоза при дії глюкокінази (гексокінази) фосфорилюється, використовуючи АТФ як донора фосфатної групи.
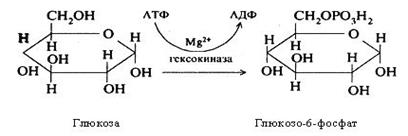
Процес первинного фосфорилювання глюкози з утворенням фосфорного ефіру називається «шлюзовою» реакцією, або реакцією «запала», після якої цей моносахарид включається в інші реакції.
Глюкозо-6-фосфат, що утворюється при цьому, перетворюється потім під дією ферменту фосфоглюкомутази у фруктозо-6-фосфат.
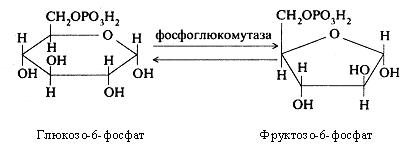
Надалі при участі фосфофруктокінази й АТФ відбувається фосфорилювання фруктозо-6-фосфата з утворенням фруктозо-1,6-дифосфата.
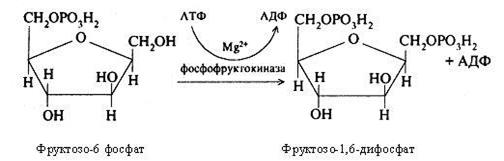
Фруктозо-1,6-дифосфат є типовим продуктом гліколізу. Під дією ферменту альдолази відбувається його розщеплення на дві тріози: фосфодиоксиацетон і фосфогліцероловий альдегід. Такий розподіл називається дихотомією, а гліколіз – дихотомічним циклом обміну вуглеводів.
Під дією ферменту тріозофосфатізомерази можливо взаємне перетворення тріоз. При співвідношенні 5 % фосфогліцеролового альдегіду й 95 % фосфодиоксиацетону встановлюється рухлива рівновага.
Фосфодиоксиацетон перетворюється в гліцеральдегід-3-фосфат і всі наступні реакції йдуть із двома молекулами фосфогліцеролового альдегіду. Крім того, він відновлюється в гліцеральдегід-3-фосфат, що використається для синтезу різних ліпідів. Таким чином, він є сполучною ланкою між гліколізом й обміном ліпідів.
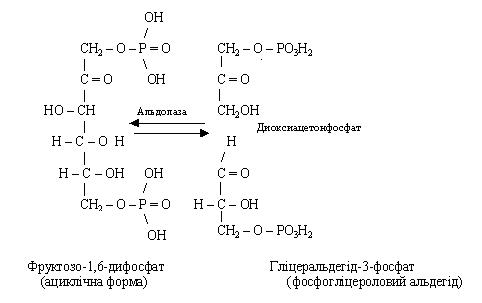
Утворенням гліцеральдегід-3-фосфату завершується перший, підготовчий етап гліколізу.
Друга стадія, що має важливе значення – найбільш складна. Вона включає окиснювально-відновну реакцію (гліколітичная оксидоредукція), спо-лучену із субстратним фосфорилюванням, у процесі якого утворюється АТФ.
При взаємодії гліцеральдегід-3-фосфату з особливим ферментом – HSE, у білковій частині якого міститься сульфгідрильна група (SH), утвориться проміжний фермент-субстратний комплекс:
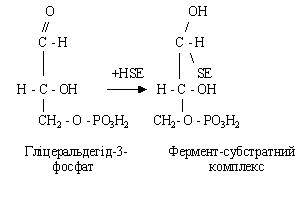
Потім відбувається його дегідрування за участю НАД, при цьому з'являються відновлена форма НАДН2 і проміжний макроергічний комплекс.
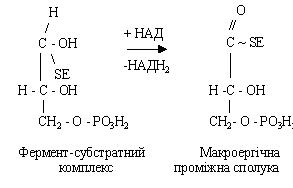
При взаємодії його з неорганічною фосфорною кислотою утворюється 1,3-дифосфогліцеролова кислота.
Після цього макроергічна сполука взаємодіє з АДФ, утворюються АТФ і 3-фосфогліцерат.
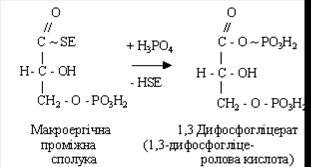
У цій реакції відбувається перетворення альдегідної групи глицеральдегид-3-фосфата в карбоксильну з виділенням енергії, що запасається в АТФ. Утворення АТФ із високо енергетичних сполук називається субстратним фосфорилюванням.
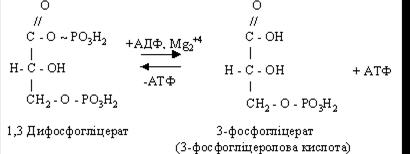
Під дією ферменту фосфогліцератфосфомутази (фосфогліцеромутази) 3-фосфогліцеролова кислота перетворюється в 2-фосфогліцеролову кислоту, що потім під впливом ферменту енолази дегідрується й переходить в енольну форму 2-фосфопіровиноградної кислоти.
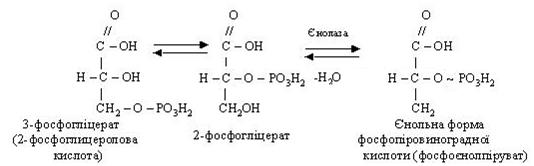
Остання взаємодіє з АДФ, при цьому утворюються АТФ і піровиноградна кислота (ПВК):
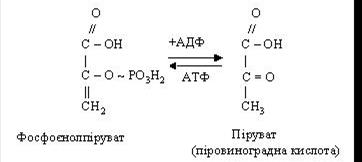
Якщо до моменту утворення пірувата в тканині не надійде достатня кількість оксигену, то ПВК відновлюється до лактату (молочна кислота) при участі відновленого НАД (НАДН2).
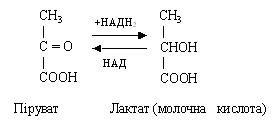
В анаеробних умовах 85 % лактату відновлюється до глікогену, а 15 % окиснюється до СО2 і Н2О. Таким чином, лактат є кінцевим продуктом анаеробного окиснювання глюкози. В аеробних умовах лактат знову перетворюється в піруват або використовується для біосинтезу глюкози в печінці. Цей процес протікає в цитоплазмі, де локалізовані всі ферменти гліколізу.
При активній роботі м'язів в них накопичується багато молочної кислоти, що викликає їхнє стомлення.
Щоб відновити працездатність м'язів, необхідно звільнити їх від молочної кислоти, що досягається виведенням її в кров, з якої вона надходить у печінку. Так, в аеробних умовах, молочна кислота в процесі глюконеогенеза перетворюється в глюкозу, що знову із кров'ю надходить у м'язи й включається в обмінні процеси.
Біологічне значення процесу гліколізу полягає насамперед в утворенні багатих енергією фосфорних сполук. На перших етапах гліколізу витрачаються дві молекули АТФ (гексозна і фосфофруктокіназна реакції). На наступних етапах утворюються чотири молекули АТФ (фосфогліцераткіназна і піруваткіназна реакції). Крім того, утворюється дві молекули НАДН2, кожна з яких при біологічному окиснюванні на мітохондріях виділяє три молекули АТФ. Таким чином, у результаті гліколізу утворються вісім молекул АТФ із однієї молекули глюкози.
З енергетичної точки зору гліколіз неефективний, тому що для виробництва енергії використовується велика кількість вуглеводів. Разом з тим фізіологічне значення цього процесу надзвичайно велике, оскільки він дозволяє організму виконувати свої функції в умовах недостатнього постачання киснем, а кінцеві продукти гліколізу (піруват і лактат) є субстратами аеробного окиснювання.
Значення гліколізу визначається також і тим, що в ході відповідних реакцій утворюються речовини, які необхідні для біосинтезу деяких життєво важливих сполук. Так, наприклад, фосфодиоксиацетон використовується для біосинтезу простих і складних ліпідів.
Таким чином, саме гліколіз готовить "напівфабрикати", які надалі окиснюються до СО2 і Н2О в аеробних умовах.
Луї Пастер, вивчаючи взаємозв'язок між анаеробним та аеробним окиснюванням, звернув увагу на гальмування гліколізу в процесі дихання. Це явище одержало назву «пастеровського ефекту». Гальмування відбувається на стадії перетворення фруктозо-6-фосфата у фруктозо-1,6-дифосфат. Значення ефекту Пастера, тобто переходу в присутності оксигену від анаеробного гліколізу до дихання, складається в перемиканні клітини на більш ощадливий шлях одержання енергії.
Однією із причин пригнічення гліколізу диханням є конкуренція за неорганічний фосфат й АДФ. У деяких клітинах, наприклад ракових, більш інтенсивно протікає гліколіз. При рості злоякісних пухлин має місце зворотний пастеровському ефект Кребтри – гальмування дихання гліколізом.
Аеробне окиснювання вуглеводів. Клітини, які недостатньо постачаються оксигеном, можуть частково або повністю існувати за рахунок енергії гліколізу.
В аеробних умовах перетворення лактату, що утворився із глюкози в процесі гліколізу, іде у двох напрямках: приблизно 1/5 лактату окиснюється до СО2 і Н2О, інша кількість перетворюється в глікоген.
Перший етап аеробного розпаду лактату – його окиснювання до пірувату за участю лактатдегідрогенази.
Однак переважна більшість тваринних і рослинних клітин у нормі перебуває в аеробних умовах, і піруват, що утворюється при розщепленні глюкози, не відновлюється до лактату, а поступово окиснюється до СО2, і Н2О в аеробної стадії катаболізму. При цьому спочатку відбувається окисне декарбоксилювання пірувату з утворенням ацетил-КоА.
Окисне декарбоксилювання протікає на мітохондріях. Воно каталізується складними поліферментними і полікоферментними системами, які складаються з декількох ферментів (власне дегідрогенази й ін.) і декількох коферментів, у тому числі тіамінпірофосфату (ТПФ), тіаміндифосфату (ТДФ), ліпоєвої кислоти (ЛК), НАД, HSKoА, ФАД, Mg2+. Кожен компонент ферментної системи бере участь у здійсненні відповідної ланки процесу. Реакції відбуваються в кілька етапів.
Цикл трикарбонових кислот (цикл Кребса) У ході аеробного окиснювання вуглеводів піровиноградна кислота піддається окисному декарбоксилюванню з утворенням ацетил-КоА.
Ацетил-КоА, що утворився, вступає в різні реакції обміну й окиснюється до СО2 і Н2О. Повне окиснювання ацетил-КоА відбувається в циклі трикарбонових кислот – циклі Кребса.
70 % ПВК окиснюється до СО2 і Н2О через стадію утворення ацетил-КоА. При обміні білків, жирів і вуглеводів протягом доби на кожен 1 кг маси тіла утворюється близько 10 г ацетату.
Цикл Кребса є центром, де сходяться всі метаболічні шляхи, він – загальний кінцевий шлях окиснювання ацетильних груп (у вигляді ацетил-КоА), у які перетворюється в процесі катаболізму більша частина органічних молекул, що грають роль "клітинного палива" – вуглеводів, жирних кислот, амінокислот.
Він протікає в матриксі мітохондрій і складається з восьми послідовних реакцій.
Перша реакція каталізується цитрат-синтетазою, при цьому ацетил-КоА конденсується із щавелевооцтовою кислотою (оксалоацетатом), у результаті чого утворюється лимонна кислота (цитрат).
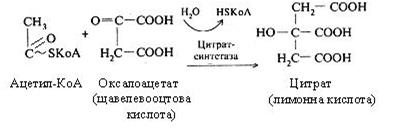
У другій реакції лимонна кислота піддається дегідрагуванню з утворенням цисаконітової кислоти, що, приєднуючи молекулу води, переходить в ізолимонну кислоту (ізоцитрат).
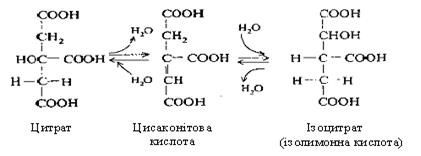
Третя реакція – ізолимонна кислота окиснюється шляхом відщіплення двох атомів гідрогену й перетворюється в щавелевобурштинову кислоту, що декарбоксилюється до α-кетоглутарової кислоти (α-кетаглутарат).
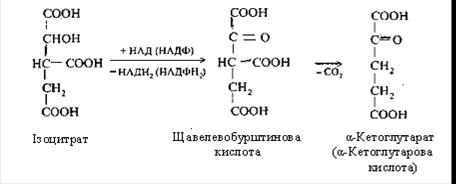
Четверта реакція: α-кетоглутарова кислота піддається окисному декарбоксилюванню під впливом складних ферментів До складу цих ферментів входять коферменти: (ТПФ, HSKoА, ліпоєва кислота, НАД, ФАД). Для реакції необхідні також іони Mg2+. У результаті окисного декарбоксилювання α-кетоглутарової кислоти утворюється сукциніл-КоА, що має макроергічний карбоксилтіоловий зв'язок, у якому резервується енергія окисного декарбоксилювання. При цьому виділяється друга молекула СО2 і НАДН2.
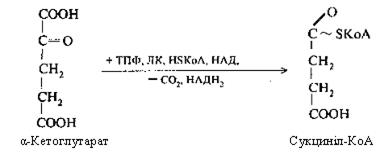
У ході п'ятої реакції сукциніл-КоА взаємодіє з неорганічним фосфатом, потім реагує з гуанідилдифосфатом (ГДФ) і перетворюється в бурштинову кислоту, а ГДФ, приєднуючи фосфат, переходить у ГТФ.
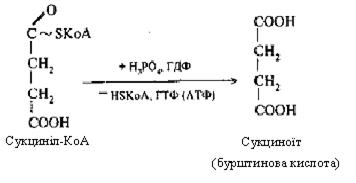
У результаті шостої реакції бурштинова кислота при участі ФАД окиснюється у фумарову кислоту (фумарат). Остання гідратується з утворенням яблучної кислоти (сьома реакція). Під впливом НАД вона окиснюється до щавлевооцтової кислоти (оксалоацетат) – восьма реакція, тобто до того субстрату, з якого починається цикл трикарбонових кислот.
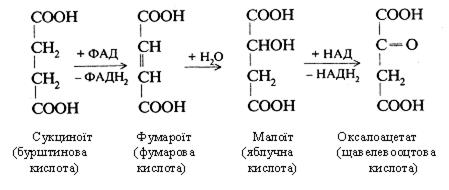
Процес аеробного окиснювання вуглеводів відбувається з виділенням енергії (за рахунок НАДН2 і ФАДН,). Одна молекула НАДН2 виділяється на стадії декарбоксилювання пірувата з утворенням ацетил-КоА.
Окиснювання ізолимонної кислоти в щавелевобурштинову також супроводжується виділенням молекули НАДН2. При декарбоксилюванні α-кетоглутарової кислоти утворюється сукциніл-КоА й НАДН2. Сукциніл-КоА перетворюється в бурштинову кислоту з утворенням 1 молекули АТФ (за рахунок ГТФ). Дегідрування бурштинової кислоти відбувається з виділенням ФАДН2, а дегідрування яблучної – з виділенням НАДН2. Відомо, що 1 молекула НАДН2 еквівалентна 3 молекулам АТФ, а 1 молекула ФАДН2 – 2 молекулам АТФ.
Отже, з однієї тріози в аеробному циклі утворюється 4 молекули НАДН2 (12 молекул АТФ), 1 молекула ФАДН2 (2 молекули АТФ) і 1 молекула АТФ (ГТФ). Оскільки з однієї молекули глюкози утворюється 2 тріози, вихід енергії буде становити 15 х 2 = 30 молекул АТФ, а повне окиснювання 1 молекули глюкози в анаеробному і аеробному циклах складе 8 + 30 = 38 молекул АТФ.
Щавелевооцтова кислота, що утворилася, може вступати в реакцію з іншою молекулою ацетил-КоА й процес починається спочатку. Таким чином, певна кількість щавелевооцтової кислоти неодноразово бере участь у реакції й забезпечує окиснювання до СО2 і Н2О великої кількості оцтової кислоти, що утворюється з вуглеводів, ліпідів, білків й інших сполук. Але цей процес не нескінченний. Щавелевооцтова кислота в мітохондріях декарбоксилюється з утворенням піровиноградної кислоти, що у свою чергу перетворюється в ацетил-КоА.
Виділенням енергії не вичерпується значення циклу трикарбонових кислот. Роль його полягає також в тому, що при аеробному окиснюванні вуглеводів утворюються проміжні речовини, які використовуються для різних процесів біосинтезу. Так, α-кетоглутарова й щавелевооцтова кислоти можуть перетворюватися в амінокислоти (глутамінову й аспарагінову), необхідні для синтезу білків, азотистих основ, гормонів, нуклеотидів.
Цикл Кребса поставляє відбудовні еквіваленти в ланцюг дихальних ферментів, де потік електронів і протонів сполучений з утворенням АТФ. Цикл не може протікати швидше, ніж це дозволяє використання АТФ. Він регулюється за типом зворотного зв'язку: інгібується АТФ й активується АДФ, що накопичується в міру утилізації АТФ.
Пентозний цикл окиснювання вуглеводів. Подання про існування в тканинах тварин, рослин і мікробів іншого механізму окиснювання вуглеводів, що відрізняється від розглянутого вище, були розвинені на основі робіт головним чином Варбурга, Дікенса й В.А. Енгельгардта, що показали можливість окиснювання гексозомонофосфата в клітинах тварин (наприклад, в еритроцитах) без попереднього розщеплення на дві фосфотріози. Розбіжність шляхів окиснювання вуглеводів – класичного – лимоннокислого циклу Кребса й «пентозного» – починається на стадії утворення гексозомонофосфату. Якщо гексозомонофосфат (фруктозо-6-монофосфорний ефір) піддається ще раз фосфорилюванню й перетворюється у фруктозодифосфат, то в цьому випадку подальший розпад вуглеводів відбувається за звичайним гліколітичним шляхом з утворенням фосфотріоз і піровиноградної кислоти, яка «згоряє» потім у лимоннокислому «казані».
Якщо ж приєднання другої частки фосфату до гексозо-6-монофосфорному ефіру не відбувається, то глюкозомонофосфат може піддаватися прямому окислюванню з відщіпленням СО2 й утворенням пентозофосфату. Звідси відбулася й назва – пряме окиснювання вуглеводів у пентозному циклі.
Основний шлях окиснювання вуглеводів в організмі тварин здійснюється за звичайним гліколітичним шляхом (за схемою Ембдена-Мейергофа-Парнаса-Кребса). Тільки в окремих органах і тканинах, наприклад, у жировій тканині, печінці, еритроцитах, надниркових залозах, лімфатичних вузлах і деяких інших тканинах має істотне значення окиснювання гексозофосфатів у пентозному циклі.
РЕГУЛЯЦІЯ ОБМІНУ ВУГЛЕВОДІВ І ЙОГО ПОРУШЕННЯ. Рівень глюкози в крові здорових людей постійний, він відображає стан вуглеводного обміну взагалі й глюкози зокрема. У нормі в крові міститься 3,33…5,55 ммоль/л (~ 4…6 одиниць) вуглеводів.
Моносахариди крові використовуються головним чином для енергетичних потреб організму (70 %), частина з них бере участь у біосинтезі ліпідів, антитіл, мукополісахаридів, тобто виконує пластичну функцію.
Найбільше значення в організмі має глюкоза. Це пов'язано з високим, у порівнянні з іншими моносахаридами, вмістом її в харчових продуктах й в організмі, а також з більшою активністю клітинних ферментів, які каталізують її перетворення. Крім того, у печінці активно протікають процеси перетворення різних моносахаридів у глюкозу, і тільки вона може запасатися у вигляді глікогену, що, розпадаючись, забезпечує потреби організму в цьому вуглеводі.
Різні порушення обміну вуглеводів проявляються в першу чергу зміною вмісту глюкози в крові, а регуляцію цього виду обміну речовин можна розглядати як регуляцію рівня глюкози в крові.
Обмін вуглеводів у цілому і кількість глюкози в крові, зокрема, регулюються нервовою системою і залозами внутрішньої секреції. Природним подразником служить зниження вмісту глюкози в крові (гіпоглікемія), що наступає у випадках, коли перерви між черговими прийомами їжі перевищують 5…6 год. Збіднена глюкозою кров надходить у мозок, викликаючи рефлекторне порушення метаболічних центрів гіпоталамуса і довгастого мозку. У відповідь виникають імпульси, що стимулюють розпад глікогену печінки до глюкози й відновлення її рівня в крові до норми.
Важливе місце в регуляції обміну вуглеводів належить гормону підшлункової залози – інсуліну, що утворюється в β-клітках острівкової тканини підшлункової залози. Інсулін знижує рівень глюкози в крові шляхом активного використання її клітинами тканин, тобто підвищує проникність мембран кліток для глюкози, що приводить до зменшення її вмісту в крові (гіпоглікемічний ефект). Глюкоза, що надійшла в клітини, при участі АТФ і гексокінази перетворюється в глюкозо-6-фосфат.
Глюкозо-6-фосфат, що утворився, не може вийти із клітини й піддається різним перетворенням. При надлишку глюкози в клітинах інсулін стимулює синтез глікогену в печінці й м'язах, окиснювання моносахаридів і перетворення їх у ліпіди.
При недостатності інсуліну спостерігається підвищення рівня глюкози в крові (гіперглікемія), надлишкове виведення глюкози із сечею (глюкозурія) і зниження кількості глікогену в печінці. Постійна гіперглікемія і глюкозурія є симптомами цукрового діабету – важкого захворювання, викликаного порушенням функції підшлункової залози.
Тимчасове підвищення кількості глюкози в крові й поява її в сечі називають відповідно до аліментарної (харчової) гіперглікемією й глюкозурією. Вони виникають при високому споживанні солодких вуглеводів (понад 100 г за один прийом).
З інших гормонів важливе значення має адреналін – гормон мозкової речовини надниркових залоз. Він викликає гіперглікемію, тому що активує фермент печінки фосфорилазу, яка каталізує розпад глікогену до вільної глюкози. Механізм дії адреналіну складний. У печінці він активує перетворення неактивної форми фосфорилази в активну через ряд проміжних передавачів (рецептори клітин, аденілатциклаза, ц-АМФ, протеїнкіназа та ін.). У м'язах адреналін активує розпад глюкози до молочної кислоти.
Бере участь у регуляції вуглеводного обміну і глюкагон – гормон α-кліток острівців Лангерганса підшлункової залози. Він підвищує рівень глюкози у крові.
Впливають на рівень глюкози в крові гормони коркової речовини надниркових залоз – глюкокортикоїди. Вони підвищують її кількість шляхом активації вироблення глюкози з невуглеводних компонентів (глюконеогенез). Гормони гіпофіза (адренокортикотропний, соматотропний й ін.) стимулюють вироблення глюкокортикоїдів й, отже, сприяють підвищенню рівня глюкози в крові.
Особлива роль у регуляції обміну вуглеводів належить печінці. У ній активно протікає розпад і синтез глікогену. При гіпоглікемії відбувається активний розпад глікогену печінки до глюкози, що потім надходить у кров. При гіперглікемії клітини печінки активно захоплюють глюкозу із крові і використовують її для синтезу глікогену. Участь печінки в регуляції обміну вуглеводів проявляється в інактивації глюкокортикоїдів і в активації синтезу інсулінази – ферменту, що розщеплює інсулін. Крім того, є ще один шлях регуляції – за типом зворотного зв'язку: при надлишку глюкозо-6-фосфата активізується синтез глікогену і гальмується його розпад, а недолік глюкози в крові запускає гідроліз глюкозо-6-фосфата до вільної глюкози.
Ознаками порушення вуглеводного обміну є гіперглікемія, глюкозурія, гіпоглікемія.
Гіперглікемія може бути інсулярного або екстраінсулярного походження. Інсулярная гіперглікемія розвивається при зниженні вироблення інсуліну в результаті поразки острівців Лангерганса підшлункової залози. Гіперглікемії, не пов'язані з виробленням інсуліну, можуть бути викликані фізіологічними й іншими причинами. Як відомо, аліментарні гіперглікемії виникають при надлишковому споживанні їжі, багатої вуглеводами (наприклад, фруктів, солодощів). Нейрогенні гіперглікемії (центральні) пов'язані з різними емоційни-ми факторами (радість, страх), які стимулюють вироблення адреналіну, що викликає посилений розпад глікогену до глюкози і надходження її в кров. Причинами екстраінсулярних гіперглікемій можуть бути захворювання залоз внутрішньої секреції (пухлини гіпофіза, надниркових залоз, тиреотоксикоз), що викликають гіперсекрецію відповідних гормонів. До гіперглікемії приводять отруєння фосфором, окислом карбогену, травми, пухлини мозку та ін.
Зниження рівня обміну глюкози і як наслідок – підвищення її вмісту в крові, можуть бути обумовлені порушеннями функцій ферментних систем при запальних процесах в організмі.
У сечі здорової людини глюкози практично немає, тому що вона піддається зворотному всмоктуванню в ниркових канальцях. Якщо рівень вмісту глюкози в крові перевищує «нирковий поріг» (6,68 ммоль/г), то нирки перестають ресорбувати цей моносахарид, частина глюкози попадає в сечу, розвивається глюкозурія.
Зниження рівня глюкози в крові (нижче 2,40 ммоль/г) – гіпоглікемія проявляється симптомами: слабкістю, сильним потовідділенням, погіршенням діяльності центральної нервової системи, втратою свідомості. Вона може розвиватися при передозуванні інсуліну у хворих цукровим діабетом. Гіпоглікемія спостерігається також при підвищеному виділенні інсуліну підшлунковою залозою, зниженому синтезу гормонів щитовидної залози, захворюваннях надниркових залоз (Адісонова хвороба). Знижується надходження глюкози в кров через порушення її всмоктування в кишечнику при захворюваннях тонкої кишки (ентероколітах) і жовчних шляхів. Гіпоглікемія виникає також при захворюваннях печінки (її жирова інфільтрація та ін.) і ряді інфекційних хвороб.
Серед порушень вуглеводного обміну варто виділити деякі спадкоємні захворювання, що приводять до зміни синтезу ряду ферментів. Так, спадкоємні захворювання, в основі яких лежать порушення діяльності ферментів, які каталізують процеси розпаду глікогену, називаються глікогенозами. Вони пов'язані з недостатністю фосфорилази в печінці або в кісткових м'язах, відсутністю глюкозо-6-фосфатази в печінці та ін.
Дата добавления: 2020-03-17; просмотров: 1246;











