Кристаллическое строение и свойства металлов.
Характерные свойства металлов: прочность, пластичность, электро- и теплопроводность и д. р. обусловлены их строением на межатомном и внутриатомном уровне.
Металлы- кристаллы, т. е. упорядоченные структуры, в которых атомы не перемещаются относительно друг друга.
При тепловых процессах могут происходить перемещения, называемые диффузией.
Все металлы, затвердевающие в нормальных условиях, представляют собой кристаллические вещества, то есть укладка атомов в них характеризуется определенным порядком – периодичностью, как по различным направлениям, так и по различным плоскостям. Этот порядок определяется понятием кристаллическая решетка.
Кристаллическая решетка это воображаемая пространственная решетка, в узлах которой располагаются частицы, образующие твердое тело.
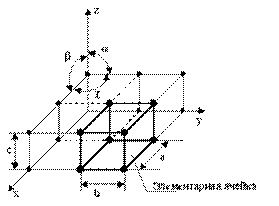
Рис.1.1. Схема кристаллической решетки
Элементарная ячейка – элемент объема из минимального числа атомов, многократным повтором которого можно построить весь кристалл.
Элементарная ячейка характеризует особенности строения кристалла. Основными параметрами кристалла являются:
· размеры ребер элементарной ячейки. a, b, c – периоды решетки – расстояния между центрами ближайших атомов. В одном направлении выдерживаются строго определенными.
· координационное число (К) указывает на число атомов, расположенных на ближайшем одинаковом расстоянии от любого атома в решетке.
· базис решетки количество атомов, приходящихся на одну элементарную ячейку решетки.
· плотность упаковки атомов в кристаллической решетке – объем, занятый атомами, которые условно рассматриваются как жесткие шары. Ее определяют как отношение объема, занятого атомами к объему ячейки (для простой кубической решетки – 0,52, объемно-центрированной кубической решетки – 0,68, для гранецентрированной кубической решетки – 0,74) или число атомов, приходящееся на одну ячейку решетки.
Существуют разные типы кристаллических решеток, которые удерживаются металлическими связями. Металлической называется связь посредствам электронного газа, характерна для металлов.
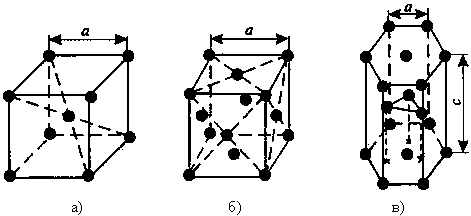
Рис. 1.2. Основные типы кристаллических решеток: а – объемно-центрированная кубическая; б– гранецентрированная кубическая; в – гексагональная плотноупакованная
Прочность металла зависит от плотности упаковки его кристаллической решетки и особенно строения атомов. Плотность упаковки определяется числом атомов, приходящихся на одну ячейку решетки. Чем больше плотность упаковки кристаллов, тем больше связей в кристалле и тем плотнее и прочнее металл.
Анизотропия
Свойства тела зависят от природы атомов, из которых оно состоит, и от силы взаимодействия между этими атомами. Силы взаимодействия между атомами в значительной степени определяются расстояниями между ними. В аморфных телах с хаотическим расположением атомов в пространстве расстояния между атомами в различных направлениях равны, следовательно, свойства одинаковы, то есть аморфные тела изотропны
В кристаллических телах атомы правильно располагаются в пространстве, причем по разным направлениям расстояния между атомами неодинаковы, что предопределяет существенные различия в силах взаимодействия между ними и, в конечном результате, разные свойства. Характерной особенностью кристаллических тел является анизотропия их свойств, что очень ярко проявляется только у монокристаллов и слабее у текстурованных материалов.
Причиной данного свойства является то, что на различных направлениях кристалла находится разное число атомов, что приводит к анизотропии - различности свойств по различным направлениям в кристалле.
Обычно анизотропия наблюдается в пределах одного зерна (монокристалла), а металлы - поликристаллы. Поэтому реальные металлы без специальной обработки изотропны (“псевдоизотропия”).
Аллотропия
Способность некоторых металлов существовать в различных кристаллических формах в зависимости от внешних условий (давление, температура) называется аллотропией или полиморфизмом.
Аллотропия - пособность изменять кристаллическое строение при определённой температуре, перестраивая тип элементарной ячейки.
Ярким примером полиморфизма является железо:
Fe –t1=911°С – ОЦК ® ГЦК t2=1392°С ® ОЦК до t3=1539°С- (t плавления ).










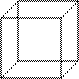
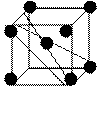
Рис. 1.3. а – ОЦК объемно-центрированная кубическая; б– ГЦК гранецентрированная кубическая
Другим общеизвестным веществом, на примере которого хорошо видно, как могут меняться свойства от перестройки ячейки, является углерод, который может находится в природе в виде графита и алмаза.
Причиной перестройки является стремление любого вещества обладать min запасом свободной энергии, которая зависит от абсолютной Т.
Разные аллотропические формы металлов обозначаются буквами греческого алфавита a, b, γ и т. д. с увеличением температуры перестройки.
Наличие у металлов полиморфных свойств имеет важное значение, т. к. при этом происходит изменение у металлов плотности r, способности растворять другие элементы.
Именно благодаря полиморфизму сплавы на основе Fe, Ti и других металлов можно подвергать термической обработке для изменения их свойств.
Дата добавления: 2019-12-09; просмотров: 856;











