ЭНЕРГЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ
(ТЕРМОХИМИЧЕСКИЕ РАСЧЕТЫ)
Все химические процессы сопровождаются энергетическими эффектами, т.е. выделением или поглощением энергии в том или ином виде.
Изучением энергетических эффектов химических реакций занимается термохимия. Термохимия – это раздел термодинамики, изучающий энергетические эффекты различных химических процессов, направление и пределы их самопроизвольного протекания.
Термодинамические свойства системы можно выразить с помощью нескольких функций состояния системы. Важная особенность функций состояния – их независимость от способа достижения данного состояния системы. Функции состояния:U – внутренняя энергия, H - энтальпия, S - энтропия и G – изобарно-изотермический потенциал или энергия Гиббса.
В любом процессе соблюдается закон сохранения энергии, выражаемый равенством:
Q=DU+А (1)
где Q- теплота (неупорядоченная форма передачи энергии);
DU - внутренняя энергия;
А- работа (упорядоченная форма передачи энергии).
Выражение (1) является математическим выражением первого законатермодинамики.Из выражения (1) следует, что теплота, подведенная к системе, расходуется на увеличение ее внутренней энергии (DU) и на совершение работы (А).
Под работой подразумевается сумма всех видов работы против сил, действующих на систему со стороны внешней среды. Это работа против сил внешнего электрического поля, против сил гравитационного поля, работа расширения и т.д.
Для химических взаимодействий наиболее характерна работа расширения:
А =Р •DV (2)
Тогда выражение (1) записывается так:
Qp=DU+pDV (3)
т.к. DU=U2-U1 и DV=V2-V1, то
Qp=(U2-U1)+р(V2-V1)=(U2+рV2)-(U1+рV1) (4)
Сумму (U+рV)- называют энтальпиейсистемы
Н=U+pV (5)
Подставив (5) в выражение (4), получим:
Qp=H2-H1=DH (6)
Энтальпия (Н) – функция состояния (т.к. из выражения (6) видно, что значение Н зависит от конечного и начального состояния системы), которая характеризует теплосодержание системы.
Так же как и для внутренней энергии, абсолютное значение энтальпии системы экспериментально определить невозможно, но можно найти изменение энтальпии при переходе системы из одного состояния в другое.
При экзотермических процессах энтальпия уменьшается (DН<0), а при эндотермических – увеличивается (H>0).
В основе термохимических расчетов лежит Закон Гесса:тепловой эффект химической реакции не зависит от пути ее протекания, а зависит лишь от природы и физического состояния исходных веществ и продуктов реакции.
В основе большинства расчетов лежит следствие из закона Гесса: тепловой эффект химической реакции равен сумме энтальпий образования продуктов реакции за вычетом сумм энтальпий образования исходных веществ.
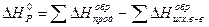 (7).
(7).
Уравнение (7) позволяет определить как тепловой эффект реакции, так и одну из энтальпий образования, если известны тепловой эффект реакции и все остальные энтальпии образования.
Энтропию системы S можно рассматривать как меру неупорядоченности ее состояния.
Энтропия, как и энтальпия, и внутренняя энергия – функция состояния системы, поэтому изменение энтропии DS в ходе превращения системы определяется только начальным и конечным состоянием системы и не зависит от пути протекания процесса.
Процессы, при которых ΔS>0:
1). Расширение газов;
2). Фазовые превращения, при которых вещество переходит от твердого к жидкому и газообразному состояниям;
3). Растворение кристаллических веществ и т.д.
Процессы, при которых ΔS<0:
1). Сжатие газов:
2). Конденсация и кристаллизация веществ и т.д.
Поскольку энтропия S есть функция состояния, то изменение энтропии DS (химической реакции), равно разности между значениями абсолютной энтропии продуктов и реагентов при температуре и давлении, при которых протекает реакция. Для химической реакции в стандартных условиях:
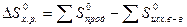
Многие процессы протекают без подвода энергии извне. Такие процессы называются самопроизвольными. Примерами самопроизвольных химических процессов могут служить образование ржавчины на металлах, растворение солей в воде и т.д. Чтобы управлять такими процессами, необходимо знать, каковы движущие силы и критерии самопроизвольных химических реакций. В любом химическом процессе проявляются две тенденции:
1) Стремление к образованию прочных связей между частицами, к возникновению более сложных веществ, что сопровождается понижением энергии системы. Эта тенденция при изобарно-изотермических условиях характеризуется энтальпийным фактором процесса и количественно выражается через DН.
2) Стремление к разъединению частиц, к беспорядку, которое характеризуется возрастанием энтропии. Данная тенденция характеризуется энтропийным фактором и количественно выражается произведением Т×DS.
Эти факторы, которые характеризуют две противоположные тенденции процесса не могут по отдельности быть критериями самопроизвольного протекания процесса.
Критерием принципиальной осуществимости процессов, протекающих в закрытой системе при T=const и P=const, является изменение в ходе процесса термодинамической функции состояния, называемой изобарно-изотермическим потенциалом (G)
DG=H-TDS
Или просто изобарным потенциалом (синонимы: энергия Гиббса, свободная энергия).
Условия принципиальной возможности протекания процесса при постоянных температуре Т и давлении Р: DG<0.Процесс принципиально не возможен в данных условиях, если DG>0.В системе наступает химическое равновесие, если DG=0
DG – функция состояния, т.е. ее значение не зависит от пути протекания процесса, а лишь от исходного и конечного состояния системы. Поэтому
DGх.р. = SDGобрпродуктов - SDGобрисх.веществ
ПРИМЕР 1. Вычислите, при какой температуре начнется диссоциация пентахлорида фосфора, протекающая по уравнению РСl5(Г) = РСl3(Г) + Сl2(Г).
РЕШЕНИЕ: Когда начнется диссоциация пентахлорида фосфора, в системе установится равновесие РСl5(Г) « РСl3(Г) + Сl2(Г). и нам нужно найти температуру, при которой DG(Х.Р.) = 0. Для этого воспользуемся соотношением DG(Х.Р.) = DН(Х.Р.) — ТDS(Х.Р.),. При DG(Х.Р.) = 0
DН(Х.Р.)
DН(Х.Р.) = ТDS(Х.Р.) Т = —————
DS(Х.Р.)
Величины DНХ.Р. и DSХ.Р. найдем из уравнений функций состояния:
DНХ.Р. = SDН0ПРОД. — SDН0ИСХ. И DSХ.Р. = SS0ПРОД. — SS0ИСХ.
DНХ.Р. = DН0(РСl3(Г)) + DН0(Сl2(Г)) — DН0(РСl5(Г)) Из приложения:
DНХ.Р. = —306,35 + 0 — (—398,94) = 92,59 кДж
DSХ.Р. = S0(РСl3(Г)) + S0(Сl2(Г)) — S0(РСl5(Г)) Из приложения:
DSХ.Р = 311,66 + 222,95 — 352,71 = 181,90 Дж/К = 0,18190 кДж/К
DНХ.Р. 92,59
Т = ——— = ———— = 509 К
DSХ.Р. 0,18190
Следовательно, при температуре ~ 509 К установится равновесие. Выше этой температуры будет доминировать процесс диссоциации пентахлорида фосфора, ниже — процесс его образования.
ПРИМЕР 2:На основании стандартных теплот образования и абсолютных стандартных энтропий веществ (см. приложение 1) вычислите DG0298 реакции, протекающей по уравнению СО(г) + Н2О(ж) = СО2(г) + Н2(г).
РЕШЕНИЕ: DG=H-TDS. DН и DS – функции состояния, поэтому
1) DНХ.Р. = SDН0ПРОД. — SDН0ИСХ. , DНХ.Р = DН0(СО2(г)) + DН0(Н2(г)) - DН0(СО(г)) - DН0(Н2О(ж))
Из приложения: DНХ.Р = (-393,51 + 0) – (-110,52 – 285,84) = +2,85 кДж.
2) DSХ.Р. = SS0ПРОД. — SS0ИСХ., DS Х.Р = D S 0(СО2(г)) + D S 0(Н2(г)) - D S 0(СО(г)) - D S 0(Н2О(ж))
Из приложения: DS Х.Р = (213,65 + 130,59) – (197,91 + 69,94 = +76,39 Дж\K = 0,07639кДж/К.
3) DG=H-TDS, где Т = 298К; DG = +2,85 – 298∙0,07639 = -19,91кДж.
Ответ: DG = -19,91кДж.
ИНДИВИДУАЛЬНЫЕ ЗАДАНИЯ
21. Проанализируйте энтальпийный и энтропийный факторы в реакции
FеО + Сu ↔ СuО + Fе. Возможна ли эта реакция при стандартных условиях? Можно ли подобрать температуру, выше или ниже которой реакция термодинамически была бы разрешена?
22. При каких температурах начинается восстановление железа
Fе3О4(К) + 4С(ГРАФИТ) ↔ 3Fе(К) + 4СО(г)
23. При какой температуре меняется направление процесса в системе: 4НСl(Г) + О2(Г) ↔ 2Н2О(Г) + 2Сl2(Г)? Хлор или кислород является более сильным окислителем при стандартных условиях?
24. Пользуясь стандартными величинами DG0 химических веществ (приложение), вычислите DG реакций: РbО2(К) + Рb(К) ↔ 2РbО(К) и SnО2(К) + Sn(К) ↔ 2SnО(К). Какие степени окисления более характерны для свинца и олова?
25. При каких температурах возможен процесс восстановления Fе3О4 по уравнению:
Fе3О4(К) + СО(Г) ↔ 3FеО(К) + СО2(Г)? Возможна ли эта реакция при стандартных условиях?
26.Проанализируйте энтальпийный и энтропийный факторы в реакции получения муравьиного альдегида Н2СО(Г) по реакции: СО(Г) + Н2(Г) ↔ Н2СО(Г)Возможна ли эта реакция при стандартных условиях? При каких температурах реакция термодинамически разрешена?
27. Рассчитав ΔG реакций, найдите, какие из карбонатов: ВеСО3, СаСО3 или ВаСО3 — можно получить по реакции взаимодействия соответствующих оксидов с СО2 при стандартных условиях? Какая реакция идет наиболее энергично?
28. При каких температурах возможен процесс восстановления:
Fе2О3(К) + 3Н2(Г) ↔ 2Fе(К) + 3Н2О(Г)?
29. При каких температурах станет возможным протекание реакции: WО3(К) + 3С(ГРАФИТ) ↔ W(К) + 3СО(Г)?
30. Азотное удобрение — нитрат аммония при неосторожном обращении (или умышленно) может самопроизвольно взрываться по реакции NН4NО3(К) ↔ N2О(Г) + 2Н2О(Г).Может ли самопроизвольно разлагаться хлорид аммония по реакции NН4Сl(К) ↔ NН3(Г) + НСl(Г)? Ответ докажите, сопоставив для обеих реакций величины ΔG.
31. При каких температурах хлор может разлагать воду по уравнению: 2Сl2(Г) + 2Н2О(Г) ↔ О2(Г).+ 4НСl(Г)? Почему повышение температуры способствует этому процессу?
32. При каких температурах начинается восстановление железа Fе3О4(К) + 4С(ГРАФИТ) ↔ 3Fе(К) + 4СО(г) ?
33. Пользуясь стандартными величинами DG0 химических веществ (приложение), вычислите DG реакций: Fе2О3(К) + Fе(К) ↔ 3FеО(К) и РbО2(К) + Рb(К) ↔ 2РbО(К). Какие степени окисления более характерны для железа и свинца?
34. При каких температурах начинается восстановление железа
Fе3О4(К) + 4С(ГРАФИТ) ↔ 3Fе(К) + 4СО(г) ?
35. Можно ли получить при стандартных условиях кислород по реакциям: 2Сl2(Г) + 2Н2О(Г) ↔ О2(Г).+ 4НСl(Г) и 2F2(Г) + 2Н2О(Г) ↔ О2(Г).+ 4НF(Г)? На основании полученных данных расположите F2, Сl2 и О2 в ряд по окисляющей способности при н.у.
36. При каких температурах процесс диссоциации хлористого аммония по уравнению: NН4Сl(К) ↔ NН3(Г) + НСl(Г) станет преобладающим? Идет ли он при стандартных условиях?
37. Вычислите, при какой температуреначнется образование пентахлорида фосфора, протекающая по уравнению:
PCl3(г) + Cl2(г) ↔ PCl5(г)
38. Проанализируйте энтальпийный и энтропийный факторы в реакции Fе2О3(К) + 3С(ГРАФИТ) ↔ 2Fе(К) + 3СО(г) При каких температурах реакция термодинамически разрешена?
39. При каких температурах возможно самопроизвольное протекание реакции 2СО(Г) + 2Н2(Г) ↔ СН4(Г) + СО2(Г)?
40.При каких температурах возможно самопроизвольное протекание процесса 2NО(Г) + О2(Г) ↔ 2NО2(Г)
Дата добавления: 2022-02-05; просмотров: 447;











