Теория атома И. Бора. Принцип соответствия
В свете тех выдающихся открытий конца XIX в., которые революционизировали физику, одной из ключевых стала проблема строения атомов. Еще в 1889 г. в своей Фарадеевской лекции Д.И. Менделеев отмечал, что в результате выявления специфической периодичности химических свойств элементов, расположенных по возрастающим атомным весам, центральной проблемой физики становится проблема строения атома *.
* Менделеев Д.И. Полн. собр. соч. М., 1937. Т. 2. С. 347.
В 1909—1910 гг. Э. Резерфордом были проведены экспериментальные исследования рассеяния α-частиц тонким слоем вещества. Как показали эти исследования, большинство α-частиц, пронизывающих тонкий слой вещества, рассеиваются силовыми центрами, которые действуют на них с силой, обратно пропорциональной квадрату расстояния. Некоторые сравнительно немногие частицы отклонялись на угол 90° и более; по-видимому, они встретились с очень сильными электрическими полями. Результаты этого исследования позволили Резерфорду в 1911 г. сформулировать планетарную модель атома. По модели Резерфорда, атом состоит из положительного ядра гораздо меньших размеров, нежели атом, — порядка 10-13 см. Вокруг ядра вращаются электроны. Общий заряд атома равен нулю, поэтому заряд ядра по абсолютной величине равен nе, где n — число электронов в атоме, е — заряд электрона. Резерфорд полагал также, что число электронов в атоме должно быть равно порядковому номеру элемента в периодической системе Менделеева. Но модель Резерфорда не объясняла многих выявленных к тому времени закономерностей излучения атомов, вид атомных спектров и др.
Более совершенную квантовую модель атома предложил в 1913 г. молодой датский физик Н. Бор, работавший в лаборатории Резерфорда. Бор понял, что для построения теории, которая объясняла бы и результаты опытов по рассеянию α -частиц, и устойчивость атома, и сериальные закономерности, и ряд других экспериментальных данных, нужно отказаться от ряда принципов классической физики. Бор взял за основу модель атома Резерфорда и дополнил ее новыми гипотезами, которые не следуют или даже противоречат классическим представлениям. Эти гипотезы известны как постулаты Бора. Они сводятся к следующему.
1. Каждый электрон в атоме может совершать устойчивое орбитальное движение по определенной орбите, с определенным значением энергии, не испуская и не поглощая электромагнитного излучения. В этих состояниях атомные системы обладают энергиями, образующими дискретный ряд: Е1, Е2, ..., Еn. Состояния эти характеризуется своей устойчивостью. Всякое изменение энергии в результате поглощения или испускания электромагнитного излучения может происходить только скачком из одного состояния в другое.
2. Электрон способен переходить с одной стационарной орбиты на другую. Только в этом случае он испускает или поглощает определенную порцию энергии монохроматического излучения определенной частоты. Эта частота зависит от уровня изменения энергии атома при таком переходе. Если при переходе электрона с орбиты на орбиту энергия атома изменяется от Еm до Еn, то испускаемая или поглощаемая частота определяется условием
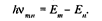
Эти постулаты Бор использовал для расчета простейшего атома (водорода), рассматривая первоначально наиболее простую его модель: неподвижное ядро, вокруг которого по круговой орбите вращается электрон. Объяснение спектра водорода было большим успехом теории Бора.
Квантовые постулаты Бора были лишь первым шагом в создании теории атома, поэтому пришлось воспользоваться следующим приемом: сначала задача решалась при помощи классической механики (заведомо неприменимой полностью к внутриатомным движениям), а затем из всего непрерывного множества состояний движения, к которым приводит классическая механика, на основе квантовых постулатов отбирались квантовые состояния. Несмотря на все несовершенство этого метода, он привел к большим успехам — позволил объяснить сложные закономерности в атомных и молекулярных спектрах, осмыслить природу химических взаимодействий и др. Такой подход, по сути, является частным случаем общего принципа, играющего важную роль в современной теоретической физике — принципа соответствия, который гласит, что всякая неклассическая теория в соответствующем предельном случае переходит в классическую.
Важным достижением Бора и других исследователей было развитие представления о строении многоэлектронных атомов. Предпринятые шаги в развитии теории строения более сложных (чем водород) атомов и объяснении структуры их спектров принесли некоторые успехи, однако здесь исследователи столкнулись с большими трудностями. Введение четырех квантовых чисел, характеризующих состояния электрона в атоме, установление принципа Паули (согласно которому две тождественный частицы с полуцелым спином не могут одновременно находиться в одном состоянии) и объяснение периодической системы Менделеева — большие успехи теории атома Бора. Однако они не означали, что эту теорию можно считать завершенной. Во-первых, постулаты Бора и многие принципы его теории имели характер непонятных, ни откуда не следуемых утверждений, которые еще должны получить свое обоснование. Во-вторых, в некоторых даже довольно простых случаях применение данной теории встречало непреодолимые трудности; так, например, попытки теоретически рассчитать даже такой, казалось бы, простой атом, как атом гелия, не привели к успеху. Физики ясно понимали неудовлетворительность боровской теории атома.
Таким образом, в первой четверти XX в. перед физикой все еще стояла задача поиска новых путей развития теории атомных явлений. Ее решение потребовало отказа от ряда давно установленных понятий и выработки совершенно новых теоретических представлений и принципов.
Дата добавления: 2021-11-16; просмотров: 457;











