Первое начало термодинамики
В термодинамике закон сохранения энергии выражается в виде I начала термодинамики, который формулируется следующим образом: теплота dQ, подведенная к замкнутой системе, расходуется на увеличение внутренней энергии dU и работу dA, производимую системой против внешних сил, т.е.
dQ = dU + dA (10.1)
Полученное уравнение носит название уравнения Клаузиуса[1]. В более корректной форме уравнение (10.1) имеет вид
dQ = dU + dA, (10.2)
где dQ, dA – бесконечно малые величины. Однако, в таком изменение записи нет необходимости и в дальнейшем будем пользоваться формулой (10.1).
Внутренняя энергия системы складывается из кинетических и потенциальных энергий частиц, составляющих данную систему
U = Ек + Еп (10.3)
Для идеального газа Еп = 0 и внутренняя энергия определяется только кинетической энергией молекул газа, т.е. U = Ек.
Для одного моля газа Екm
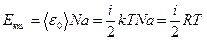 , (10.4)
, (10.4)
где <e0> – средняя кинетическая энергия одной молекулы, Na – число Авогадро, i – число степеней свободы молекул, Т – температура, R – молярная газовая постоянная.
Для произвольной массы газа m
 , (10.5)
, (10.5)
где М – молярная масса газа.
Изменение внутренней энергии
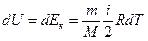 (10.6)
(10.6)
Внутренняя энергия газа может изменяться в результате или процесса теплопередачи, или процесса совершения работы.
Рассмотрим, что собой представляет в термодинамике работа dA. При нагревании газа (передача теплоты dQ) поршень поднимается – газ совершает работу против внешних сил (рис.10.1)
dA = Fdh, (10.7)
где F = PS, P – давление газа, S – площадь поршня.
Тогда
dA = PSdh = PdV, (10.8)
где dV – изменение объема газа.
После соответствующих подстановок уравнение Клаузиуса примет вид
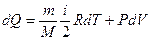 (10.9)
(10.9)
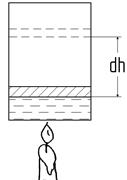
Рис.10.1
Графически работа изображается площадью под кривой, а заштрихованная площадь (рис. 10.2) вычисляется по формуле (10.8).
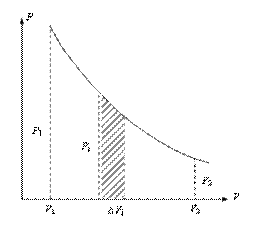
Рис.10.2
Полную работу А, совершаемая газом при изменении его объема от V1 до V2 найдем интегрируя уравнение (10.8)
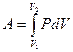 (10.10)
(10.10)
Теплоемкости газов
Удельной теплоемкостью вещества С называется количество теплоты dQ, необходимое для нагревания газа массой m = 1 кг на 1 градус
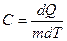 ,
,  (10.11)
(10.11)
Молярной теплоемкостью Сm называют количество теплоты, необходимое для нагревания 1 моля вещества на 1 К
 ,
,  (10.12)
(10.12)
где 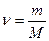 – количество молей (количество вещества), М – молярная масса.
– количество молей (количество вещества), М – молярная масса.
Удельная и молярная теплоемкости связаны соотношением
Сm = СМ (10.13)
Из I начала термодинамики следует, что теплоемкость газа зависит от способа передачи энергии. Передача теплоты газу может осуществляться при V = const или при P = const.
Для одного моля газа I начало термодинамики имеет вид
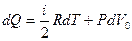 , (10.14)
, (10.14)
где V0 – объем одного моля газа.
При V = const dA = 0 и dQ = dU. Тогда молярная СmV и удельная СV теплоемкости равны соответственно
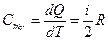 ,
, 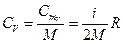 (10.15)
(10.15)
Теперь рассмотрим теплоемкость при P = const.
Для одного моля газа
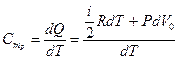 , (10.16)
, (10.16)
Воспользуемся уравнением Менделеева-Клапейрона и подставим в (10.16) 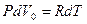 . Тогда молярная CmP и удельная CP теплоемкости равны соответственно
. Тогда молярная CmP и удельная CP теплоемкости равны соответственно
 ,
,  (10.17)
(10.17)
Сравнивая уравнения (10.15) и (10.17), видим, что теплоемкость при P = const больше теплоемкости при V = const. Это объясняется тем, что тепло, сообщаемое газу при P = const идет не только на увеличение внутренней энергии, но и дополнительно на совершение работы против внешних сил (на увеличение объема). Согласно сказанному, для одного моля газа
Сmp – CmV = R (10.18)
Выражение (10.18) называется уравнением Майера[2], которое раскрывает физический смысл молярной газовой постоянной R – она равна работе, совершаемой молем идеального газа при повышении температуры на 1К при P = const.
При изучении термодинамических процессов важно знать отношение 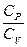 (вне зависимости от того, молярные это теплоемкости или удельные), которое зависит от свойств газа
(вне зависимости от того, молярные это теплоемкости или удельные), которое зависит от свойств газа
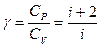 (10.19)
(10.19)
Из формул (10.15) и (10.17) следует, что теплоемкости не зависят от температуры, а определяются лишь числом степеней свободы составляющих вещество молекул. Это утверждение справедливо только для одноатомных газов. Для двухатомных наблюдается расхождение между теорией и экспериментальными данными. На рис.9.3 представлена экспериментальная кривая зависимости СV от Т для молекул водорода. Разным температурам соответствует свое значение теплоемкости.

Рис.10.3
Классическая теория теплоемкости не достаточна для объяснения CV(T) в широком диапазоне температур. Объяснение такого поведения теплоемкости дает квантовая механика.
Дата добавления: 2019-12-09; просмотров: 351;










