Качественное и количественное
 |  |
Качественные Количественные
 |  |  | |||
цветные осаждения Без минерализации с минера-




 лизацией
лизацией
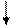
метод Биуретовый методы, методы метод Лоури метод основанные УФ- Къельдаля
на связывании спектро-
красителей скопии
Рисунок 1 – Методы определения белка
Для наблюдения реакции в пробирки наливают по 1-2см3 белка с равным количеством 4 % раствора щёлочи и добавляют 1-2 капли 0,5% раствора медного купороса.
Реакцию дают все белки, а так же продукты их гидролиза -пептоны и пептиды, начиная с тетрапептидов.
Другой качественной реакцией на белки, содержащие α – аминокислоты является нингидриновая реакция. Нингидрин в концентрации 0,1 % реагирует с равным объёмом раствора белка NН2- группами, содержащимися в α – положении при нагревании с последующим охлаждением придаёт системам синее окрашивание.
Существуют также частные реакции на белки, связанные с присутствием фенольных и гетероциклических групп.
Во второй группе реакций белки осаждают действием солей, органических растворителей, концентрированных кислот, щелочей, ионов тяжёлых металлов, температуры и в изоэлектрической точке. Белки в растворённом состоянии крайне неустойчивы, поэтому при добавлении органических растворителей (спирт, ацетон), концентрированных растворов нейтральных солей щелочных металлов и воздействий физических факторов (нагревание, облучение, ультразвук) гидратная оболочка разрушается и они выпадают в осадок.
Так как белковые вещества сырья (муки, крупы, молока, мяса), включая ферменты, часто являются определяющими в обеспечении качества пищевых изделий, то для изучения физико-химических, биохимических и физиологических свойств этих соединений обязательным условием является получение белков в индивидуальном и, по возможности, неденатурированном состоянии. Белки обычно теряют природные (нативные) свойства (растворимость, гидратацию, ферментативную активность и т.д.), подвергаясь денатурации под влиянием различных факторов.
Наиболее распространённым количественными методами являются метод Кьельдаля, Лоури с реактивом Фолина, Войвуда в модификации Т.А. Глагоревой, К.А. Мерка.
Содержание белка в пищевых объектах обычно определяют по количеству азота с использованием метода Кьельдаля. С целью упрощения и сокращения длительности анализа этот метод с момента его разработки (1983) неоднократно модифицировался с применением различных катализаторов и условий минерализации. На основе модифицированных методов созданы высокопроизводительные автоматические анализаторы типа «Кьельфос», стоимость определения содержания белка на которых и сегодня остаётся высокой.
Метод основан на минерализации навесок при нагревании с концентрированной серной кислотой в присутствии катализаторов. Аммиак отгоняют в раствор борной кислоты и оттитровывают его 0,1н. раствором серной кислоты. Объём кислоты, пошедший на титрование, умножают на титр по азоту и узнают содержание азота в пробе.
Химическая реакция аммиака с борной кислотой идёт с образованием метаборной кислоты из ортоборной (Н3ВО3 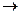 НВО2 + Н2О). Сама борная кислота очень слабая и не оказывает влияния на концентрацию ионов водорода. Реакция идёт следующим образом: NH3 + HBO2 = NH4+ + BO2-. Полученный в результате анион ВО2- оттитровывают раствором кислоты; при этом происходит восстановление протона в боррат-анион (основание): Н+ + ВО2- = НВО2. Анион ВО2 является сильным основанием и, следовательно, его можно титровать сильной кислотой.
НВО2 + Н2О). Сама борная кислота очень слабая и не оказывает влияния на концентрацию ионов водорода. Реакция идёт следующим образом: NH3 + HBO2 = NH4+ + BO2-. Полученный в результате анион ВО2- оттитровывают раствором кислоты; при этом происходит восстановление протона в боррат-анион (основание): Н+ + ВО2- = НВО2. Анион ВО2 является сильным основанием и, следовательно, его можно титровать сильной кислотой.
Существует и некоторая условность в методе Кьельдаля при расчёте количества белка, заключающаяся в использовании переводного коэффициента. Однако, несмотря на недостатки, метод Кьельдаля является унифицированным, он включён в ГОСТы на многие пищевые продукты.
Для перевода количества азота в содержание белка используют коэффициент 6,25. Принят он потому, что большинство белков содержит 16 % азота (100:6,25 = 16). Однако более правильным является использование коэффициентов, соответствующих фактическому содержанию сырого белка в каждом его виде. Так, для пшеницы получен коэффициент 5,7, так как её белки содержат 17,5 % азота. Для других белковых ресурсов коэффициенты перевода приняты следующими: 5,7 – рожь, ячмень, овёс, семена подсолнечника; 5,8 – соя; 6,25 – кукуруза, мясо; 6,38 – молоко.
Колориметрический метод определения белка (Метод Лоури) основан на реакции белков с реактивом Фолина, дающей синее окрашивание. Интенсивность окраски определяют на фотоэлектроколориметре с красным светофильтром (или на спектрофотометре при длине волны 750 нм). Количество белка в растворе находят по калибровочной кривой. Метод применяют для определения белка в растворах с концентрацией от 10 до 100мкг.
В основе биуретового метода лежит биуретовая реакция. По оптической плотности с использованием калибровочных графиков находят концентрацию белка в растворах. Этот метод определения белка требует для выполнения доступных реактивов и используется для определения белков в растворах, в том числе предназначенных для электрофореза.
Имеются различные методы определения азота, такие как метод Дюма, нейтронно-активационный и с фенолятгипохлоридом на приборе «Техникон». Принцип метода Дюма заключается в разложении органического соединения в атмосфере оксида углерода до газообразного состояния с последующим измерением объёма азота (N2). В нейтронно-активационном методе атомы азота образца бомбардируются нейтронами в ядерном реакторе с получением изотопа 13N. Содержание белка рассчитывают по количеству гамма-лучей.
Широкое распространение получил метод инфракрасной спектроскопии, в основе которого лежит поглощение белками света с определённой длиной волны и измерение интенсивности его отражения в пробах анализаторах. Приборы калибруют по образцам зерна (эталонам) с известным содержанием белка, определяемым по методу Кьельдаля.
Известны методы количественного определения белка, основанные на различной степени помутнения (нефелометрический метод), способности белков адсорбировать красители (кумасси синий R-250, амидочёрный и др.) и преломлять лучи света (по показателю преломления). Они характеризуются высокой точностью и простотой определения, хотя имеют ряд ограничений. Наиболее удобными являются методы с кумасси синим, биуретовый и Лоури.
Массовую долю белка определяют также колориметрическим методом, который основан на способности белков при рН ниже изоэлектрической точки связывать кислые красители вследствие образования нерастворимого комплекса. При этом интенсивность окраски раствора уменьшается обратно пропорционально количеству белка. После удаления нерастворимого комплекса измеряют оптическую плотность раствора оставшегося красителя и по градуировочному графику определяют массовую долю белка.
Определение массовой доли белков методом формольного титрования. Этот метод применяют для контроля массовой доли белка в молоке кислотностью не более 22оС. Он основан на реакции щелочных аминогрупп белка с формалином, в результате которой высвобождаются карбоксильные кислые группы белка. При этом повышается титруемая кислотность молока. По приросту которой определяют массовую долю белка в молоке.
Для определения массовой доли белка в молоке применяют также рефрактометрический метод. Он основан на изменении показателей преломления молока и безбелковой молочной сыворотки, полученной из того же образца молока, разность между которыми пропорциональна массовой доле белка в молоке.
При изучении физико-химических свойств белков и их превращении в пищевых системах широко используют методы фракционирования и очистки от небелковых соединений. Они основаны на различии таких свойств белков, как размер молекул, растворимость заряд и сродство к специфическим химическим группам.
Общая схема операций по выделению белков сводится к измельчению биологического материала (гомогенизации), экстрагирования и собственно выделению, то есть очистки и получению белка в индивидуальном состоянии.
Осаждение белков из раствора под действием солей щелочных и щелочноземельных металлов называют высаливанием. Для высаливания чаще применяются сульфат аммония, под влиянием которого белки, как правило, сохраняют растворимость и ферментативную активность.
Глобулины выпадают в осадок при 50 % насыщении, альбумины при 100 % насыщении растворов солей, а при ступенчатом фракционировании (20-100 % насыщения) выпадают белки и других классов (проламины, глютелины).
В практике выделения и очистки белков используются различные типы хроматографии: адсорбционная, распределительная, ионообменная и хроматография по сродству.
Адсорбционнная хроматография основана на различиях в полярности белков. В колонке вместе с буферным раствором упаковывают адсорбент, на который в небольшом объёме растворителя наносят исследуемый образец. Компоненты разделяемой смеси адсорбируются, затем элюируются с помощью буферного раствора с увеличивающейся концентрацией или полярностью. Фракции белка собирают с помощью автоматического коллектора фракций.
В распределительной хроматографии, в отличие от адсорбционной, в качестве неподвижной фазы выступает водный слой, удерживаемый твёрдой фазой (силикагель, бумага). Разделяемые вещества многократно распределяются между водным слоем и движущейся фазой растворителя и с разной скоростью перемещаются по длине колонки или бумаге. Распределительную хроматографию на бумаге часто используют для анализа пептидов и аминокислот. Адсорбентом служат нити целлюлозы, а растворителем – смесь органических растворителей, например: бутиловый спирт – уксусная кислота – вода. Хроматограмму проявляют, высушивают и анализируют местонахождение разделяемых компонентов тем или иным способом.
Методом ионообменной хроматографии белки или аминокислоты разделяют на основе различий в общем заряде молекул. Если белок в нейтральной среде (рН 7) имеет положительный заряд, то он связывается на колонке с ионообменником, содержащим фенольные, сульфо- и карбоксильные группы (катионообменник). Чаще всего для фракционирования белков используют производные полистерола и целлюлозы.
Положительно заряженный белок снимается с колонки с помощью раствора хлористого натрия или изменением рН элюирующего буфера. При этом ионы натрия конкурируют с положительно заряженными группами белков. Белки с меньшим положительным зарядом вымываются с колонки первыми, с большим зарядом – последними.
Хроматография по сродству (аффинная хроматография) основана на принципе избирательного связывания белков со специфическими веществами (лигандами) прикреплёнными к носителю. Лиганды (глюкозу) ковалентно присоединяют к носителю (проводя иммобилизацию) и наносят на колонку исследуемую белковую смесь. Несвязавшиеся белки удаляют соответствующим буфером, а нужный белок элюируют раствором, содержащим лиганд в очень высокой концентрации. При этом присоединённые к колонке остатки глюкозы в молекуле белка замещаются на глюкозу, находящуюся в растворе.
Гель-фильтрация, или метод молекулярных сит заключается в пропускании белков через колонку с гелем сефадекса или других типов (агарозных, полистирольных). Применяются также пористые стеклянные шарики и пористый кварц (порасил).
Принцип методов электрофоретического разделения заключается в способности молекул пептидов и аминокислот, находясь в заряженной форме в виде катионов (+) или анионов (-), передвигаться в электрическом поле с определённой скоростью.
Очень высокую разрешающую способность имеет метод изоэлектрического фокусирования белков, в основе которого лежит фронтальный электрофорез, проводимый на колонке одновременно в градиенте рН и напряжения.
В организме синтезируется только часть аминокислот, другие должны доставляться с пищей. Первые из них называются заменимыми, вторые незаменимыми. Заменимые аминокислоты способны заменять одна другую в рационе, так как они превращаются одна в другую или синтезируются из промежуточных продуктов углеводного или липидного обмена.
Жизнедеятельность человека обеспечивается ежедневным потреблением с пищей сбалансированной смеси, содержащей восемь незаменимых аминокислот и две частичнозаменимые. Незаменимые представлены аминокислотами с разветвлённой цепью углерода – лейцином, изолейцином и валином, ароматическими – фенилаланином, триптофаном и алифатическими – треонином, лизином и метионином. К частичнозаменимым относят аргинин и гистидин, так как в организме они синтезируются довольно медленно.
Важным понятием, характеризующим качество поступающего в организм белка, является биологическая ценность, то есть наличие незаменимых аминокислот и степень их усвоения. Чем ближе потребляемый белок по аминокислотному составу подходит к составу белков организма, тем выше его биологическая ценность.
Изучение химического состава пищевых продуктов, закономерностей метаболических превращений в организме каждого из многочисленных белковых веществ, входящих в состав продукта, выявление их участия в жизнедеятельности, а также интегрального биологического эффекта, привело к возникновению научных представлений о биологической ценности, под которой понимают относительную степень задержки азота пищи или эффективность его утилизации для поддержания азотистого равновесия, зависящая от аминокислотного состава и других структурных особенностей белков. Таким образом, термин «биологическая ценность» отражает качество белковых компонентов продукта, связанных как с перевариванием белка, так и со степенью сбалансированности его состава. Биологическая ценность может быть определена химическими и биологическими методами (например, с использованием тест-организмов).
Основываясь на понятии биологической ценности как степени соответствия состава пищи физиологическим потребностям организма, разработаны некоторые принципы биологической оценки качества продуктов питания.
Большинство исследований пришло к единому мнению, что биологическую ценность белков, независимо от использованного варианта проведения эксперимента или метода её расчёта необходимо выражать не в абсолютных, а в относительных величинах (в процентах) то есть в сравнении с аналогичными показателями, полученными с применением стандартных белков.
Химические методы исследования биологической ценности белков разрабатывались на основании результатов изучения состава белков в пищевых продуктах и установленной связи между степенью задержки азота, пищевого белка в живом организме и наличием в нём незаменимых аминокислот.
Наиболее широко используется метод Х. Митчела и Р. Блока, в соответствии с которым рассчитывается показатель аминокислотного скора (а.с.). Скор выражают в процентах или безразмерной величиной, представляющей собой отношение содержания аминокислот (а.к.) в исследуемом белке к её количеству в эталонном белке. При расчёте скора формула выглядит следующим образом:
Аминокислотный скор = 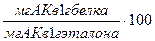 , (3.8)
, (3.8)
Аминокислота, скор который имеет самое низкое значение, называется лимитирующей аминокислотой.
Таблица 3.1 Содержание аминокислот в 1 г идеального белка
| Аминокислота | Содержание, мг | Аминокислота | Содержание, мг |
| Изолейцин | Фенилаланин+тирозин | ||
| Лейцин | Треонин | ||
| Метионини + цистин | Триптофан | ||
| Валин | Всего |
Другой метод определения биологической ценности белков заключается в определении индекса незаменимых аминокислот (ИНАК). Метод представляет собой модификацию метода аминокислотного скора и позволяет учитывать количество всех незаменимых кислот. Индекс рассчитывают по формуле:
ИНАК = 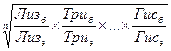 , (3.9)
, (3.9)
где n – число аминокислот;
индексы б, э – содержание аминокислоты в изучаемом и эталоном белке соответственно.
Известны и другие химические методы, которые основаны на исследовании аминокислотного состава белка с последующим расчётом индексов биологической ценности (индексы Озера, Митчела, Корпачи).
Вышеперечисленные методы индексов и скора по стандарту, не позволяют учитывать одну из важнейших характеристик биологической ценности белка, а именно, доступность усвоения в организме аминокислот, входящих в его состав. Например, количество доступного лизина является в настоящее время наиболее ценным показателем «технологического» снижения биологической ценности белков. В литературе описаны различные способы определения доступного лизина в белковых продуктах: химические, биологические и микробиологические.
Особый интерес вызывают у исследователей такие методы определения биологической ценности белков, в которых в какой либо степени имитируются условия пищеварения в организме человека. Метод ферментативного переваривания белков протеолитическими ферментами желудочно-кишечного тракта применяется для изучения скорости расщепления белков, находящихся в составе различных пищевых продуктов.
Для изучения биологической ценности белков наибольшее применение получили биологические методы исследования, результаты которых служат основой для сравнения с данными, полученными при использовании химических методов.
Биологические методы основаны на скармливании изучаемого белка живому организму с последующим выявлением его реакции. Основными показателями оценки при этом являются привес (рост животных) за определённый период времени, расход белка и энергии на единицу привеса, коэффициенты перевариваемости и отложения азота в теле, доступность аминокислот. Биологические методы исследования биологической ценности белков можно классифицировать на росто-весовые и балансовые. Эти методы широко используют для определения различных индексов биологической ценности белков.
Росто-весовые методы основаны на учёте прибавки веса тела на единицу потреблённого белка за определённое время.
Наибольшее распространение получили, разработанные П.Осборном, методы определения коэффициента эффективности белка (КЭБ или PER), которым определяют прибавку веса тела на один грамм потреблённого белка за экспериментальный период. Для сравнения при определении показателя используют контрольную группу животных со стандартным белком – казеином. В количестве, обеспечивающем в рационе 10% белка. Методика определения КЭБ признана оригинальной в ряде стран (США, Канада).
Балансовые методы исследования биологической ценности белка основаны на определении различных реакций организма на потребляемый белок. Методы определения биологической ценности белков, основанные на данных балансовых исследований, считают наиболее точными из всех предложенных.
Липиды
Липидами (от греч. lipos – жир) называют сложную смесь органических соединений с близкими физико-химическими свойствами, которая содержится в растениях, животных и микроорганизмах. Липиды широко распространены в природе и вместе с белками и углеводами составляют основную массу органических веществ всех живых организмов, являясь обязательным компонентом каждой клетки. Они широко используются при получении многих продуктов питания, являются важными компонентами пищевого сырья, полуфабрикатов и готовых пищевых продуктов, во многом определяя их пищевую и биологическую полноценность и вкусовые качества.
Липиды не растворимы в воде (гидрофобны), хорошо растворимы в органических растворителях (бензине, диэтиловом эфире, хлороформе и др.).
В растениях липиды накапливаются главным образом, в семенах и плодах. Ниже приведено содержание липидов (%) в разных культурах: арахис (ядро) – 50-68; какао (бобы) – 49-57; подсолнечник – 30-58; соя (семена) – 15-25; кукуруза – 5,6; гречиха – 3,8; рис – 2,9; пшеница – 2,7.
У животных и рыб липиды концентрируются в подкожных, мозговой и нервных тканях и тканях, окружающих важные органы (сердце, почки). Содержание липидов в тушке рыбы (осетров) можно достигать 20-25 %, сельди – 10 %, у туш наземных животных оно сильно колеблется: 33 % (свинина), 9,8 % (говядина), 3,0 % (поросята). В молоке оленя – 17-18 %, козы – 5,0 %, коровы – 3,5-4,0 %. Содержание липидов в отдельных видах микроорганизмов может достигать 60 %.
По химическому строению липиды являются производными жирных кислот, спиртов, альдегидов, построенных с помощью сложноэфирной, простой эфирной, фосфоэфирной, гликозидной связей. Липиды делят на две основные группы: простые и сложные липиды. К простым нейтральным липидам (не содержащим атомов азота, фосфора, серы) относят производные высших жирных кислот и спиртов, глицериды, воски, эфиры холестерина, гликопептиды и другие соединения. Молекулы сложных липидов содержат в своём составе не только остатки высокомолекулярных карбоновых кислот, но и фосфорную или серную кислоты.
В определении содержания жира в сырье и готовой продукции чаще всего используют методы, приведённые ниже.
Метод Гербера используют при определении жира в полуфабрикатах из мяса (мясной фарш, полуфабрикаты из котлетной массы), творога, в кулинарных изделиях, мучных кондитерских изделиях, молока и молочных продуктах, сухих продуктах детского и диетического питания.
Метод основан на разрушении белков исследуемого продукта концентрированной серной кислотой и растворении жира в изоамиловом спирте. Образующийся в реакции изоамилового спирта с серной кислотой сложный эфир растворяется в ней, что способствует выделению жира. Полученную смесь центрифугируют в жиромерах (бутиролитрах). Отделившийся жировой слой собирается в градуированной части жиромера и отсчитывается там.
Определение жира проводят в молочных или сливочных жиромерах, отличающихся размером и градуировкой. Объём деления в молочных жиромерах равен 0,1 % или 0,011332 жира в продукте. В сливочных жиромерах объём двух делений соответствует 1 % жира в продукте пр навеске 5 г. Их используют, если содержание жира в продукте превышает 10 %.
Весовой метод с экстракцией жира в микроизмельчителе. Метод используется для кулинарных изделий и некоторой продукции консервной промышленности. Жир извлекают из продукта при измельчении последнего в микроизмельчителе. После отгона растворителя высушенный жир взвешивают.
Рефрактометрический метод применяют для определения жира в мучных кулинарных, сдобных булочных и мучных кондитерских полуфабрикатах и изделиях, овощных полуфабрикатах, консервированных продуктах.
Метод основан на том, что при растворении жира коэффициент преломления растворителя понижается пропорционально количеству присутствующего жира. По разности между коэффициентом преломления чистого растворителя и раствора жира определяют массовую долю последнего. Чем больше разница между этими коэффициентами, тем точнее определение.
Метод определения жира с предварительным гидролизом крахмала используют при определении жира в полуфабрикатах из муки, булочных и мучных кондитерских изделиях (ГОСТ 5899-85). Он основан на извлечении жира растворителем из навески, обработанной предварительно соляной кислотой, удалении растворителя и взвешивании жира.
Для качественного определения масел существуют следующие характерные реакции.
Проба на акролеин. Две-три капли испытуемого вещества (масло, экстракт после отгонки растворителя) нагревают в пробирке на голом огне с 1,5-2 частями безводного сернокислого натрия. Появление после вспенивания тяжелых белых паров и резкий запах акролеина (чада), вызывающего слезоточение, указывают на наличие масла. Акролеин – непредельный альдегид СН2=СНСНО – образуется из глицерина при отнятии двух молекул воды. Если пары отвести в пробирку с фуксиносернистой кислотой, то последняя приобретает красную окраску.
Проба на омыление. Нагревают 2-3 капли испытуемого вещества в пробирке с 5 см3 раствора спиртовой щелочи; отгоняют спирт. Оставшийся продукт растворяют в воде (мыло в воде растворимо). Прибавление кислоты до кислой реакции вызывает образование всплывающих на поверхность водного раствора жирных кислот.
Проба с галоидами. Эта реакция является характерной для масел, содержащих непредельные жирные кислоты. В пробирку с раствором масла в эфире прибавляют 1-2 капли бромной воды и встряхивают. Быстрое исчезновение желтой окраски бромной воды указывает на присутствие ненасыщенных кислот.
Углеводы
Согласно принятой в настоящее время классификации углеводы подразделяются на три основные группы: моносахариды, олигисахариды и полисахариды.
Углеводы широко распространены в природе, они встречаются в свободной и связанной форме в любой растительной, животной или бактериальной клетке. Углеводы составляют три четверти биологического мира и примерно 60-80 % калорийности пищевого рациона.
Наиболее распространённый углевод – целлюлоза, структурный компонент деревьев и других растений. Главный пищевой ингредиент – крахмал. Моносахариды встречаются в свободном виде в природе в небольших количествах, в основном они присутствуют как структурные единицы полисахаридов, входят в дисахариды и олигосахариды.
Среди моносахаридов широко известными являются глюкоза, фруктоза, галактоза, арабиноза, ксилоза и D – рибоза.
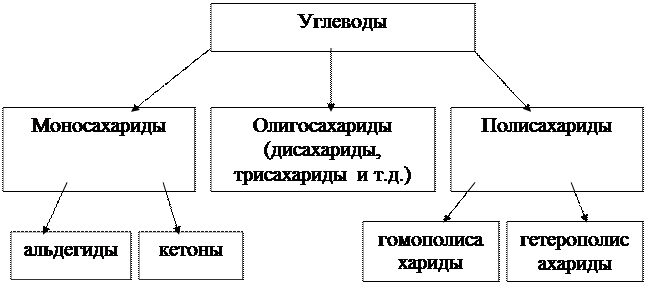
Рисунок 3.2 – Принципиальная классификация углеводов
Глюкоза (виноградный сахар) в свободном виде содержится в ягодах и фруктах (в винограде до 8 %; в сливе, черешне 5-6 %, в мёде 36 %).
Фруктоза (плодовый сахар) содержится в чистом виде в пчелином мёде (до 37 %), винограде (7,7 %), яблоках (5,5 %).
Галактоза - составная часть молочного сахара (лактозы), которая содержится в молоке млекопитающих, растительных тканях и семенах.
Дисахариды – сложные сахара, каждая молекула которых при гидролизе распадается на две молекулы моносахаридов. Среди дисахаридов особенно широко известны мальтоза, сахароза и лактоза.
Пектиновые вещества, содержащиеся в растительных соках и плодах, представляют собой гетерополисахариды, построенные из остатков галактуроновой кислоты. Пектиновые вещества составляют основу гелей.
Для определения моно- и олигосахаридов используют их восстанавливающую способность. Сначала их извлекают из пищевых продуктов 80 %-м этиловым спиртом. Спиртовые экстракты упаривают под вакуумом, разбавляют горячей водой и фильтруют. При анализе продуктов, относительно богатых белками и фенольными соединениями, фильтрат дополнительно обрабатывают нейтральным раствором ацетата свинца, избыток которого удаляют сульфатом, фосфатом или оксалатом натрия. Осадок отфильтровывают, а в фильтрате определяют восстанавливающие (редуцирующие) сахара с использованием гесацианоферрата (III) калия, фелинговой жидкости или йодометрически. Для определения сахарозы (вместе с редуцирующими сахарами) её необходимо предварительно гидролизовать.
Качественный и количественный анализ отдельных сахаров проводят методами газо-жидкостной, ионообменной или высокого разрешения жидкостной хроматографией.
Определение крахмала основано, как правило, на определении полученной при гидролизе глюкозы химическими методами или на способности полученных растворов вращать плоскость поляризации. Для определения крахмала необходимо предварительно освободиться от моно- и олигосахаридов экстракцией 80 %-ным этанолом. Затем проводят извлечение крахмала из продукта каким-либо способом (например, растворением сначала в холодной, потом в горячей воде) и освобождаются от белков путём обработки раствора фосфорно-вольфрамовой кислоты, ацетатом цинка, гексацианоферратом (III) калия или другими белковыми осадителями. Определение крахмала проводят, как правило, путём определения глюкозы после ферметативного или кислотного гидролиза. Для расчёта используют соответствующие коэффициенты. Можно применять метод поляриметрии.
Для определения декстринов их извлекают (40оС) водой и осаждают 96 %-м этанолом, проводят гидролиз и определяют глюкозу. Для расчёта используют соответствующие коэффициенты. Можно использовать метод спектрофотометрии, измеряя интенсивность окраски йодокрахмального комплекса.
Общее содержание пищевых волокон (лигнин + неусваиваемые углеводы) обычно определяют гравиметрическим методом. Анализ заключается в использовании фракционирования – сначала растворяют крахмал и белки при помощи ферментов, имитирующих расщепление их в желудочно-кишечном тракте человека (α – амилаза, пепсин, панкреатин), растворимые пищевые волокна осаждают спиртом, фильтруют, осадок взвешивают.
Определение пектина основано на извлечении пектина (растворимого пектина и протопектина) из пищевого продукта, осаждении и взвешивании. Для извлечения растворимого пектина применяют экстракцию холодной водой с последующим кипячением. Для извлечения протопектина применяют кипячение с соляной кислотой после извлечения растворимого пектина. Для продуктов, богатых крахмалом, применяют специальные приёмы его отделения. Для осаждения пектина проводят реакцию с хлоридом кальция. Помимо взвешивания можно определять в осадке содержание кальция комплексонометрически с трилоном Б и по этим данным рассчитывать содержание пектина.
Гемицеллюлозы гидролизуются труднее, чем пектин, их определяют после удаления пектинов. Определение гемицеллюлоз основано на определении восстанавливающих сахаров, полученных при кислотном или щелочном гидролизе. Для расчёта используются соответствующие коэффициенты.
Метод определения клетчатки основан на проведении гидролиза легкорастворимых углеводов при соответствующих условиях и получении негидролизуемого остатка, который взвешивают.
Ниже описанные методы определения сахаров, наиболее часто используемые при исследовании сырья и готовой продукции.
Перманганатный метод Бертрана. Этот метод основан на окислении сахаров реактивами, в состав которых медь входит в виде растворимого комплексного соединения. Оно образуется при смешивании равных объёмов раствора серно-кислой меди (Фелинг №1) и щелочного раствора калия-натрия винно-кислого (Фелинг №2). При нагревании жидкость Фелинга окисляет редуцирующие сахара, в результате чего окись меди восстанавливается до закиси. Закись меди растворяют кислым раствором железоаммонийных квасцов или серно-кислого окисного железа, при этом закись меди восстанавливает серно-кислое окисное железо в серно-кислое закисное железо, которое оттитровывают раствором марганцово-кислого натрия. По объёму марганцово-кислого калия рассчитывают количество восстановленной меди, а затем, пользуясь специальными таблицами, находят количество сахара.
Цианидный метод. Данный метод применяют для определения количества хлеба в рубленных полуфабрикатах из мяса (птицы, рыбы); риса в фаршах; муки и манной крупы в творожных изделиях; сахарозы в сладких и вторых блюдах, напитках, лактозы в молочных продуктах.
Метод основан на способности редуцирующих сахаров восстанавливать в щелочном растворе железосинеродистый калий в железисто-синеродистый.
Окончание процесса окисления редуцирущих сахаров определяют по индикатору, в качестве которого используют метиленовый голубой. В конце реакции он восстанавливается сахарами в бесцветное лейкооснование. Метод можно использовать при концентрации сахаров не менее 0,2 % и не более 2 %.
Рефрактометрический метод. Этим методом контролируют содержание сахара в напитках (чае, кофе с сахаром, кофе и какао с молоком), сладких блюдах (киселях, плодово-ягодных, молочных, муссах плодово-ягодных, желе, самбуках), в бисквите и песочных лепёшках, в некоторых кремах. Принцип метода описан ранее.
Для определения сахарозы фруктозы и других кетосахаров в растительных продуктах и сырье используют метод Мак-Рери и Слаттери (1960), основанный на способности кетосахаров давать окраску с резоцином в кислой среде.
Количественное определение большинства высокомолекулярных углеводов основано на свойстве их гидролизоваться при кипячении с разбавленными (крахмал, гемицеллюлозы) или концентрированными (целлюлоза) минеральными кислотами до конечного продукта – простых сахаров и на учете последних. Многие углеводы обладают оптической активностью, и это свойство также используется для количественного их определения (крахмал). Очень часто применяются поляриметрические методы с использованием поляриметров различной конструкции. Принцип метода состоит в гидролизе крахмала и определении в гидролизате угла вращения.
Количественное определение пектиновых веществ основано на их свойстве давать окраску с карбазолом. Среди таких методов широко применяют карбазольный метод, который основан на появлении специфического фиолетово-розового окрашивания в результате взаимодействия уроновых кислот с карбазолом в сернокислой среде. При этом образуется 5-карбоксифурфурол, обладающий максимумом поглощения при 535 нм.
Количественное определение каждой из групп полисахаридов затрудняется их растворимостью. Поэтому существует много схем последовательного определения полисахаридов, но ни одну из них нельзя рассматривать как достаточно точную. В большинстве их предварительным кипячением с водой спиртонерастворимого остатка извлекают пектиновые вещества, затем, применяя растворы щелочи различной концентрации, извлекают гемицеллюлозы, затем серной кислотой (также различной концентрации) определяют целлюлозу. В некоторых схемах вместо щелочи для определения гемицеллюлоз применяют обработку разбавленной (2-3%-й) кислотой.
Определение целлюлозы проводят по методу Кюршнера и Ганека. Этот метод основан на окислении, разрушении и растворении различных химических соединений, входящих в состав продуктов, смесью уксусной и азотной кислот. При этом целлюлоза (клетчатка) практически не растворяется, отфильтровывается и взвешивается.
Для качественного обнаружения различных углеводов используют некоторые характерные для них реакции. В продуктах в свободном состоянии присутствуют различные сахара – моносахариды и олигосахариды. Благодаря введению в лабораторную практику метода распределительной хроматографии на бумаге удается легко и сравнительно быстро разделить сложную смесь сахаров на индивидуальные сахара и идентифицировать их.
Для определения моносахаридного состава используется газохроматическое разделение данных смесей на летучие производные.
Для качественного определения крахмала используют очень чувствительную реакцию крахмала с йодом (синее окрашивание), применяемую, например, в качестве контроля на полноту гидролиза. Для обнаружения целлюлозы применяют раствор йода в растворах хлористого цинка и йодистого калия (синее окрашивание), для пектина – окраску с рутением красным или после гидролиза – окраску галактуроновой кислоты карбазолом.
В отдельных случаях требуется получить и другую характеристику полисахаридов, например, опре
Дата добавления: 2018-05-10; просмотров: 1260;











