Строение вещества. Виды химических связей
Все вещества состоят из атомов.
Атом представляет собой систему, состоящую из положительно заряженного ядра, вокруг которого вращаются отрицательно заряженные электроны. Электроны притягиваются к ядру и отталкиваются друг от друга. Расположенные ближе к ядру электроны подвержены большему притяжению, они ослабляют притяжение внешних электронов, которые находятся на большем расстоянии от ядра. Внешние электроны могут отрываться от одного атома и присоединяться к другому атому, изменяя число его внешних электронов. Такие электроны называются валентными. У разных веществ атомы содержат разное число валентных электронов.
Атом, потерявший один или несколько электронов, становится положительно заряженным. Атом, который присоединил к себе свободные электроны, становится отрицательно заряженным. Образовавшиеся таким образом положительные и отрицательные частицы называются ионами.
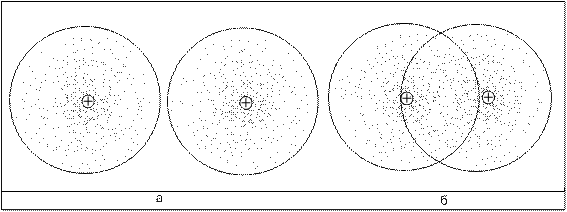
Рис. 1. Ковалентная (атомная) связь в молекуле водорода:
а - изолированные атомы; б - молекула с ковалентной связью
Из атомов строятся молекулы. Связи, благодаря которым происходит объединение атомов в молекулы, называются химичсскими.
Способность атомов вступать в соединения с атомами других веществ и образовывать молекулы определяет химические свойства вещества.
Молекула является наименьшей частицей вещества, которая сохраняет его химические свойства.
Химические связи между атомами вещества делят на ковалентные (атомные), ионные, металлические и молекулярные.
1) Ковалентная
Ковалентные связи возникают между атомами за счет образования устойчивых пар валентных электронов разныхчатомов (рис. 1).
Эти пары являются общими для атомов, которые входят в молекулу. Если двухатомная молекула состоит из атомов одного элемента (Н2, Сl2, N2), то электронная пара в одинаковой степени принадлежит обоим атомам. В таком случае молекулу и ковалентную связь называют неполярными и (или) нейтральными. В неполярных молекулах центры положительных и отрицательных зарядов совпадают.
Если двухатомная молекула состоит из атомов различных элементов, то электронная пара может быть смещена к одному из атомов. В этом случае ковалентную связь называют полярной, а молекулы с полярной связью, у которых центры положительных зарядов не совпадают, - полярными или дипольными. Дипольная молекула характеризуется электрическим дипольным моментом
μ=q·l
где q - абсолютное значение заряда, Кл; l – расстояние между центрами положительного и отрицательного зарядов, м.
Если у многоатомных молекул заряды расположены симметрично, то они неполярны, при несимметричном расположении атомов молекулы полярны (рис. 2).
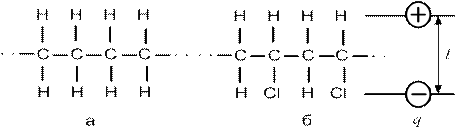
Рис. 2. Схемы неполярной молекулы полиэтилена ( 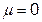 ) (а) и полярной молекулы поливинилхлорида (б): q - абсолютное значение заряда; l - расстояние между центрами положительного и отрицательного зарядов
) (а) и полярной молекулы поливинилхлорида (б): q - абсолютное значение заряда; l - расстояние между центрами положительного и отрицательного зарядов
Атомная связь имеет направленный характер. Эта связь образуется в направлении наибольшей плотности объединенных электронов. Поэтому вещества с ковалентными связями обычно характеризуются твердостью, хрупкостью, тугоплавкостью и химической инертностью. К ним относятся кристаллы германия, кремния, алмаза, соединения элементов из средних групп таблицы Д.И.Менделеева - SiC, BN. Атомные связи характерны для таких газов, как Н2,О2, N2. Молекулы некоторых органических соединений: полиэтилена (С2Н4)n, политетрафторэтилена (C2F4)n - имеют ковалентную связь, при этом между отдельными молекулами в этих материалах образуются молекулярные связи.
Разновидностью ковалентной связи является донорно-акцепторная связь, которая возникает между атомом, способным отдать электрон (донор), и атомом, способным принять этот электрон (акцептор). Примером таких материалов являются соединения мышьяка -арсениды галлия GaAs и индия InAs.
2) Ионная
Ионные связи обусловлены силами электростатического притяжения между положительными и отрицательными ионами.
Молекулы вещества с полярной связью полярны. Не имеют направленности. Соединения с ионной связью обладают разными свойствами, которые характерны для типичных металлов и неметаллов. Такие связи наиболее характерны для неорганических диэлектриков, которые имеют в своем составе ионы противоположных знаков (большинство солей и некоторые оксиды, например, ZnO, CdO, NiO, CuO2).
Ионные связи менее прочны, чем ковалентные, поэтому соединения, образованные ионной связью, уступают веществам с ковалентной связью по механической прочности и химической стойкости.
3) Металлическая
Металлические связи образуются в металлах и обусловлены особенностями поведения внешних (валентных) электронов. Атомы металлов обладают способностью отдавать внешние (валентные) электроны, превращаясь в положительный ион, или присоединять их вновь, превращаясь снова в нейтральный атом.
Внешние электроны, которые покидают атомы, становясь свободными, называются коллективизированными.
В результате металл представляет собой систему, состоящую из положительных ионов, которые находятся в среде коллективизированных электронов (рис.3.)
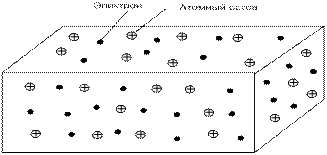
Рис. 3. Металл в представлении теории электронного газа
В этой системе одновременно имеют место притяжение между ионами и свободными электронами и ковалентная связь между нейтральными молекулами. Наличие этих связей определяет монолитность и прочность металлов.
Благодаря наличию свободных электронов металлы обладают высокой электро- и теплопроводностью. Металлическая связь в отличие от ковалентной не имеет направленного характера, что придает металлам высокую пластичность. Большинство металлов имеют высокие температуры плавления и кипения.
4) Молекулярная
Молекулярные связи образуются между отдельными молекулами в результате электростатического притяжения между зарядами противоположных знаков, которые имеются в молекулах. Такое электростатическое притяжение называют силами Ван-дер-Ваалъса. С помощью таких сил образуются молекулы в твердом водороде Н2, азоте N2, углекислом газе СО2 и других органических соединениях - полиэтилене, фторопласте и др.
Особым видом молекулярной связи является водородная связь, которая образуется через ион водорода (протон), расположенный между двумя ионами соседних молекул. Водородной связью соединяются молекулы воды и некоторых органических соединений.
В твердых веществах атомы и молекулы располагаются в строгом порядке и хаотично. Вещества с закономерным упорядоченным расположением атомов или молекул в пространстве называют кристаллическими, а вещества с беспорядочным расположением атомов или молекул - аморфными.
Дата добавления: 2021-11-16; просмотров: 540;











