Дискретность энергетических состояний атома. Постулаты Бора.
Линейчатый характер спектров излучения и поглощения атомов свидетельствует о том, что атом может излучать (поглощать) энергию не в любых количествах, а только вполне определенными порциями (квантами).
Исходя из представления о дискретности энергетических состояний атома Н.Бор в 1913 г. усовершенствовал атомную модель Резерфорда, создав квантовую теорию строения атома. В ее основу положены 3 постулата:
1. Электроны могут двигаться в атоме не по любым орбитам, а только по орбитам вполне определенного радиуса. На этих орбитах, называемых стационарными, момент количества движения электрона
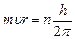 – условие квантования, (12)
– условие квантования, (12)
где m - масса электрона, 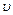 - его скорость, r - радиус орбиты, n - квантовое число (n=1, 2, 3, …)
- его скорость, r - радиус орбиты, n - квантовое число (n=1, 2, 3, …)
2. Движение электронов по стационарным орбитам не сопровождается излучением (поглощением) энергии.
3. Переход электрона с одной стационарной орбиты на другую сопровождается излучением (поглощением) кванта энергии. Величина 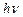 этого кванта равна разности энергий (W1 и W2) стационарных состояний атома до и после излучения (поглощения):
этого кванта равна разности энергий (W1 и W2) стационарных состояний атома до и после излучения (поглощения):
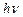 = W1-W2 – условие частоты (13)
= W1-W2 – условие частоты (13)
Т.о., частота э/м волн, излучаемых атомом, определяется не частотой вращения электронов в атоме, а разностью энергий стационарных состояний атома.
Постулаты Бора, сохранив в основном модель атома Резерфорда, вместе с тем освободили ее от упомянутых выше недостатков (противоречий опыту).
Дата добавления: 2017-11-21; просмотров: 1166;











