ОСНОВЫ ТЕХНИЧЕСКОЙ ТЕРМОДИНАМИКИ И ТЕОРИИ ТЕПЛОПЕРЕДАЧИ
3.1. ТЕХНИЧЕСКАЯ ТЕРМОДИНАМИКА
Термодинамика — это отрасль физики, изучающая законы преобразования энергии и процессы перехода ее из одних форм в другие. Техническая термодинамика имеет своим предметом технические приложения основных принципов термодинамики к процессам преобразования тепловой энергии в механическую работу или, наоборот, работы в тепловую энергию в так называемых тепловых машинах — двигателях, турбинах, компрессорах и т. д. Эта наука содержит теоретические основы работы тепловых машин и позволяет оценивать эффективность их рабочих процессов.
Рабочее тело и параметры его состояния. Работа тепловых машин осуществляется с использованием рабочих веществ — теплоносителей, которые называются рабочими телами. В качестве рабочих тел используются, как правило, вещества в газообразном (парообразном) состоянии. Газы и пары под воздействием внешних условий (температуры и давления) допускают значительные изменения своего объема и поэтому могут совершать при расширении или сжатии существенно большую работу, чем жидкие и твердые тела, которые практически несжимаемы.
Количество рабочего тела как количество вещества принято измерять в молях Моль - это количество вещества, число молекул (или атомов) которого равно количеству атомов в 0,012 кг (12 г) углерода - 12. В термодинамике обычно используется более крупная единица - киломоль (1 кмоль=10 м3 моль). Киломоль (килограмм-молекула)—это количество вещества, масса которого в килограммах численно равна его относительному молекулярному весу. С другой стороны, масса одного киломоля вещества называется молярной массой (кг/кмоль) этого вещества. Молярная масса водорода 2 кг/кмоль, кислорода 32 кг/кмоль и т. д.
Если рабочее тело будет находиться в среде, имеющей постоянные давление и температуру, то по истечении достаточного времени в рабочем теле по всему его объему установятся такие же по величине давление и температура. В дальнейшем состояние рабочего тела будет неизменным, пока не изменятся параметры внешней среды. Рабочее тело в этом случае находится в термодинамическом равновесии с окружающей его средой. При неравновесном состоянии параметры рабочего тела по объему неодинаковы и нельзя говорить в целом об его давлении и температуре.
Таким образом, физическое состояние рабочего тела в термодинамическом равновесии определяется тремя термодинамическими параметрами состояния: температурой, давлением и удельным объемом (или плотностью) . Необходимо отметить, что такими параметрами являются не просто температура и давление, а именно абсолютные их величины.
Абсолютная температура Т служит параметром теплового состояния тела, она измеряется в Кельвинах (К). Разность температур может выражаться в Кельвинах или в градусах Цельсия (1К=1°С). Абсолютное давление было определено в п. 2.1 [см. формулу (2.11)]. Там же было дано и понятие удельного объема [см. формулу (2.4)].
Зависимость типа f(p, u, Т) = 0, связывающая параметры состояния, называется в термодинамике уравнением состояния.
Идеальный газ. Реальные рабочие тела тепловых машин имеют сложный и часто переменный состав, что усложняет анализ их рабочих процессов. Для возможности изучения общих принципов поведения рабочих тел в различных процессах в физике введено понятие идеального газа. Идеальный газ в отличие от реальных характерен отсутствием сил взаимодействия между молекулами. Сами же молекулы считаются не занимающими объема.
Основные законы идеальных газов. Эти законы (или, как их иногда называют в физике, газовые законы) установлены трудами ряда крупных ученых и поэтому связаны с их именами. Еще во второй половине XVII века работы англичанина Роберта Бойля (1661 г.) и независимо от него проведенные более подробные исследования Эдма Мариотта (1676 г.) во Франции выяснили одну из важных закономерностей, присущих газам. Более чем через сто лет французы Жак Шарль (1787 г.), Жозеф Луи Гей-Люссак (1802 г.) и итальянец Амедео Авогадро (1802 г.) получили ряд важных результатов, которые сложились в систему газовых законов — простых аналитических выражений, определяющих свойства и поведение идеальных газов.
Напомним их вкратце, имея в виду, что часто поведение реальных газов (при сравнительно низких давлениях и достаточно высоких температурах) может определяться этими закономерностями идеального газа.
Закон Бойля — Мариотта. При неизменной температуре удельные объемы газа обратно пропорциональны его давлениям, или, иными словами, произведение давления на удельный объем есть величина для данного газа постоянная (при постоянной температуре). Таким образом, p1v1 = p2v2, или при T=const
pu = const. (3.1)
Закон Гей-Люссака. При постоянном давлении удельные объемы идеального газа прямо пропорциональны его абсолютным температурам: v1/v2 = T1/T2, или при p = const
v/T=const. (3.2)
Закон Шарля. При постоянном удельном объеме абсолютные давления идеального газа прямо пропорциональны его абсолютным температурам: р1/р2 = Ti/Т2, или при v = const
р/Т = const. (3.3)
Закон Авогадро. Все идеальные газы в единице объема при одинаковых давлениях и температурах содержат одинаковое число молекул.
Этот закон в отличие от предыдущих по существу является лишь гипотезой, т. е. предположением, ибо доказать его непосредственно нельзя - ведь невозможно пересчитать молекулы. Но целый ряд косвенных факторов дает этому закону убедительное подтверждение. Из закона Авогадро вытекает важное следствие: объем одного и того же количества вещества любого идеального газа (например, киломоля) должен быть одинаков, т. е. Vm = mv = const.
При нормальных условиях (tо = 0°С и ро = 0,1013МПа) Vmо = mvо = 22,4135м3/кмоль, или, приближенно, Vmо = 22,4 м3/кмоль. Отсюда для любого идеального газа при нормальных физических условиях vо = 22,4/m и ро = m/22,4.
Объединенный газовый закон. Этот закон может быть получен из совместного рассмотрения законов Бойля—Мариотта и Гей-Люссака. Для перехода 1 кг газа из состояния p1, v1, T1 в состояние p2, u2, T2 оказывается справедливым следующее соотношение между этими параметрами: p1,v1,T1 — p2,v2 T2 или
pv/Т = const. (3.4)
Эту постоянную величину для 1 кг газа называют удельной газовой постоянной и обозначают R. Размерность R — Дж/(кг • К). Из размерности следует физический смысл этой величины - это работа, которую совершает 1 кг газа при его расширении или сжатии, вызванном изменением его температуры на один градус (1К) при постоянном давлении. Для каждого идеального газа удельная газовая постоянная имеет свое значение.
С использованием величины R уравнение (3.4) можно представить в следующем виде:
pv = RТ. (3.5)
Известное из физики уравнение объединенного газового закона в виде условия (3.5) называют в термодинамике уравнением состояния идеального газа, так как оно представляет собой связь между всеми тремя термодинамическими параметрами состояния для одного килограмма идеального газа. Уравнение (3.5) также называют уравнением Клапейрона, по имени Бенуа Эмиля Клапейрона - французского физика, впервые установившего эту зависимость.
Газовые законы лежат в основе термодинамики. Их значение очень велико, причем очень важны даже не сами законы, а то, что они существуют. Ведь аналогичных общих законов нет ни для жидкостей, ни для твердых тел. Наличие же сходства поведения у различных газов означает, что всем газам свойственно что-то принципиальное, отличающее их от жидкостей и твердых тел. Свойства жидкостей и твердых тел зависят от типа частиц, из которых они состоят, и сил взаимодействия между ними. В газах же расстояния между молекулами настолько велики по сравнению с размерами самих молекул, что силы взаимодействия между ними почти не проявляются. Следовательно, свойства газов мало зависят от свойств их молекул и все газы в обычных условиях ведут себя поэтому практически одинаково.
Для любой массы газа т уравнение состояния имеет вид
pV = mRT, (3.6)
где V = um - объем газа.
Уравнение состояния в любом виде дает возможность определить один из параметров состояния газа по известным значениям двух других. В частности, уравнение можно использовать для приведения объема V газа в произвольных условиях (р, Т) к нормальным физическим условиям (ро, То):
Vо = V(pТо)/(pоТ) (3.7)
Универсальная газовая постоянная. Если умножить в уравнении Клапейрона (3.5) обе части на молярную массу m (кг/кмоль), как предложил великий русский химик Д. И. Менделеев, то можно получить уравнение состояния для одного киломоля идеального газа, которое называют уравнением Клапейрона-Менделеева:
рVm = mRT, (3.8)
где Vm = vm м3/кмоль - объем одного киломоля газа в данных условиях (р и Т).
Величина mR = Rm называется универсальной газовой постоянной, которая имеет одно и то же значение для всех идеальных газов. По параметрам нормальных физических условий (ро = 0,1013 МПа и То = 273,15 К) можно подсчитать значение Rm = 8314,3 Дж/(кмоль • К).Значения удельных газовых постоянных для любых газов можно определить, разделив универсальную постоянную на молярную массу.
Уравнение состояния реального газа разработано голландским физиком Ван дер Ваальсом (1873 г) на основе уравнения Клапейрона Оно имеет вид
 (3.9)
(3.9)
где а и b — постоянные коэффициенты, имеющие различные значения для разных газов
Дробь a/u2 измеряется в единицах давления и характеризует силы взаимного притяжения молекул реального газа. Коэффициент b представляет собой величину удельного объема реального газа при наибольшем возможном сжатии, т е по существу это собственный объем молекул единицы массы реального газа Расчеты по уравнению Ван дер Ваальса для реальных газов более точны, но и значительно более сложны
Опыт показывает, что с достаточной для практических целей точностью для расчетов рабочих процессов достаточно нагретых реальных газов в тепловых машинах можно пользоваться уравнением Клапейрона
Смеси газов. Рабочие тела большинства тепловых машин не являются однородными газами, а состоят из нескольких различных газов. Даже атмосферный воздух состоит, по крайней мере, из трех составляющих: азот, кислород, водяные пары.
Если смесь нескольких идеальных газов занимает один общий объем V при температуре Т, то, очевидно, что каждый из газов, составляющих смесь, занимает тот же объем и имеет ту же температуру. Давления отдельных составляющих должны в сумме быть равны давлению смеси, т е
рcм = р1 + р2 +…..+рi +...+рп (3 10)
Это выражение называется законом Дальтона, который установил, что давление смеси газов равно сумме парциальных давлений отдельных составляющих смеси Парциальными давлениями рi называются давления, которые имели бы составляющие, если каждая составляющая в отдельности занимала бы весь объем смеси V при ее температуре Т.
Закон Дальтона справедлив только для идеальных газов Иными словами, как каждая составляющая, так и смесь в целом должны подчиняться уравнению состояния Клапейрона, а элементы смеси должны быть химически инертны по отношению друг к другу.
Состав смеси газов может быть задан различными способами в абсолютных величинах масс mi, объемов ui или количеств веществ (числа молей) Мi, ее составляющих, либо, в относительных долях по массе или объему.
Массовой долей g, называют отношение массы т, составляющей смеси (то есть данного газа) к массе смеси тсм:
gi = mi/mcм. (3.11)
Очевидно, что сумма массовых долей составляющих при таком определении равна единице: g1 + g2 + … + gi + … + gn = 1.
Объемной долей называется отношение приведенного объема составляющей смеси v, к общему объему смеси ис„:
ri = vi/vcм.. (3.12)
Под приведенным (парциальным) объемом и, понимается объем газа, входящего в смесь, при давлении р и температуре Т смеси. Сумма приведенных объемов всех компонентов смеси равна объему смеси, а сумма объемных долей равна единице: r1 + r2 + … + ri + …. + rn = 1.Молярные доли смеси равны объемным, т. е. M1/Mcм = rt.
Парциальные давление и объем составляющей смеси связаны между собой по закону Бойля — Мариотта: pivcм = pcмvi.
Таким образом, pi = pvi/vcм = pri - парциальное Давление составляющей равно давлению смеси, умноженному на объемную долю составляющей.
К расчету поведения смеси однородных газов можно применить уравнение состояния идеального газа в обычной форме, например для 1 кг pvcм = RcмT. Однако в этом случае смесь надо рассматривать как условный однородный газ массой 1 кг, в котором было бы то же количество вещества (число молекул), как и в смеси.
При этом надо подразумевать, что смесь имеет условную (усредненную) молярную массу mсм, а ее средняя удельная газовая постоянная Rcм = 8314,3/mсм. Величина mсм определяется по одному из выражений в зависимости от способа задания состава смеси:
mсм = m1r1 + m2r2 + ... + miri + •…•• + mпrп (3.1 3)
mсм = 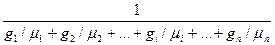 (3.14)
(3.14)
С использованием понятия приведенной молярной массы смеси можно получить соотношения между массовыми и объемными долями составляющих.смехи:
gi = ri(mi/mcм) ri = gi(mi/mi) (3.15)
Так как из закона Авогадро следует, что при одинаковых р и Т плотности газов пропорциональны их молярным массам, то из выражения (3.15) получаем формулу для определения плотности смеси:
rсм = r1r1 + r2r2 + + riri + + rпrп (3 16)
Из определения удельной газовой постоянной смеси и выражения (3.16) следует воз-можность ее подсчета через значения R,
Rсм = g1Rl + g2R2 + … + giRi +…+gnRn (3 17)
Некоторые понятия термодинамики.
В термодинамике предметом исследования являются термодинамические процессы, под которыми подразумеваются изменения со стояния рассматриваемого объекта (рабочего тела, например) в результате обмена энергией с внешней окружающей средой Тело или группа тел, состояние которых исследуется, называется термодинамической системой.
Система, как уже отмечалось выше, может находиться в состоянии равновесия с внешней средой, т. е. в равновесном состоянии. Если под действием каких-либо внешних или внутренних факторов система (рабочее тело) выведена из равновесного состояния, то значения всех ее параметров состояния изменяются - произойдет термодинамический процесс изменения состояния системы Если внешние воздействия прекратятся, термодинамическая система постепенно сама возвратится в равновесное состояние.
Термодинамические процессы сами по себе могут быть равновесными, протекающими столь медленно, что в каждый момент времени параметры системы имеют по всему ее объему одинаковые значения, соответствующие параметрам внешней среды, и неравновесными, протекающими быстро, когда значения давлений и температур по объему системы не успевают выравняться и имеются различия между параметрами системы и среды Равновесный процесс можно представить цепью последовательных (различных) равновесных состояний Равновесные процессы являются идеальными процессами. Происходящие в реальных условиях термодинамические процессы являются неравновесными, так как протекают с конечной скоростью и всегда имеются конечные значения разностей температур и давлений системы и среды.
Однако во многих случаях степень неравновесности относительно невелика, и такие процессы можно рассматривать как равновесные. Равновесными с некоторыми оговорками можно считать и рабочие процессы в двигателях внутреннего сгорания.
Равновесный процесс, который может быть осуществлен в обратном направлении через тот же ряд последовательных равновесных состояний прямого процесса, называют обратимым процессом. Необратимые процессы характерны тем, что рабочее тело невозможно вернуть в исходное состояние без внешнего дополнительного воздействия Например, процесс нагревания одного рабочего тела за счет тепла другого тела с более высокой температурой - процесс необратимый, так как передача тепла в обратном направлении от меньшей температуры к большей принципиально невозможна без дополнительной затраты энергии (работы). Следовательно, реальные процессы не только неравновесны, но и необратимы. Однако изучение равновесных обратимых процессов, являющихся идеализацией реальных процессов, дает возможность выявить основные закономерности последних, получить сравнительно простые выражения для их описания, облегчить их анализ и исследования. Неточности, связанные с таким подходом, обычно компенсируются введением специальных поправок.
Внутренняя энергия системы (рабочего тела) складывается из кинетической энергии движения молекул и потенциальной энергии их взаимодействия. Мерой кинетической энергии тепловых движений молекул является температура тела. Потенциальная составляющая внутренней энергии зависит и от температуры, и от удельного объема тела, так как взаимодействие молекул зависит от расстояний между ними. Таким образом, величина полной внутренней энергии тела U, измеряемой в джоулях, определяется двумя параметрами его состояния: Т и v.
В термодинамике исследуется обычно не абсолютная величина внутренней энергии тела, а ее изменения (увеличение или уменьшение) в термодинамических процессах. Эти изменения однозначно определяются начальными и конечными значениями параметров состояния тела и не зависят от вида и характера процесса, в котором имеют место. Удельная внутренняя энергия тела, отнесенная к 1 кг его массы, обозначается и, ее размерность Дж/кг.
Изменения внутренней энергии системы могут проявляться в различных формах: в виде тепловой энергии или механической работы.
Часть внутренней энергии тела в термодинамическом процессе может передаваться от рабочего тела (или восприниматься им) в виде определенных количеств тепла Q. Необходимым условием передачи энергии в виде теплоты является наличие разности температуры тела и среды. Следовательно, теплота Q (Дж) может подводиться к телу (положительная энергия) и вызывать увеличение его внутренней энергии, или, наоборот, отводиться от него (отрицательная энергия) и уменьшать его внутреннюю энергию. Удельный подвод или отвод тепла обозначают q (Дж/кг).
Обмен энергии в виде тепла может иметь место без видимого движения тела, изменения его объема. Передача энергии в виде механической работы обязательно связана с видимым перемещением тела или его частей, с изменением его объема. Работа L рабочего тела равна произведению давления в системе р на изменение объема тела DV, т. е. L=pDV. Если к телу подводится энергия в виде затраченной на изменение его объема работы, работу считают отрицательной. Если тело отдает энергию, совершая механическую работу, ее считают положительной.
Соотношения между теплом и работой в термодинамических процессах зависят от характера процесса, в котором они участвуют. Таким образом, тепло и работа в отличие от внутренней энергии являются функциями процесса, а не состояния рабочего тела.
Для более полной характеристики термодинамических процессов используется понятие энтальпии: I = U + pV (Дж), или в удельной форме i = U + pv (Дж/кг). Энтальпия складывается по определению из внутренней энергии тела и механической работы, затраченной на то, чтобы ввести тело с объемом V в среду с давлением р.
Энтальпия тела определяется параметрами состояния и является функцией состояния тела. Ее изменение в термодинамическом процессе зависит только от начальных и конечных значений параметров состояния и не зависит от характера процесса.
Первый закон термодинамики устанавливает количественную связь между внутренней энергией системы U, тепловой энергией Q и механической работой L. Он является частным случаем общего закона сохранения энергии, согласно которому энергия не создается вновь и не исчезает, а лишь переходит из одной формы в другую. Первый закон термодинамики устанавливает закономерность взаимного преобразования теплоты и работы в системе, а именно тепловая энергия Q, подведенная к телу, расходуется только на изменение внутренней энергии тела и на совершение внешней работы, L:
Q = ΔU + L, (3.18)
или в удельных величинах
q = Δu + l, (3.19)
где ΔU и Δи - соответственно изменения полной и удельной внутренней энергии тела при подводе (отводе) и затрате или совершении работы; l - удельная работа.
Аналитические выражения первого закона термодинамики устанавливают принцип эквивалентности теплоты и работы. Из него следует, что, если вся подведенная к телу теплота отводится в виде работы (или наоборот), внутренняя энергия тела не меняется.
Теплоемкость газов. Под теплоемкостью тела в физике понимается количество теплоты, которое необходимо подвести к телу, чтобы поднять его температуру на один градус.
Удельная теплоемкость определяется по отношению к единице количества вещества, которое может измеряться по-разному.
Используются следующие удельные значения теплоемкости: удельная массовая с Дж/(кг·К), удельная объемная с' Дж/(м3·К), удельная молярная mс Дж/(кмоль • К).
Эти величины взаимосвязаны между собой:
с = с'vо = mс/m; с' = с/vо = mс/22,4;
mс = сm = 22,4 с, (3.20)
где uо - удельный объем при нормальных физических условиях; 22,4 - объем одного киломоля в нормальных условиях, м3.
В термодинамике почти всегда используются понятия именно удельной теплоемкости, и поэтому принято называть ее просто теплоемкостью (это и подразумевается далее в данной книге, при этом оговаривается, какая именно удельная теплоемкость имеется в виду).
Величина теплоемкости идеальных газов зависит от температуры, при которой проходит процесс теплообмена, и увеличивается с ее повышением (у реальных газов теплоемкость зависит и от давления). Поэтому различают понятия средней теплоемкости сm12для какого-то интервала температур (t1, t2 или Т1, T2) и истинной теплоемкости с для данной температуры (t или Т). Для определения истинных теплоемкостей используются эмпирические формулы типа c = a + bt + dt2..., где a, b, d - постоянные коэффициенты (различные для каждого газа). В таких формулах часто ограничиваются подсчетом лишь двух слагаемых.
Средняя теплоемкость определяется экспериментально по количеству тепла q, подведенного к телу:
cm12 = q/(t2 - t1) (3.21)
Значения средних теплоемкостей обычно для интервалов температур (0°, t), приводятся в справочных таблицах. Если известны значения средних теплоемкостей cm01 и ст02 соответственно в интервалах температур (0°, t1) и (0°, t2), то среднюю теплоемкость в интервале температур (t1, t2) можно подсчитать по формуле (3.21). Для этого определим количество теплоты q12, необходимое для нагревания 1 кг газа от температуры t1 до температуры t2. Сначала получим количества теплоты q01 и q02, необходимые для нагревания до температур t1и t2от нулевой температуры (0°С):
q01 = c01 • t1 и q02 = c02 • t2
Тогда
q12 = q02 — q01 = c02 • t2 — c01 • t1 (3.22)
Подставив значение q12 в формулу (3.21), получим значение средней теплоемкости cm12.
По аналогии с формулой (3.22) можно получить более общие формулы для расчета количества теплоты Q12 на нагревание определенного количества газа (m, V или М) в диапазоне температур от t1 до t2:
Q12 = mcm12(t2 — t1)=Vc'm12(t2 — t1) = Мmcm12(t2 — t1). (3.23)
Теплоемкости газов при постоянном давлении ср (в изобарном процессе) и при постоянном объеме cv (в изохорном процессе) имеют в термодинамике особое значение, поскольку такие процессы часто являются предметом ее исследования. Эти теплоемкости часто называют изобарной и изохорной - в соответствии с наименованием процесса. Каждая из этих теплоемкостей может быть массовой (истинной ср и сu или средней срт и cum), объемной (соответственно с'р, c'u и с'рт, c'um) и мольной (mср, mcu и mсрт, mcum).
Выбор необходимой теплоемкости осуществляется в соответствии с конкретными условиями.
При изохорном нагревании газа его объем не изменяется (v = const).
Следовательно, газ при этом не совершает механической работы, связанной с его расширением и преодолением сопротивления внешних сил. При изобарном процессе (р = const) нагревание неизбежно приводит к расширению газа, увеличению его объема, связанному с совершением механической работы против внешних сил. Поэтому очевидно, что для нагревания одного и того же количества газа до одной и той же температуры в одинаковых условиях при изобарном процессе надо затратить больше теплоты, чем при изохорном. Следовательно, изобарная теплоемкость газа выше изохорной теплоемкости.
Значения этих теплоемкостей связаны между собой. Немецкий врач Юлиус Роберт Майер установил в 1842 г., что хотя ср и cu зависят от природы газа, разность между ними почти одинакова для всех газов. Она равна работе, которую совершает газ при расширении за счет нагревания на один градус, т. е. удельной газовой постоянной R. Таким образом,
ср - cu = R (3.24)
Это выражение называют уравнением Майера. Если умножить обе части уравнения на молярную массу m, получим
mср - mcv = mR = Rm = 8314 Дж/(кмоль • К) (3.25)
Поскольку ср>cu, их отношение cp/cu. = k больше единицы. Коэффициент k для идеальных газов является постоянной величиной, зависящей лишь от природы газа. Для одноатомных газов k == 1,67, для двухатомных — k = 1,41.
Теплоемкость смеси газов равна сумме произведений теплоемкостей составляющих на их доли, а именно
ссм = с1g1 + с2g2 + … + сigi + + сngn (3.26)
или
с'см = с'1r1 + с'2r2 + … + сi'ri + + сnrn (3.27)
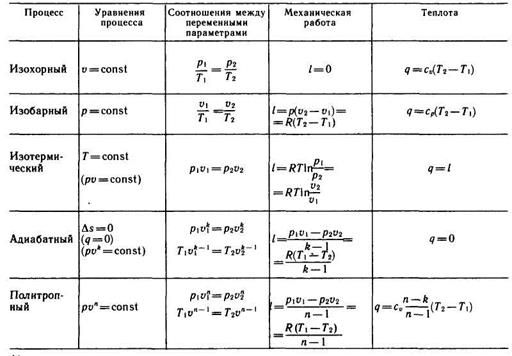
Основные термодинамические процессы. Изменения состояния идеального газа, связанные с подводом или отводом теплоты или совершением работы, сводятся к изменению значений его параметров состояния. В большом числе возможных процессов изменения параметров, связанных уравнением состояния pu = RT, можно выделить несколько основных, в которых какой-либо один из параметров состояния не меняет своего значения. В первую очередь можно указать на процесс при постоянном объеме (v = const) - изохорный, процесс при постоянном давлении (p = const) - изобарный, процесс при постоянной температуре (Т = const) - изотермический, процесс без теплообмена с внешней средой (q = 0) - адиабатный, процесс при постоянной теплоемкости (c = const) - политропный.
Проведем анализ основных особенностей этих процессов. Предварительно отметим следующее. Так как произвольное состояние газа определяется тремя параметрами (р, v, T), это состояние можно представить точкой в трехмерном пространстве с осями координат (р, u и Т). Чаще, однако, используют более простое графическое представление термодинамических состояний и процессов - на плоскости, обычно в координатах (р и v).
Такой график процесса называют pv - диаграммой. Она позволяет оценить работу, совершаемую в процессе.
С другой стороны, для оценки термодинамических процессов используется еще один комбинированный параметр состояния, называемый энтропией S. В термодинамике имеет значение не само абсолютное значение энтропии, а ее изменение в процессе (так же как и изменение внутренней энергии). Изменение энтропии ΔS определяется отношением количества тепла Q, подведенного к телу (или отведенного от него) , к средней температуре тела Тт. Удельное изменение энтропии Δs подсчитывается по удельному количеству тепла q:
ΔS = Q/Тm; Δs = q/Tm. (3.28)
Для подсчета изменения удельной энтропии s2 - s1используется следующее выражение:
Δs = s2 - s1 = сv ln(Т1/Т2) + R ln(v1/v2) (3.29)
С использованием энтропии строятся так называемые энтропийные диаграммы термодинамических процессов, в которых по оси абсцисс откладывается энтропия s, а по оси ординат - или абсолютная температура Т (Т - s - диаграмма) или удельная энтальпия i (is - диаграмма).
Более наглядны в наших случаях изображения процессов в координатах (Т, s), которые позволяют судить о степени использования теплоты в рассматриваемых процессах.
Анализ каждого из основных процессов проведем в следующей последовательности: рассмотрим уравнения и графики процесса в координатах (р, v) и (Т, s), установим соотношения между изменяющимися в процессе параметрами, получим формулы для подсчета работы, количества теплоты и изменения внутренней энергии газа.
Основные результаты этого исследования сведены в табл. 3.1.
Изохорный процесс (рис. 3.1) протекает при нагревании или охлаждении газа в замкнутом сосуде, т. е. при неизменном объеме. Его уравнение u = const. В координатах (р, u) этот процесс изображается вертикальной линией - изохорой 1—2 (рис. 3.1, а).
Уравнения состояния для точек 1 и 2 соответственно будут p1v1 = RT1и p2v2 = RT2Разделив одно на другое, получаем соотношение между параметрами состояния этих точек p1/р2= T1/T2, являющееся выражением закона Шарля, рассмотренного выше: в изохорном процессе давление газа изменяется прямо пропорционально его температуре.
|
При подводе теплоты к газу давление и температура газа повышаются (от точки 1 к точке 2), при отводе теплоты - понижаются (от точки 2 к точке 1).
В изохорном процессе, как это следует из его определения, работа, связанная с изменением объема, равна нулю (l = 0). Иными словами, в процессе работа не совершается. Поэтому вся подведенная теплота идет на повышение внутренней энергии, т. е.
gv = Δuv = cvm(T2 – T1) (3.30)
Из уравнения (3.29), так как в изохорном процессе ln(v2/vi) = ln1 = 0, следует, что изменение энтропии в процессе
Δsv = cvmln(T2/T1). (3.31)
Это выражение представляет собой уравнение процесса в переменных (Т, s). Графически процесс в координатах (Т, s) показан на рис. 3.1, б. Площадь под кривой 1—2, так как по определению (3.28) TmDs = q, равна количеству тепла, участвующему в процессе.
Изобарный процесс (рис. 3.2) протекает при постоянном давлении, например при нагревании или охлаждении газа в цилиндре, на поршень которого действует постоянная по величине сила. Уравнение процесса р = const. В координатах (р, v) графиком процесса (см. рис. 3.2, а) является прямая 1—2, параллельная оси абсцисс, называемая изобарой. При подводе тепла температура и объем газа увеличиваются (процесс идет от точки 1 к точке 2), при отводе тепла — уменьшаются (от точки 2 к точке 1).
Уравнения состояния для этих точек соответственно выглядят так: p1v1 = RT1и p1v2 = RT2. Разделив первое на второе, получаем соотношение параметров в процессе v1/v2 = T1/T2, являющееся выражением закона Гей-Люссака, рассмотренного ранее: в изобарном процессе удельные объемы газа изменяются прямо пропорционально его температуре.
Изменение энтропии в процессе определяется по уравнению (3.29), из которого с учетом закона Гей-Люссака и уравнения Майера (3.24) следует
Δsр = cрmln(T2/T1). 3.32)
В координатах Т, s график процесса показан на рис. 3.2, б.
Сравнение выражений (3.32) и (3.31) показывает, что одному и тому же изменению температур (от Т1до Т2) в изобарном процессе соответствует большее изменение энтропии (так как ср>cu). Следовательно, в координатах Т, s изохора круче изобары.
Количество теплоты, подведенной в процессе при постоянном давлении, составляет
qр = cрm(T2 – T1). (3.33)
Работа расширения (или сжатия) газа при постоянном давлении определяется, как в любом процессе, площадью под графиком процесса на рv - диаграмме. В данном случае lр = р(v2 – v1).Изменение внутренней энергии газа в процессе Δир = cvm(T2 – T1).
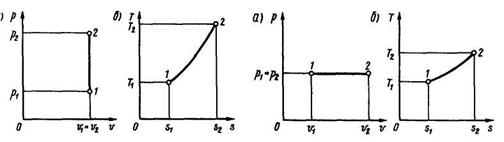
Рис. 3.1. Изохорный процесс (u=const) Рис. 3.2. Изобарный процесс (p=const)
Изотермический процесс (рис. 3.3) протекает при неизменной температуре. Его уравнение Т = const, или, по закону Бойля — Мариотта, рv = const, на основе которого и устанавливается соотношение между па-параметрами процесса v1/v2 = р2/р1 в изотермическом процессе давления газов обратно пропорциональны их объемам. Таким образом, в координатах рu график процесса - изотерма - представляет собой равнобокую гиперболу (рис. 3.3, а). При подводе теплоты газ расширяется и совершает работу, при отводе теплоты - сжимается.
Так как в изотермическом процессе температура газа не меняется, следовательно, не меняется и его внутренняя энергия. В этом случае, очевидно, что в соответствии с первым законом термодинамики вся подведенная теплота преобразуется в механическую работу.
Изменение энтропии в процессе можно получить из выражения (3.29), если иметь в виду, что ln(T2/T1) = ln1 = 0. Тогда
ΔsТ = Rln(u2/u1). (3.34)
В координатах Т, s (рис. 3.3, б) график процесса Т = const представляет собой прямую линию, параллельную оси абсцисс. Площадь под этой линией TDs = q - по определению энтропии. Так как q = l, как было показано выше, то получаем формулы для количества теплоты и механической работы:
qТ = lТ = RТln(v2/v1) = RТln(р1/р2). (3 35)
&
| <== предыдущая лекция | | | следующая лекция ==> |
| Автоматизированная информационно-управляющая система (АИУС) | | | Зонирование территорий по степени возможных опасностей, отнесение территорий и объектов к группам и категориям по гражданской обороне |
Дата добавления: 2021-09-25; просмотров: 119;










