ГИДРАВЛИЧЕСКАЯ ИЗВЕСТЬ И РОМАНЦЕМЕНТ
5.1.1. Гидравлическая известь
Определение: гидравлическая известь - гидравлическое вяжущее вещество, получаемое обжигом не до спекания известняков, содержащих от 6 до 20 % глинистых веществ.
Процесс получения гидравлической извести состоит из добычи сырья, обжига его в шахтных печах при 900-1100 0С и помола или гашения полученной извести (гидравлическая известь гасится только в пушонку).
При обжиге мергелистых известняков после разложения углекислого кальция часть образующейся CaО соединяется с окислами SiO2, AI2O3, Fe2O3, входящими в состав глинистых веществ:
2СаО + SiO2 = 2СаО SiO2;
2СаО + Fe2O3 = 2СаО Fe2O3;
СаО + А12О3 = СаО А12О3.
Образовавшиеся силикаты, ферриты и алюминаты кальция обусловливают способность гидравлической извести твердеть не только на воздухе, но и под водой. Так как в гидравлической извести содержится значительное количество свободной окиси кальция, то она так же, как и воздушная известь, гасится при действии на нее воды.
По ГОСТ 9179 гидравлическая известь делится на слабо- и сильногидравлическую. В слабогидравлической извести содержание активных CaO + MgO составляет 15-16 % и прочность образцов на сжатие в возрасте 28 сут. не менее 2 МПа, а у сильногидравлической – соответственно 1-15 % и 5 МПа (при комбинированном твердении – 7сут. во влажном воздухе и 21сут. в воде).
Гидравлическую известь применяют для приготовления строительных растворов, а также для получения бетонов низких марок и изготовления бетонных камней. Гидравлическую известь следует хранить в закрытых помещениях и при перевозке предохранять от увлажнения.
5.1.2. Романцемент
Определение: романцемент - гидравлическое вяжущее вещество, продукт тонкого помола обожженных не до спекания известняковых или магнезиальных мергелей, содержащих более 20 % глинистых примесей. Обжиг сырья производят в шахтных печах при температуре около 900 °С.
В романцементе свободной окиси кальция содержится меньше, чем в гидравлической извести, поэтому при действии воды он не гасится, т.е. не рассыпается в порошок. Прочность растворов на романцементе выше, чем на гидравлической извести. По пределу прочности при сжатии образцов из цементного раствора состава 1:3 в возрасте 28 сут. романцемент делится на три марки: 25, 50 и 100.
Романцемент должен выдерживать испытание на равномерность изменения объема при твердении. Начало схватывания должно наступать не ранее 15 мин, конец схватывания - не позднее 24 ч после затворения водой.
Романцемент применяют там же, где и гидравлическую известь (растворы для каменной кладки и наружной штукатурки, низкомарочные бетоны и бетонные камни). Вследствие невысокой прочности романцемент в железобетонных конструкциях, не используется.
Портландцемент
Определение: портландцемент – гидравлическое вяжущее вещество, твердеющее в воде и на воздухе, изготовленное путем совместного тонкого измельчения клинкера и необходимого количества гипса. Клинкер получают обжигом до спекания сырьевой смеси надлежащего состава, обеспечивающего преобладание в конечном продукте силикатов кальция.
Портландцемент – наиболее широко применяемое в строительстве гидравлическое вяжущее вещество. Впервые производство его было организовано в начале XIX в. в Москве Егором Челиевым, который предложил получать гидравлическое вяжущее вещество путем обжига смеси глины и извести «до белого коления».
Портландцемент характеризуется постоянством своего химического состава. Содержание отдельных окислов колеблется в сравнительно ограниченных пределах (%): СаО = 64-67; SiO2 = 19-24; А12О3 = 4-7; Fe2O3 = 2-6; MgO - не более 5, SO3 - не менее 1,5 и не более 3,5.
5.2.1. Сырье
В качестве сырьевых материалов, с которыми в цемент вводится окись кальция CaO, применяют все виды известняков и мела независимо от содержания в них глины.Вторым компонентом обычно является глина, с которой в цемент вводятся кремнезем SiO2, глинозем А12О3 и окись железа Fe2O3.
Сырьевые материалы не должны содержать повышенного количества MgCO3 и сульфатов, например CaSO4·2H2O, с тем, чтобы содержание MgO и SO3 в цементе не превышало норм, установленных стандартом. Для увеличения содержания того или иного окисла вводят корректирующие добавки: для увеличения содержания Fе2О3 - пиритные огарки, SiO2 - маршалит, кварцевый песок и др., А12О3 - бокситы.
5.2.2. Производство портландцемента
Производство портландцемента состоит из добычи и подготовки сырья к обжигу; обжига (получение клинкера) и измельчения клинкера в тонкий порошок.
а) Подготовка сырья к обжигу
При мокром способе мел и глину, предварительно прошедшие стадию дробления, взвешивают на весах и загружают в болтушки (рис. 5.1), куда подают и воду. В болтушках происходит размучивание и перемешивание сырья. При этом получают текучую массу, называемую шламом, которая вытекает из болтушки через отверстие с сеткой. Содержащиеся в сырье примеси (песок, галька) осаждаются на дне болтушки и периодически удаляются. Часто в качестве второго компонента в сырьевую смесь вводят не мел, а твердый известняк. В этом случае в болтушку загружают только глину - хорошо размучиваемый компонент. Глиняный шлам из болтушки и известняк поступают в трубные мельницы непрерывного действия для дальнейшего измельчения.
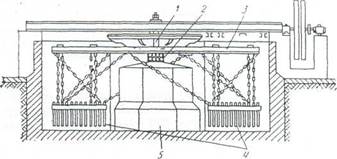
Рис. 5.1. Болтушка дляперемешивания глины и мела
1 - вал; 2 - подшипник; 3 - крестовина; 4 -бороны; 5 – фундамент
Трубная мельница (рис. 5.2) представляет собой сварной барабан, разделенный по длине дырчатыми перегородками на несколько камер, заполненных примерно на 0,3 объема мелющими телами. Шлам поступает в первую камеру, загруженную стальными или чугунными шарами диаметром от 70 до 100 мм, а затем для дальнейшего помола - во вторую камеру, заполненную шарами меньших диаметров. Окончательное измельчение происходит в третьей камере, где материал перетирается металлическими цилиндриками.
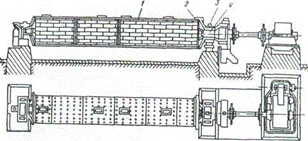
Рис.5.2. Трубная мельница
1 - барабан; 2 - днище; 3- подшипник; 4 -полая цапфа
Выходящий из мельницы шлам подается насосом в вертикальные шламбассейны (рис. 5.3), представляющие собой стальные или железобетонные резервуары цилиндрической формы, переходящие внизу в конус, в которых корректируют химический состав шлама. Необходимые запасы шлама для обеспечения бесперебойной работы печей создают в горизонтальных шламбассейнах емкостью до 8000 м3. Из шламбассейна шлам поступает в печь для обжига.
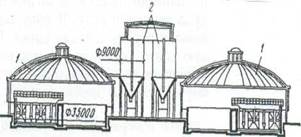
Рис. 5.3. Шламбассейны
1 - горизонтальные с крановыми мешалками; 2- вертикальные
Сухой способ производства портландцемента отличается от мокрого особенностью приготовления сырьевой шихты к обжигу. Дробленые и высушенные сырьевые материалы (глину и известняк или мел) раздельно тонко измельчают в помольных агрегатах, а затем их перемешивают, получая сырьевую муку заданного химического состава.
При сухом способе производства портландцемента расход тепла с учетом затрачиваемого также и на сушку сырьевых материалов составляет 800-1200 ккал/кг клинкера против 1500 ккал/кг при мокром способе.
б) Обжиг
При мокром способе подготовки сырье обжигают во вращающихся печах. Печь (рис. 5.4) представляет собой цилиндр диаметром до 5 м и длиной до 200 м из толстой листовой стали, футерованный внутри огнеупорным материалом. Печь расположена под небольшим углом к горизонту, при работе она вращается с частотой 1-2 об/мин. Шлам из шламбассейна подают насосом в питатели-дозаторы, установленные над печью, и из них шлам поступает в верхний (приподнятый) конец печи. Вследствие вращения печи и наклона ее к горизонту обжигаемый материал перемещается в печи по направлению к нижнему концу, занимая лишь небольшую часть сечения. Над материалом навстречу ему движутся топочные газы, образующиеся при сгорании топлива в нижнем конце печи.
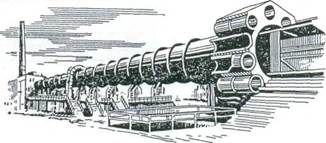
Рис. 5.4. Вращающаяся печь с рекуператорами
При температуре примерно 500 °С и выше происходит удаление химически связанной воды из минералов, входящих в состав глин, в частности из каолинита. При этом каолинит распадается с образованием аморфного остатка, состоящего из AI2О3 и SiO2, по уравнению
Al2O3·2SiO2·2H2O → Al2O3 + 2SiO2 + 2Н2О.
В интервале температур 800-900 °С происходит термическая диссоциация СаСО3:
СаСО3 → СаО + СО2 - q.
Образующийся углекислый газ вместе с продуктами горения удаляется из печи, а, окись кальция вступает в химическое взаимодействие с продуктами распада каолинита и других минералов. Реакции химического связывания СаО протекают в твердом состоянии и особенно интенсивно при температуре 1100-1200 °С, при этом образуются следующие химические соединения:
2СаО+ SiO2 = 2CaO·SiO2 → двухкальциевый силикат (C2S)
ЗСаО + А12О3 = ЗСаО·А!2О3→ трехкальциевый алюминат (С3А)
4СаО + А12О3 + Fe2O3 = 4СаО·А12О3·Fe2O3 → четырехкальциевый
алюмоферрит (C4AF).
При температуре в печи около 1300 °С обжигаемая масса состоит из 2CaO·SiO2, ЗСаО·А12О3, 4СаО·А12О3·Fe2O3 и свободной СаО. При температуре свыше 1300 °С ЗСаО·А12О3 и 4СаО·А12Оз·Fе2Оз расплавляются и образуют жидкость, в которой частично растворяются СаО и 2CaO·SiO2. В жидком растворе 2CaO·SiO2 присоединяет одну молекулу СаО по реакции
2CaO·SiO2 + СаО = 3CaO·SiO2;
при этом образовавшийся трехкальциевый силикат 3CaO·SiO2 (более тугоплавкий и менее растворимый, чем двухкальциевый силикат 2CaO·SiO2) выделяется из раствора в виде мельчайших кристаллов.
в) Охлаждение клинкера
Скорость охлаждения клинкера оказывает большое влияние на качество цемента - при медленном охлаждении клинкера портландцемент получается низкого качества. Объясняется это полиморфными превращениями двухкальциевого силиката при его охлаждении. Высокотемпературные α- и β-модификации 2СаО·SiO2, обладающие гидравлическими свойствами, при медленном охлаждении переходят в γ-модификацию по схеме
1420°С 675°С
α → β → γ.
Однако стабильная (устойчивая) при нормальной температуре γ-модификация 2CaO·SiO2 гидравлическими свойствами не обладает, поэтому только резким охлаждением клинкера от высоких температур (1000-1200 °С) можно зафиксировать β-2CaO·SiO2 и предотвратить образование нежелательной γ-модификации. Быстрое охлаждение клинкера способствует повышению качества цемента также и потому, что при этом сохраняется более активная модификация и трехкальциевого силиката.
г) Помол клинкера
Из холодильника вращающейся печи клинкер подается на клинкерный склад, расположенный вблизи цементно-помольного цеха. После предварительного дробления в дробилке клинкер через дозаторы поступает для тонкого измельчения в трубные мельницы, устройство которых аналогично устройству сырьевых мельниц; из мельниц готовый портландцемент направляется пневматическим насосом на хранение в силосы.
5.2.3.Минералогический состав клинкера портландцемента
Рассматривая под микроскопом микрошлифы клинкера, можно установить, что он состоит в основном из двух кристаллических минералов и изотропной стекловидной массы, обволакивающей эти минералы и заполняющей промежутки между ними.
Первый минерал, в наибольшем количестве представленный в клинкере современного портландцемента, называется алитом. Алит - это твердый раствор на основе трехкальциевого силиката 3CaO·SiO2, в состав которого в небольших количествах входят MgO, A12O3, а иногда и другие окислы (Сг2О3, РгО5 и т. д.). Чем больше алита в клинкере, тем выше качество цемента.
Второй минерал, состоящий из метастабильной β-модификации двухкальциевого силиката β-2CaO·SiO2, стабилизированной растворенными в ней окислами СаО, А12О3, В2О3, Na2O, Р2О5 и др., называется белитом.
Изотропная стекловидная масса представляет собой продукт затвердевания жидкой фазы, образующейся при обжиге; в состав ее входят ЗСаО·А12О3, 4СаО·А12О3·Fe2O3 и другие химические соединения.
Содержание в клинкере свободной извести СаОсвоб допускается не более 0,5 %. Клинкер, полученный из правильно рассчитанной, хорошо подготовленной и обожженной сырьевой смеси, практически не содержит
5.2.4.Твердение портландцемента
При затворении портландцементного порошка достаточным количеством воды образуется пластичное цементное тесто, которое затем начинает загустевать.
Определение: период времени от начала затворения до потери тестом пластичности называется периодом, схватывания цементного теста.
За периодом схватывания следует период твердения, в течение которого прочность цементного камня постепенно нарастает. Схватывание цементного теста завершается относительно быстро в течение нескольких часов, твердение же цементного камня продолжается длительное время (месяцы и годы).
В процессе схватывания и твердения минеральных вяжущих веществ различают три периода:
а) подготовительный, или период растворения;
б) коллоидации - образование коагуляционной структуры;
в) кристаллизации - образование коагуляционно-кристаллизационной структуры.
а) Начальный период взаимодействия цемента с водой
Взаимодействие цемента с водой начинается с растворения клинкерных минералов на поверхности цементных зерен. В жидкую фазу цементно-водной суспензии переходят продукты растворения всех клинкерных минералов.
Рассмотрим механизм растворения клинкерных минералов на примере растворения трехкальциевого силиката C3S. При затворении цемента водой с поверхности цементных зерен в раствор будут переходить молекулы 3CaO·SiO2. В жидкой фазе от молекулы трехкальциевого силиката отщепляется СаО. Образующийся в результате гидратации СаО гидрат окиси кальция Са(ОН)2 диссоциирует затем на ионы Са2+ и ОН-.
Оставшаяся часть молекулы, а именно 2CaO·SiO2, диссоциирует на ионы 2Са2+ и SiO4-4, а затем гидролизуется по реакции:
2Са2+ + SiO4-4 + 4H0H = 2Са2+ + 4ОН- + H4Si04.
Следовательно, при растворении трехкальциевого силиката в жидкой фазе (в растворе) будут присутствовать ионы Са2+, ОН- и SiO4-4 и молекулы ортокремневой кислоты. В результате образования избытка гидроксильных ионов ОН- при растворении и гидролизе трехкальциевого силиката быстро повышается рН жидкой фазы цементно-водной суспензии.
б) Образование коагуляционной структуры
Как только в результате растворения клинкерных минералов концентрация жидкой фазы цементно-водной суспензии достигнет некоторого предельного значения Сп, начнут возникать первичные зародыши новых фаз.
Рассмотрим взаимодействие безгипсового цемента с водой.
При затворении водой безгипсовых цементов жидкая фаза цементного теста быстро насыщается ионами Са2+, ОН-, SiO4-4, Al(OH)-4 до некоторой предельной концентрации Са, при которой происходит самопроизвольное образование зародышей новых фаз по реакциям:
ЗСаО·SiO2 + 5Н2О → 2CaO·SiO2·4H2O + Ca(OH)2;
2CaO·SiO2+4H2O→2CaO·SiO2·4H2O;
ЗСаО·А12О3 + Са(ОН)2 + 18Н2О → 4СаО·А12О3·19Н2О;
4СаО·А12О3·Fe2O3 + nН2О → 4СаО·А12О3·Fe2O3 пН2О.
Зародыши гидратов возникают в непосредственной близости отповерхности цементных зерен, так как образование их в объеме раствора (в жидкой фазе) энергетически менее выгодный процесс. Здесь же, вблизи поверхности цементных зерен, протекают и коллоидно-химические процессы, в результате которых образуются коллоидные гели. Частицы новых фаз образуют вокруг поверхности цементных зерен сильно набухающие коллоиды вследствие возникновения вокруг них сольватных оболочек.
В результате коллоидно-химических процессов, протекающих на поверхности цементных зерен, они увеличиваются в объеме (набухают) и через некоторое время оказываются в непосредственном контакте друг с другом, образуя коагуляционные узлы, как это показано на рис. 5.5.
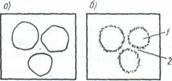
Рис. 5.5. Схема образования начальной коагуляционной
структуры в процессе схватывания цементного теста
а - цементно-водная суспензия сразу после затворения; б - образование коагуляционных контактов;
1-не до конца гидратированное зерно цемента; 2 - коагуляционные контакты
Определение: структуру цементного теста, в которой отдельные зерна цемента через тонкие водные прослойки объединяются в единую рыхлую пространственную сетку с помощью ван-дер-ваальсовых молекулярных сил, принято называть коагуляционной.
Образование коагуляционной структуры сопровождается загустеванием (схватыванием) цементного теста.
Характерной особенностью коагуляционной структуры цементного теста является ее тиксотропность, т.е. способность обратимо разрушаться (разжижаться) при механических воздействиях - при перемешивании, встряхивании и.т. д. При отсутствии в цементе гипса коагуляционная структура образуется через небольшой период времени взаимодействия цемента с водой, т. е. наступает быстрое схватывание цементного теста.
С целью замедления схватывания цемента в него при помоле вводят гипс, механизм действия которого заключается в следующем.
При взаимодействии портландцемента с водой в присутствии гипса из сильно пересыщенной жидкой фазы первым кристаллизуется труднорастворимый гидросуль-фоалюминат кальция (эттрингит):
ЗСаО А12О3 + 3(CaSO4·2H2O) + 26Н2О = ЗСаО·А12О3·3CaSO4·32H2O.
Эттрингит кристаллизуется в непосредственной близости от поверхности цементных зерен, образуя полупроницаемую гелевидную оболочку. Возникающие вокруг цементных зерен оболочки, состоящие в основном из субмикрокристаллов эттрингита, характеризуются большой экранирующей способностью из-за высокой степени дисперсности кристалликов эттрингита, в связи с чем в первые минуты взаимодействия цемента с водой скорость гидратации цемента существенно уменьшается.
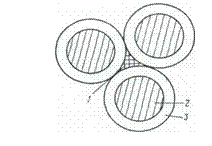 |
Между внутренней поверхностью гелевидной оболочки и еще не гидратированной поверхностью зерна цемента не существует непосредственного контакта, т. е. в процессе формирования экранирующих оболочек образуется зона перехода (рис. 5.6).
Рис. 5.6. Схема формирования структуры цементного камня
1 – капиллярное пространство; 2 - исходное зерно
портландцемента; 3 -зона перехода
Зона перехода заполнена молекулами воды и ионами - продуктами растворения всех клинкерных минералов. Концентрация жидкой фазы, заполняющей зону перехода, больше концентрации раствора в капиллярном пространстве, вследствие чего возникаетосмотическое давление. С течением времени из-за увеличения плотности экранирующих оболочек возрастает разность химических потенциалов жидкой фазы, заполняющей зону перехода и капиллярное пространство, и осмотическое давление увеличивается. Под действием осмотическогодавления, достигшего своего максимального значения, экранирующие оболочки разрушаются. Разрушение их возможно только в начальный период формирования структуры цементного камня, до образования кристаллизационной структуры.
в) Образование коагуляционно-кристаллизационной
структуры цементного камня
Процесс гидратации цемента можно разделить на два основных этапа. На первом этапе гидратации цемента из жидкой фазы кристаллизуются кристаллогидраты эттрингита ЗСаО·А12О3·ЗСаSО4·32Н2О, гидроалюмината кальция 4СаО·АI2О3·19Н2О и гидросиликата кальция состава 2CaO·SiO2·4H2O, причем последние кристаллизуются преимущественно в форме субмикроскопических плоских пластинок, на поверхности которых адсорбируются полимолекулярные слои воды, временно препятствующие дальнейшему росту кристаллов. Состав гидросиликатов кальция, образующихся на первом этапе гидратации цемента, соответствует составу жидкой фазы с высокой концентрацией ионов кальция.
На первом этапе гидратации портландцемента, т. е. до образования на зернах клинкера плотных экранирующих пленок, когда концентрация ионов Са2+ в жидкой фазе цементно-водной суспензии превышает 1,12 г/л, образуются гидросиликаты кальция, состав которых соответствует общей формуле (1,7-2)CaO·SiO2·(2-4)Н2О. Гидросиликаты кальция этого состава принято обозначать символом CSH(II).
На втором этапе скорость гидратации цемента определяется скоростью диффузии продуктов растворения клинкерных минералов из зоны перехода в капиллярное пространство через полупроницаемую экранирующую оболочку. Вследствие того, что скорость поступления продуктов растворения в зону капиллярного пространства меньше скорости отвода их на образование новых твердых фаз, концентрация растворенных веществ в растворе уменьшается и снижается степень пересыщения жидкой фазы. В этих условиях преобладающим становится не возникновение трехмерных зародышей, а рост кристаллов путем образования двухмерных зародышей на поверхности ранее образовавшихся первичных кристаллов.
На втором этапе гидратации портландцемента вследствие возникновения на зернах цемента достаточно плотных экранирующих оболочек концентрация ионов кальция в жидкой фазе, заполняющей капиллярное пространство твердеющего цементного камня, становится меньше 1,12 г/л в пересчете на СаО. В этих условиях из жидкой фазы кристаллизуются низкоосновные гидросиликаты кальция, состав которых соответствует формуле (0,8-1,5) CaO·SiO2 (0,5-2)Н2О. Гидросиликаты кальция этого состава обозначают условным символом CSH(I).
При гидратации трехкальциевого алюмината образуются преимущественно гидроалюминаты состава 4СаО·А12О3 19Н2О, а на более поздней стадии твердения цемента возникает также и трехкальциевый гидроалюминат ЗСаО·А12О3·6Н2О.
5.2.5. Структурные составляющиецементного камня
В твердеющем цементном камне можно выделить три основные структурные составляющие (рис. 5.7): 1) кристаллический сросток, образованный сросшимися друг с другом кристаллликами гидроалюминатов кальция, гидрата окиси кальция, а также гидросульфоалюмината и гидросульфоферрита кальция; 2) гелевую структурную составляющую, которой дисперсной фазой являются субмикрокристаллы гидросиликатов кальция; 3) не до конца прогидратированные зерна цемента.
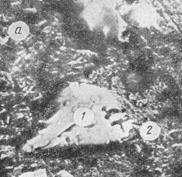
Рис. 5.7. Микроструктура твердеющего цементного камня
Гелевая составляющая, называемая тоберморитовым гелем, является основным структурным компонентом цементного камня, занимающим примерно 75 % его объема.
5.2.6. Строительно-технические свойства портландцемента
Строительно-технические свойства портландцемента характеризуются истинной и насыпной плотностью, тонкостью помола цементного порошка, нормальной густотой и сроками схватывания цементного теста, тепловыделением и равномерностью изменения объема в процессе твердения, прочностью затвердевших цементно-песчаных растворов.
а) Свойства цементного порошка
Истинная плотность частиц портландцемента колеблется в пределах 3,05-3,2 г/см3, насыпная плотность цементного порошка в рыхлом состоянии - в пределах 0,9-1,1 г/ см3. Тонкость помола цемента характеризуется массой порошка, прошедшей через сито № 008 (с размером стороны ячейки в свету 0,08 мм), и удельной поверхностью, т. е. суммарной поверхностью зерен, содержащихся в единице массы цемента: проходить через сито № 008 должно не менее 85 % порошка, удельная поверхность должна быть в пределах 2000-3000 см2/г у обычного портландцемента и 3500-5000 см2/г у быстротвер-деющих и высокопрочных портландцементов.
б) Свойства цемента в тесте
Определение: цементным тестом называют смесь цемента с водой.
Такие свойства цемента, как сроки схватывания, равномерность изменения объема при твердении и др., определяют на цементном тесте нормальной густоты, т. е. заранее заданной стандартной консистенции (пластичности).
Определение: нормальную густоту цементного теста характеризуют количеством воды в процентах от массы цемента.
Ее определяют на приборе Вика (рис. 5.8), состоящем из круглого металлического стержня 1, свободно перемещающегося в вертикальном направлении в обойме станины 5 и закрепляемого на нужной высоте зажимным винтом 4. Глубину погружения стержня определяют по шкале 3 прибора с указателем 2, закрепленным на стержне. В нижнюю часть стержня вставляется металлический цилиндр - пестик 6 (измеритель густоты цементного теста). Масса стержня с пестиком составляет 300 г.
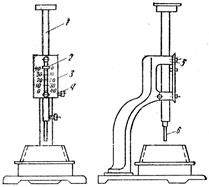
Рис. 5.8. Прибор Вика
1 - цилиндрический стержень; 2 -указатель для отсчета перемещения стержня;
3 -шкала; 4 -зажимной винт; 5 - обойма станины; 6 - пестик
Приготовленное цементное тесто помещают в металлическое кольцо конической формы, установленное на стеклянную пластинку, смазанную машинным маслом. Стержень с пестиком опускают до соприкосновения с поверхностью цементного теста и закрепляют зажимным винтом. Затем освобождают закрепляющий винт, и пестик свободно погружается в цементное тесто.
За нормальную густоту цементного теста принимают такую его консистенцию, при которой пестик прибора Вика не доходит до дна на 5-7 мм.
Свойства цемента необходимо определять на тесте нормальной густоты, так как с изменением количества воды, а следовательно, и консистенции цементного теста будут изменяться и его свойства. Для получения теста нормальной густоты необходимо 24-28 % воды.
По ГОСТ 10178-76 требуется, чтобы начало схватывания цементного теста наступало не ранее 45 мин, а конец наступал не позднее 10 ч.
За начало схватывания принимается период времени от момента затворения до начала загустевания, а за конец схватывания – время от момента затворения до полной потери цементным тестом пластичности.
Введенный в состав цемента гипс замедляет сроки схватывания, так как в его присутствии при взаимодействии цемента с водой вокруг гидратирующихся цементных зерен образуются экранирующие оболочки, препятствующие дальнейшему растворению клинкерных минералов. Все, что замедляет образование экранирующих пленок вокруг гидратирующихся цементных зерен или повышает растворимость клинкерных минералов и степень пересыщения жидкой фазы цементно-водной суспензии, ускоряет схватывание цементного теста. К таким факторам относятся: увеличение тонкости помола цемента, повышение в цементе содержания С3А - клинкерного минерала с наибольшей скоростью растворения, введение в цемент или в воду затворения добавок, увеличивающих растворимость некоторых клинкерных минералов, например хлористого кальция СаСl2, поташа К2СО3, а также рост температуры.
в) Свойства цемента в камне
Тепловыделение при твердении цемента. Тепловыделение в процессе схватывания и твердения цементного теста обусловливается экзотермическими реакциями гидратации клинкерных минералов. Количество тепла, выделяющегося в процессе гидратации цементов, определяется их минералогическим составом. Тепловыделение отдельных клинкерных минералов в условиях полной гидратации характеризуется следующими данными, кал/г (кДж/кг): С3А = 260 (1090); C3S = 160 (670); C4AF = 136 (570); C2S = 84 (352).
Чем выше содержание в цементе С3А и C3S, тем больше его тепловыделение.
Тепловыделение цемента, особенно в первые сроки твердения, существенно повышается с увеличением тонкости помола цемента и при введении в его состав химических добавок, ускоряющих процесс гидратации. Тепловыделение 1 г цемента за 7 сут твердения в зависимости от его минералогического состава и тонкости помола колеблется в пределах 40-80 кал/г (168-335 кДж/кг).
Равномерность изменения объема при твердении.Процесс твердения цементного камня сопровождается объемными деформациями: набуханием при твердении в воде, усадкой при твердении на воздухе. Однако все цементы должны характеризоваться в процессе твердения равномерным изменением объема.
Одной из причин неравномерного изменения объема цементного камня при твердении является наличие в клинкере свободных СаО и MgO, гидратация которых после конца схватывания цементного теста сопровождается возникновением в твердевшем цементном камне больших внутренних напряжений.
Испытание на равномерность изменения объема при твердении производится на образцах-лепешках, изготовленных из цементного теста нормальной густоты. На рис. 5.9 показаны образцы, выдержавшие и не выдержавшие испытание на равномерность изменения объема при твердении. Цементы, не выдержавшие испытания на равномерность изменения объема при твердении, признаются некачественными и не должны применяться в строительстве.
Прочность цементного камня в первом приближении определяется его относительной плотностью d, равной отношению средней плотности цементного камня в высушенном состоянии r0 к его истинной плотности r:
d = r0/r.
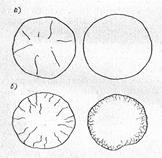
Рис. 5.9. Лепешки из цементного теста
а - выдержавшие испытания на равномерность изменения объема;
б - не выдержавшие испытания
Прочность цементного камня Rцк.в зависимости от его относительной плотности d описывается эмпирической формулой
Rц.к. = Adn = 3100[(1 + 0,23α рц)/(1+ рц·В/Ц)]2,7, (1)
где α – степень гидратации цемента; рц – безразмерная величина, равная отношению истинной плотности цемента к плотности воды, отн. ед.; 0,23 – масса воды, химически связанная при гидратации цемента, отн. ед.; В/Ц – водоцементное отношение, отн. ед.
Из формулы (1) следует, что прочность цементного камня тем выше, чем больше степень гидратации цемента α и чем меньше водоцементное отношение В/Ц.
5.2.7. Коррозия цементного камня под действием природных вод
Коррозия мягкими водами. Мягкими называют воды с жесткостью менее 4 мг-экв/л. В мягких водах соли кальция и магния присутствуют в незначительном количестве, поэтому мягкие воды способны растворять Са(ОН)2, образующий кристаллический сросток цементного камня, что и приводит к его разрушению.
Коррозия водами, содержащими агрессивную углекислоту. При наличии в природных водах агрессивной углекислоты, способной реагировать с СаСО3, гидрат окиси кальция также растворяется (выщелачивается) по реакциям:
Са(ОН)2 + СО2 = СаСО3 + Н2О
и затем
СаСО3 + СО2 + Н2О = Са(НСО3)2.
Образовавшийся бикарбонат кальция хорошо растворяется в воде, причем растворяющее действие воды тем больше, чем выше содержание в ней агрессивной углекислоты и чем меньше временная жесткость воды.
Коррозия водами, содержащими сульфаты. Часто природные воды содержат соли серной кислоты - сульфаты. Разрушение бетонов на портландцементе водами, содержащими сульфаты, вызывается следующими причинами.
1. Гидрат окиси кальция Са(ОН)2 вступает с сульфатами в обменную реакцию:
Са(ОН)2 + MgSO4 + 2Н2О = CaSO4 2Н2О + Mg(OH)2.
Образующийся гипс реагирует с гидроалюминатом кальция, находящимся в цементном камне, по уравнению
3(CaSO4·2H20) + ЗСаО·А12О3·6Н2О + 19Н2О = = 3CaO·AI2O3·3CaSO4·31H2O.
Образование нового соединения - гидросульфоалюмината кальция сопровождается значительным увеличением объема твердой фазы цементного камня, что приводит к возникновению в нем внутренних напряжений и в дальнейшем к разрушению бетона. При наличии в воде значительного количества хлоридов гидросульфоалюминат кальция не образуется, поэтому агрессивность воды определяется по содержанию в ней ионов SO-24с учетом количества ионов хлора.
2. При достаточно высокой концентрации сульфатов в агрессивных водах в порах бетона в результате обменных реакций образуется гипс CaSO4·2H2O. Разрушение цементного камня в этом случае вызывается кристаллизационным давлением растущих кристаллов двуводного гипса
Магнезиальная коррозия. Воды с содержанием катионов Mg2+ свыше 5000 мг/л агрессивны по отношению к бетонам на портландцементе. Соли магния, проникая в бетон, взаимодействуют с Са(ОН)2 по реакции
MgCl2 + Са(ОН)2 = Mg(OH)2 + СаС12.
При этом труднорастворимый гидрат окиси магния осаждается в порах бетона, а СаС12 вымывается, что приводит к разрушению цементного камня.
Коррозия водами, содержащими свободные кислоты. При наличии в воде свободных кислот растворение Са(ОН)2 значительно ускоряется, так как, кроме физического растворения, при этом происходит и химическое взаимодействие:
Са(ОН)2 + 2НС1 = СаС12 + 2Н2О.
Дата добавления: 2017-09-01; просмотров: 2926;











