СОЕДИНЕНИЯ АЛЮМИНИЯ
Оксид алюминия А12О3 Тривиальные названия: глинозем (мелкокристаллический), корунд (крупнокристаллический).
Получение. Переработка бокситов — руды, содержащей АlО3 (технология выделения алюминия из глины, содержащей очень много различных примесей, отсутствует). Вскрытие бокситной руды проводят двумя способами: мокрым и сухим.
1. Мокрый способ (способ Бауэра)—нагревание руды в автоклаве с 40%-ным раствором гидроксида натрия (условия процесса: 0,5 МПа, 160°С, 6 – 8 ч). Продукт — щелочной раствор, содержащий Na[А1(ОН)4]; красный шлам — нерастворимые примеси, главным образом FеО(ОН), а также ТiO2 (который выделяют как ценный побочный продукт, он используется для очистки городского горючего газа от серы).
Из щелочного раствора Nа[А1(ОН)4] выделяют аморфный осадок А1(ОН)3 введением при перемешивании затравки кристаллического гидрок-сида алюминия (минерал гиббсит, или гидраргиллит). Маточный раствор после отделения примесей V2О5, Gа2О3 и концентрирована возвращают на стадию вскрытия боксита.
Конечный продукт А12О3 получают прокаливанием А1(ОН)3 во вращающихся трубчатых печах при 1300 °С.
2. Сухой способ (для силикатосодержащих бокситов) — прокаливание руды со смесью Nа2СО3 и СаСО3 во вращающихся печах. Алюминий переводят в раствор в виде тетрагидроксоалюминат (III)-ионов [А1(ОН)4]-, которые разлагают, пропуская через раствор диоксид углерода: [А1(ОН)4]- + СO2 = А1(ОН)3 + НСО3-.
Из полученного гндроксида алюминия прокаливанием выделяют Аl2Оз.
Свойства.Белый порошок или очень твердые белые кристаллы; т. пл. 2055°С. После прокаливания не реагирует ни с кислотами, ни с основаниями.
Применение.Основная область применения — производство алюминия. Используется также как полировальный порошок для металлов, катализатор и носитель катализаторов, адсорбент в хроматографическом анализе, абразивный материал (так называемый электрокорунд).
Синтетические монокристаллы оксида алюминия — чистейший А12Оз — используются в качестве опоры осей в часах, для изготовления лазеров. Некоторые из них, окрашенные примесями других оксидов металлов, применяются в ювелирном деле как синтетические драгоценные камни (синтетические рубины, сапфиры и др.). Монокристаллы А12О3 получают плавлением глинозема в водородно-кислородном пламени; расплав стекает по шамотному стержню, на конце которого он кристаллизуется.
Гидроксид алюминия А1(ОН)3
Получение и свойства. Осаждается из растворов солей алюминия при добавлении гидрата аммиака: А1С13 + 3(NH3*Н2О) = А1(ОН)3 + 3NH4С1 или гидроксида натрия, взятого в недостатке: А12(SО4)3 + 6NаОН = 2А1(ОН)3 + 3Nа2SО4.
При добавлении избытка NаОН амфотерный гидроксид алюминия снова переходит в раствор (в виде аниона): А1(ОН)3 + NaОН = Ка[А1(ОН)4].
При осторожном подкислении полученного раствора снова выпадает осадок гидроксида, который исчезает при введении избытка кислоты алюминий переходит в гидратированный катион [А1(Н2О)6]3+. В этом проявляется амфотерность гидроксида алюминия:
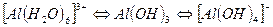
Применение.Промежуточный продукт при получении алюминия, при синтезе органических лаковых красок (содержащих органические красители и пигменты), в медицине как средство против повышенной кислотности желудочного сока.
Сульфат алюминия А12(SО4)3*18Н2О – белые кристаллы. Хорошо растворим в воде, водный раствор имеет (из-за гидролиза по катиону) кислую реакцию. Применяется как коагулирующее средство при очистке воды, причем одновременно устраняется временная жесткость воды: А12(SО4)3 + 3Са(НСО3)2 = 3СаSО4 + 2А1(ОН)3 + 6СО2.
Используется также в процессе проклейки бумаги, например, канифольным мылом — натриевой солью абиетиновой кислоты Nа(С19Н29СОО), в крашении и других производствах.
Сульфат алюминия-калия КА1(SО4)2*12Н2О, тривиальное название алюмокалиевые квасцы (часто просто квасцы) — белая, легко кристаллизующаяся двойная соль. Применение такое же, как и сульфата алюминия.
Ацетат алюминия А1(СН3СОО)3 — водный раствор этой соли (с примесями продуктов гидролиза) имеет традиционное название уксуснокислый глинозем. Применяется для огнезащитной и водонепроницаемой пропитки тканей.
Хлорид алюминия А1С13 — белое кристаллическое вещество, сильно раздражающее кожу. Сублимируется при 183°С. «Дымит» во влажном воздухе вследствие гидролиза. Из воды кристаллизуется гексагидрат А1С13*6Н2O. Используется как катализатор, например, в синтезах Фриделя – Крафтса, в реакциях дегидрирования и конденсации, в качестве переносчика галогена в органической химии.
Аланаты — групповое название гидридокомплексов алюминия. К ним относится, например, аланат лития Li[А1Н4], широко использующийся в органической химии как мягкий восстановитель.
Триэтилалюминий А1(С2Н5)3 — жидкость, т. кип. 194°С. Самозоспламеняется на воздухе. Получают из алюминия, водорода и этилена. Реагирует со взрывом с водой: А1(С2Н5)3 + 3Н2O = А1(ОН)3 + 3С2Н6
Используется в виде комплексов с соединениями d-элементов, например с хлоридом титана (IV) Т1С14, в качестве катализаторов Циглера при получении полиэтилена низкого давления.
Дата добавления: 2021-09-07; просмотров: 575;











