Ионообменная сорбция.
1. В системах с очень развитой поверхностью раздела фаз большое значение имеют поверхностные явления. Как показали исследование, они зависят от природы вещества и величины поверхности.
Рассмотрим поверхностную энергию для коллоидных (высокодисперсных) систем, они обладают большой суммарной поверхностью частиц дисперсной фазы. Например получая коллоидный раствор дроблением 1см3 твердого тела, суммарный объем частей остается прежним, а суммарная поверхность быстро увеличивается (если 1см3 раздробить до 0,0000001см. частичен то S=60000000 см3 или 0,6га.).
Такое огромное увеличение S поверхности приводит к увеличению и поверхностной энергии.
Поверхностная энергия выражается формулой: ЕS=sS, s - поверхностное натяжение.
Опыт показывает, что чем выше степень дисперсности данного тела, тем больше частичек другого тела оно может поглотить своей поверхностью. Такой процесс самопроизвольного поглощения, поверхностью твердого тела жидкости или газа носит название сорбции. Поглощающее вещество – называется сорбент, а поглощаемое – сорбтив.
Как известно поверхность, независимо от агрегатного состояния разделяемых его вещество, обладает некоторым запасом свободной энергии. В силу IIго начала термодинамики поверхность раздела двух веществ (как и любая система, обладающая запасом свободной энергии) стремится к самопроизвольному уменьшению этой энергии, это и является причиной многих физических процессов, в том числе и абсорбции.
Как показали исследования на абсорбенте не закреплены жестко. Они могут отрываться от абсорбента и уходит от поверхности. Процесс обратной сорбции, называется десорбцией. Процессы сорбции и десорбции одновременен, они приводят систему в состояние абсорбционного равновесия абсорбция « десорбция.
2. В зависимости от того насколько глубоко проникают частицы сорбтива в сорбент процесс сорбции, подразделяется на адсорбцию – поглощением поверхностью (соответственно вещество на поверхности которого происходит накопление другого вещества- называется адсорбент, а поглощаемое вещество – адсорбтив) и абсорбцию – поглощение всем объемом (абсорбент и абсорбтив соответственно).
В зависимости от характера взаимодействия частиц сорбента и сорбтива сорбция бывает физическая сорбция – (взаимодействие проявляется силами Ван-дер-Ваальса) и химическая – хемосорбция (когда происходит химическое взаимодействие между сорбентом и сорбтивом).
Наиболее важным из перечисленных выше процессов является физическая адсорбция. Адсорбция – это процесс самопроизвольного изменения концентрации вещества у поверхности раздел двух фаз, или повышение концентрации одного вещества у поверхности разделов двух фаз, из которых одна обычно твердое тело. Количество молей поглощенного в веществе на 1см2 поверхности адсорбента называется удельной абсорбцией:
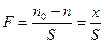
На практике абсорбцию выражают в молях на 1г абсорбента: Г = х/т. Связь между этими выражениями: Г=F*S0.
Величина удельной адсорбции для данного адсорбента зависит от Т и Р – если адсорбтив газ и от Ти С – если адсорбтив жидкость.Ö
Процесс адсорбции экзотермичен Þ в соответствии с принципом Ле-Шателье его выгодно проводить при низких t0. Кроме того абсорбция обладает чрезвычайно малой энергией активации (низким энергиям) барьером, а следовательно большой скоростью протекания.
Чаще всего адсорбция носит избирательный характер. Например активированный уголь хорошо поглощает аммиак и Cl2, но не абсорбирует СО2.
3. Данный вид адсорбции является простейшим случаем адсорбционного процесса.
Опыт показывает, что при равных для данного адсорбента и данного газа условиях, количество поглощаемого веществ будет возрастать по мере увеличения площади адсорбционной поверхности.
Кроме этого следует отметить, что величина адсорбция зависит не только от природы поглотителя, но и от природы поглощаемого газа, было установлено, что легче поглощаются те газы, которые легче конденсируются (выше t0k).
Механизмом этой абсорбции описывается теорией Ленгмюра:
1. Адсорбция осуществляется валентными силами.
2. Адсорбция происходит не на всей поверхности, а на активных центрах (выступы, углубления и т.п.).
3. Адсорбируемые силы обладают малым радиусом действия (1 центр – 1 молекула).
4. Аддсорбируемые молекулы не сидят прочно на центре, они непрерывно обмениваются с окружающей средой.Ö
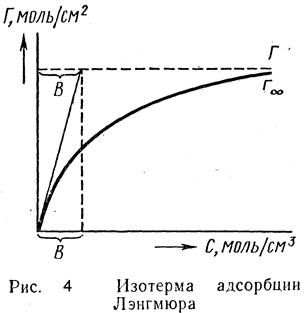
Для любого адсорбируемого газа при t0=const, через некоторое время над адсорбентом устанавливается предельная величина абсорбции, отвечающая равновесию между обеими фазами. Кривая зависимость адсорбции от t0=const называется изотермой адсорбции (рис.1).
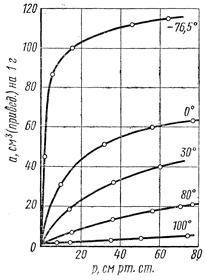 рис.1
рис.1
| Как видно из рисунка повышение Р газа увеличивает его количество которое абсорбируется. Последняя зависимость наиболее явно наблюдается в области низких давлений. При высоких давлениях кривая зависимость адсорбции от давления стремится к прямой параллельной оси абсцисс. В этом случае достигнуто полное насыщение адсорбента и повышение давления уже не влияет на абсорбцию газа. Между адсорбцией и давлением отсутствует прямая зависимость, но она описывается эмпирическим уравнением Фрейндриха: X/m=KP1/n, где x/m- величина адсорбции на единицу веса адсорбента, Р- равновесное давление газа, К и 1/n- константы адсорбции характерные для данного процесса адсорбции. ÖСлайд № 4 |
4. На границе твердое тело – раствор различают два вида адсорбции:
- молекулярную – адсорбцию не электролитов, молекул адсорбтива;
- ионную – когда адсорбент избирательно поглощает из раствора один вид из ионов.
При протекании молекулярной адсорбции из раствора вместе с молекулами растворенного вещества адсорбируется и молекулы растворителя. Количество и тех и других молекул, адсорбированных твердым адсорбентом, зависит от их собственной адсорбционной способности. Причем, при малых концентрациях преобладает адсорбция молекул растворенного вещества, при больших – растворителя.
график зависимости удельной адсорбции от концентрации адсорбтива в растворе представлен на рис. 2.
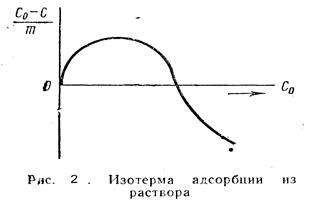
| Где: 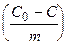 – удельная адсорбция; С0 – концентрация растворенного вещества до адсорбции, С – после абсорбции, m – масса адсорбента.
ÖСлайд № 5 – удельная адсорбция; С0 – концентрация растворенного вещества до адсорбции, С – после абсорбции, m – масса адсорбента.
ÖСлайд № 5
|
П.А. Ребиндер предложил правило согласно которому адсорбция будет идти, если полярность вещества В, характеризуемая диэлектрической проницаемостью Ев, будет находиться между полярностью вещества А и С(ЕА>Eв>Ес или ЕА<Ев<Ес). Ö
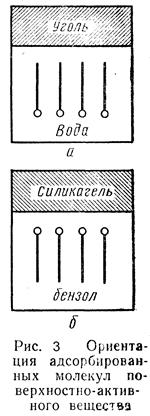 Ö Слайд № 7
Ö Слайд № 7
| На основании правила уравнения полярностей П.А. Ребиндера можно сделать вывод о том, что чем больше разность полярностей между растворимым веществом и раствором, т. е. чем меньше растворимость растворенного вещества, тем лучше оно будет адсорбироваться. Правило распределения полярностей разъясняет порядок ориентации молекул поверхностно-активных веществ на границе раздела твердое тело — жидкость. При этом полярная часть молекулы поверхностно-активных веществ будет обращена к полярной фазе, а неполярная часть — к неполярной. Так, при адсорбции из растворов поверхностно-активных веществ углем или силикагелем имеет место различная ориентация молекул адсорбтива. При адсорбции углем к гидрофобной его поверхности обращена неполярная гидрофобная цепь углеродных атомов, а гидрофильная часть молекулы погружена в воду (рис. 3а). При адсорбции поверхностно-активных веществ из неполярных растворителей, силикагелем адсорбируемые молекулы своей гидрофильной частью ориентированы к поверхности адсорбента, а своей гидрофобной углеводородной частью направлены внутрь растворителя (рис. 3 б). Таким образом, все гидрофильные вещества (силикагель, глины) хорошо адсорбируют поверхностно-активные вещества из неполярных или слабо полярных жидкостей. Все неполярные гидрофобные вещества (уголь, графит, тальк, парафин), наоборот, хорошо адсорбируют поверхностно-активные вещества из полярных жидкостей, например, из водных растворов. |
5. На твердом адсорбенте возможны три случая адсорбции:
1. Адсорбция положительная, вещество адсорбируется в большем количестве чем растворитель.
2. Отрицательная, когда больше адсорбируется растворитель.
3. Отсутствие адсорбции, когда концентрация растворенного вещества остается одинаковой и на поверхности и в объеме раствора.
Наибольший практический интерес представляет 1-й случай.
К поверхности твердое тело – жидкость применимо уравнение Ленгмюра:
Предположим, что число активных мест на поверхности равно единице, доля активных мест связанных с адсорбированными молекулами – Х Þ число свободных мест =1-х обозначим величину абсорбции через Г и учитывая, что при х=0 Г=0 и при Х=1Г=¥ будет х=г/ г¥, где Г¥ - количество вещества адсорбированного единицей поверхности при полном насыщении.Ö
 Ö Слайд № 9
Ö Слайд № 9
| При постоянной t0 на твердой поверхности адсорбента устанавливается подвижное равновесие, при котором скорость адсорбции Va равна скорости десорбции: Va=KaC(1-x) и V¶ =K¶ X, при равновесии: Va=V¶ или КаС(1-х)=К¶х Þ Х= 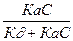  Þ Х= Þ Х= 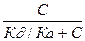 , отсюда: К¶/Ка обозначим через В, а х заменим на Г/Г¥= , отсюда: К¶/Ка обозначим через В, а х заменим на Г/Г¥= 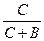 Þ Г=F¥ Þ Г=F¥ 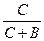 . Последнее уравнение есть изотерма адсорбции Ленгмюра рис. 4. В области малых концентраций когда С®0 (С<<В) можно записать . Последнее уравнение есть изотерма адсорбции Ленгмюра рис. 4. В области малых концентраций когда С®0 (С<<В) можно записать 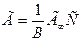 . Следует еще раз отметить, что по теории Ленгмюра адсорбированные молекулы между собой не реагируют. . Следует еще раз отметить, что по теории Ленгмюра адсорбированные молекулы между собой не реагируют.
|
6. Адсорбция ионов сильных электролитов протекает под воздействием двух родов сил: молекулярно-поверхностных (адсорбента) и электрических сил. Обычно различают три типа ионообменной адсорбции:
1. Эквивалентная адсорбция – эквивалентное поглощение и катионов, и анионов (молекулы поглощаются целиком), характерна для слабых электролитов.
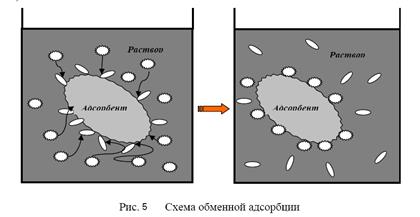
2. Обменная адсорбция – избирательное поглощение одного из ионов электролита, сопровождаемое одновременным эквивалентным вытеснением другого иона, того же знака (рис. 5)
 Ö
Ö
В зависимости от того, происходит ли обмен катионами или анионами, различают катионообменную или анионообменную сорбцию. В настоящее время известно сравнительно большое число веществ, обладающих свойствами обмена либо катионов, либо анионов. Ввиду большой практической важности ионообменной адсорбции промышленность производит специально так называемые ионообменные смолы, при помощи которых можно изменить состав ионов исследуемого раствора.
Ионообменные смолы, или иониты, разделяют на две группы: катиониты, обладающие свойством обменивать свои катионы на катионы солей, и аниониты, обменивающие собственные анионы на анионы солей, присутствующие в растворе. Катиониты содержат в своем составе активные кислотные группы типа:
—S03Н; —CH2 SO3 H; —COOH и др.
Водород этих групп способен к обмену на другие катионы.
Сущность катионного обмена можно выразить следующей схемой:
а) со щелочью R-H+ + Na+OH ↔ R-Na+ + H2O
б) с солью 2R-H+ +Ca2+ Cl2 ↔ R2Ca2+ + 2H+Cl,
где R — сложный анион синтетической смолы, причем, чем выше положительный заряд иона, тем лучше он поглощается катионитом.
Аниониты имеют в своем составе активные основные группы:
R–OH; –NH2; =NH; ≡N и др.
Механизм обмена анионов на этих смолах еще достаточно не изучен. Видимо, обменными анионами могут быть ионы гидроксила, образующиеся на поверхности смолы в процессе ее гидратации.
В общем виде сущность анионного обмена можно представить схемати-
чески:
а) с кислотой R-OH + НС1 ↔ R-C1 + Н20
б) с солью 2R-OH + Na2SO4, ↔ R2SО4 + 2NаОН.Ö
Обменную адсорбцию описывает уравнение Б.П. Никольского:
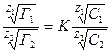
где: Г1 и Г2 – количества поглощенных ионов (мг-экв) на 1г. адсорбента; С1 и С2 – концнтрации (активности) ионов в растворе; Z1 и Z2 – валентности ионов; К – константа обмена.
3. Специфическая(избирательная) адсорбция – адсорбируются только ионы одного вида. Например только Са2+, на твердой поверхности адсорбента преимущественно адсорбируются ионы, входящие в состав адсорбента, или имеющие общую с данной поверхностью атомную группировку (или изоморфную с ней).
Это вид сорбции играет большое значение в коллоидных системах при образовании двойного электрического слоя.Ö
Дата добавления: 2022-05-27; просмотров: 180;











