Методы очистки коллоидов.
Гидрофобные золи и растворы ВМС при их образовании почти всегда "загрязняются" различными примесями, чаще всего электролитами. Часто в системе присутствует исходный электролит. Для повышения устойчивости коллоидных растворов необходимо удалить из них эти примеси.
Основные методы очистки золей и ВМС:
1)Диализ – это процесс очистки коллоидов от примеси способных проникать через полупроницаемые мембраны (Частицы золя значительно крупнее, чем молекулы и ионы примесей, поэтому через поры не проходят) (рисунок 1).Ö
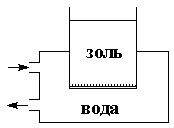
|
| Рис. 1 диализатор |
2) Электродиализ – это ускоренный вариант Диализа, с применением электрического тока (Ускоренное направление движение ионов к соответствующим электродам) (рисунок 2).Ö
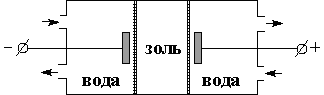
|
| Рис 2. электродиализатор |
3) Ультрафильтрация – фильтрование растворов, через полупроницаемые мембраны, укрепленные в специальных ультрафильтрах (срисунок 3).Ö
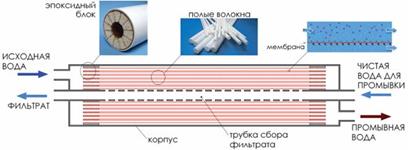
Рис. 3. Устройство и внешний вид половолоконного ультрафильтрационного модуля.
4) Электроультрафильтрация – совмещение ультрафильтрации и электродиализа.
2. Электрокинетические явления в коллоидных системах и связанные с этими явлениями наличие электрических зарядов у коллоидов открыл Ф. Рейсс. Он провел следующий опыт
(Рис. 4):Ö
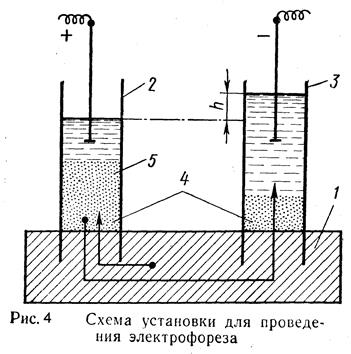
| В кусок влажной глины (1) были вставлены две стеклянные трубки (2 и 3). В цилиндры насыпали кварцевый песок (4) и налили в них до одинакового уровня воду. Опустив в воду электроды и подав на них электрический ток, через некоторое время под влиянием электрического поля частицы глины отрываясь от поверхности, будут проходить через песок и двигается к положительному полюсу образуя хорошо заметную муть (суспензию) (5), следовательно частицы глины заряжена отрицательно. Одновременно в цилиндре с (-) электродом (катодом) уровень воды поднялся, а в цилиндре с (+) полюсом опустился, что свидетельствует о положительном заряде воды. |
Дальнейшие изучение этих явлений показало, что они характерны для всех коллоидных систем. Движение частиц дисперсной фазы в электрическом поле к противоположно заряженному электроду получило название электрофореза.
Для определения причины поднятия воды в цилиндре с (-) полюсом, был поставлен следующий опыт. (рисунок 5).Ö
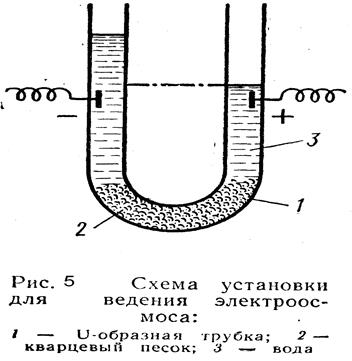
| Через U-образную трубку (1), средняя часть которой была заполнена кварцевым песком (2), пропускали электрический ток. После включения тока в колене с (-) электродом уровень воды поднялся, а в колене с (+) опустился. Это продолжалось до тех пор, пока разность уровней не достигла определенного значения. Причем количество перенесенной жидкости находится в прямой зависимости от приложенной разности потенциалов и диэлектрической проницаемости и обратно пропорционально вязкости этой среды. Процесс переноса жидкости через пористые диафрагмы и узкие капилляры получил названии электроосмос. |
Позднее были открыты еще два электрокинетических явлений, противоположных выше указанным.
Первое явление: При механическом проталкивании воды через пористую диафрагму или через капилляр, на противоположных сторонах диафрагмы (капилляра) появляется разность потенциалов, препятствующая протеканию жидкости. Это явление носит название эффект протекания, а разность потенциалов на диафрагме – потенциал протекания.
Другое явление заключается в возникновении скачка потенциала, при механическом передвижении твердой части в жидкой фазе. Указанное явление (обратное электрофорезу) получило название эффекта седиментации, а скачек потенциала – потенциалом седиментации.
Таким образом электрокинетические явления можно обобщить следующим образом: а)э.д.с приложена извне:
1) Электрофорез – твердая фаза движется по отношению жидкой неподвижной;
2) Электроосмос – жидкая фаза движется относительно твердой неподвижной.
Б) Передвижение вызывает э.д.с:
1) Потенциал седиментации – твердая движется относительно жидкой.
2) Потенциал протекания – жидкая движется относительно твердой.
3. На основе изучения электрокинетического явления в коллоидных системах было установлено, что у поверхности коллоидных частиц на границе раздела фаз образуется двойной электрический слой и возникает скачек потенциала. Это обусловлено тем, что ионы одного знака необменно абсорбируются на поверхности абсорбента, а ионы противоположного знака в силу электростатического притяжения располагаются около нее. Знак заряда поверхности зависят от природы твердых частиц и от природы жидкости. Кроме того, заряд может возникнуть в результате диссоциации молекул поверхности частицы, ионы одного знака остаются фиксированными на поверхности, а другого уходят в раствор. Схема двойного электрического слоя рис. 6.Ö
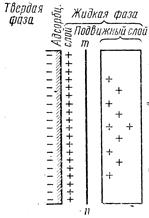 Рис. 6.
Рис. 6.
| Согласно теории двойного электрического слоя можно объяснить электрокинетические явления: движение твердой фазы к одному (+) полюсу происходит с адсорбционным слоем (до линии mn), т.е. твердая фаза имеет (-) заряд. К другому (-) полюсу движется жидкость с частью противоионов (правее линии mn) Þ жидкость имеет (+) заряд.
Разность потенциалов между подвижной и неподвижной частями двойного электрического слоя называют электрокинетическим потенциалом (x).
Вычисление x проводят пользуясь данными электрофореза и проводят по формуле: 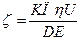 , ,
|
где: К- const, зависит от формы коллоидных частиц(сферы К = 6; цилиндры К = 4); h -вязкость среды; D- диэл-я постоянная; Е- градиент напряжения поля; U- средняя скорость движения частиц под действием электрического поля.
4. Для описания строения коллоидных частиц на основе двойного элнктрического слоя была создана мицелярная теория строения, она применила в основном только для гидрофобных золей.
Основные положения мицелярной теории:
- Каждый гидрофобный коллоидный раствор состоит из мицелл и интермицелярной жидкости.
- Мицеллы это отдельные коллойднные частицы, которые составляют дисперсную фазу золя.
- Интермицелярная жидкость – это дисперсионная среда того же золя, включающая в себя помимо растворителя и другие вещества (растворенные) входящие в состав мицеллы.
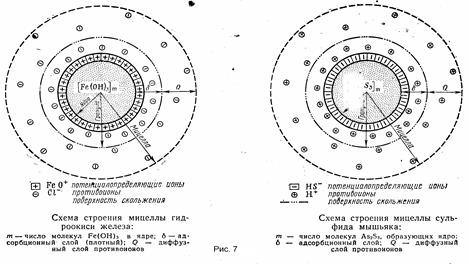
Коллоидная мицелла имеет значительно более сложное строение, чем обычные молекулы. В ней различают две основные части: внутреннюю — нейтральную, обычно называемую ядром, и внешнюю — ионогенную, в свою очередь, состоящую из двух слоев (двух ионных сфер).
Ядро составляет основную массу коллоидной мицеллы и представляет собой комплекс, состоящий из атомов или нейтральных молекул. Общее число входящих в состав ядра атомов или молекул огромно и зависит от степени дисперсности золя и от размеров самих атомов или молекул.
В процессе образования гидрофобного золя рост ядра в той или иной стадии может быть приостановлен созданием так называемого адсорбционного слоя из ионов стабилизатора. Ионная сфера вокруг ядра коллоидной мицеллы состоит из двух слоев – адсорбционного и диффузного. Адсорбционный слой слагается из слоя потенциалопределяющих ионов, адсорбированных на поверхности ядра и сообщающих ему свой заряд, и части противоионов, проникших за плоскость скольжения и наиболее прочно связанных электростатическими силами притяжения. Вместе с ядром эта ионная атмосфера образует многозарядный ион – катион или анион, называемый гранулой. Диффузный слой, расположенный за плоскостью скольжения, в отличие от адсорбционного не имеет в дисперсионной фазе резко очерченной границы. Этот слой состоит из противоинов, общее число которых равняется в среднем разности между всем числом потенциалопределяющих ионов и числом противоионов, находящихся в адсорбционном слое.
Гранула вместе с диффузным слоем противоинов составляет коллоидную частицу — мицеллу. Мицелла всегда электронейтральна. Необходимо отметить, что противоионами могут служить любые ионы тех электролитов, которые участвуют в реакциях при образовании данного золя или же присутствуют как посторонние примеси.
Пример строения мицеллы приведен на рисунке 7.Ö
Строение мицеллы принято выражать мицеллярными формулами:
- Положительно заряженная мицелла (n[ядро] m[Kat]+(m-x)[An]-)х+ х[An]-
- Отрицательно заряженная мицелла (n[ядро] m[An]-(m-x)[Kat]+)х- х[Kat]+
Мицеллярная формула коллоидного раствора полученного по реакции:
KI + AgNO3 ® AgI + KNO3
Может иметь вид
Если [KI] > [AgNO3]: [nAgI mI- (m-x)K+]x- xK+
Если [KI] < [AgNO3]: [nAgI mAg+ (m-x)NO3-]x+ xNO3-
Если [KI] = [AgNO3]: [nAgI mNO3- mK+]0
Исключения:
- гидрозоль железа, полученного гидролизом FeCl3:
FeCl3 + H2O ® Fe(OH)3 + 3H2O или
FeCl3 + H2O ® FeOCl + 2H2O –
[nFe(OH)3 mFeO+(m-x)Cl-]x+ xCl- или
[nFe(OH)3 mFe3+ 3(m-x)Cl-]3x+ 3xCl- или
[nFe(OH)3 mH+ (m-x)Cl-]x+ xCl- .
- строение золя кремневой кислоты: [nH2SiO3 mSiO32-2(m-x)H+]2x- 2xH+.
- золя золота полученный реакцией восстановления:
2KAuO2 + 3HCHO + K2CO3 ® 2Au + 3HCOOK + KHCO3 + H2O –
[nAu mAuO2- (m-x)K+]x- xK+
- золя серы полученный по реакции: 2H2S + O2 ® 2S + 2H2O –
[nS mS5O62- 2(m-x)H+]2x- 2H+.Ö
5. По оптическим свойствам коллоидные растворы существенно отличаются от истинных растворов низкомолекулярных веществ. Наиболее характерными оптическими свойствами коллоидных систем являются опалесценция, эффект Фарадея-Тиндаля и окраска.
Опалесценция (рис. 8).Ö
В зависимости от длины волны видимого света и относительных размеров частиц дисперсной фазы рассеяние света принимает различный характер.
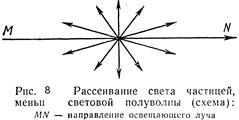
| Если размер частиц превышает длину световых волн, то свет от них отражается. При этом часть светового излучения может испытывать преломление, внутреннее отражение и поглощаться. |
Если размер частиц меньше длины полуволны падающего света, наблюдается дифракционное рассеяние света; свет как бы обходит (огибает) встречающиеся на пути частицы. При этом имеет место частичное рассеяние в виде волн, расходящихся во все стороны (рис. 8). В результате рассеяния света каждая частица является источником новых, менее интенсивных волн, т. е. происходит как бы самосвечение каждой частицы. Явление рассеяния света мельчайшими частицами получило название опалесценции. Оно свойственно преимущественно золям (жидким и твердым), наблюдается только в отраженном свете, т. е. сбоку или на темном фоне. Выражается это явление в появлении некоторой мутноватости золя и в смене («переливах») его окраски по сравнению с окраской в проходящем свете. Окраска в отраженном свете, как правило, сдвинута в сторону большей частоты видимой части спектра. Так, белые золи (золь хлорида серебра, канифоли и др.) опалесцируют голубоватым цветом.
Эффект Фарадея- Тиндаля (рисунок 9).Ö
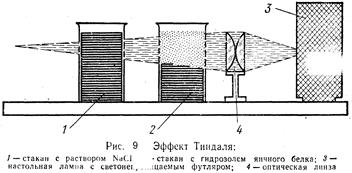
| При прохождении света через стакан с золем наблюдается световая дорожка в виде конуса, в истинных растворах такого эффекта нет. Появление конуса объясняется рассеянием света коллоидными частицами, размер которых меньше длины волны. Этот эффект идентичен опалесценции, единственное отличие в микрогенности системы. |
Окраска.
Зависимость интенсивности рассеянного свет (I) при выше указанных эффектах выражается формулой Рэлея: 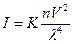
 где :I – и интенсивность рассеянного света в направление ┴ падающему лучу; К – const включающая показатель преломления среды и фазы, n – число частиц в единицу объема, l – длина волны падающего света,
где :I – и интенсивность рассеянного света в направление ┴ падающему лучу; К – const включающая показатель преломления среды и фазы, n – число частиц в единицу объема, l – длина волны падающего света,
V – объем каждой частицы.Ö
Из формулы видно I 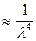 , что рассеяние более коротких волн происходит более интенсивно, следовательно, бесцветные золи в проходящем свете кажутся красными, а в рассеянном – голубыми.
, что рассеяние более коротких волн происходит более интенсивно, следовательно, бесцветные золи в проходящем свете кажутся красными, а в рассеянном – голубыми.
6. Коллоидные растворы сравнительно мало устойчивы по сравнению с молекулярными растворами. Под влиянием различных факторов(t0,h V, электричества, 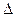 С, механического воздействия, присутствие примесей), а иногда и просто без видимых причин в коллоидных системах протекают необратимые процессы, приводят к изменениям частиц дисперсной фазы и их выпадению в осадок. Такие процессы, приводящие, к самопроизвольному укреплению частиц называют старением.
С, механического воздействия, присутствие примесей), а иногда и просто без видимых причин в коллоидных системах протекают необратимые процессы, приводят к изменениям частиц дисперсной фазы и их выпадению в осадок. Такие процессы, приводящие, к самопроизвольному укреплению частиц называют старением.
Хотя для коллоидных систем мы можем говорить только об относительной устойчивости Н.П. Песков ввел в науку понятия о кинетической и агрегативной устойчивости.
Кинетическая устойчивость- способность дисперсных частиц удерживаться во взвешенном состоянии под влиянием броуновского движения. Кроме броуновского движения факторами кинетической устойчивости является дисперсность, вязкость дисперсной среды, разность плотности дисперсной среды и фазы и т.д. Из всех факторов наиболее важный – дисперсность так как он оказывает наибольшее влияние на скорость осаждения частиц. Системы в которых скорость осаждения очень мала называются кинетически устойчивыми.
Агрегативная устойчивость – способность частиц дисперсной фазы оказывать сопротивление их слипанию и тем самым удерживать определенную степень дисперсности. Потеря агрегативной устойчивости ведет к слипанию частиц с образованием более крупных агрегатов.
Агрегатная устойчивость объясняется наличием у коллоидных частиц одноименных зарядов, которые мешают их соединению, а так же наличием вокруг ядра сольватных оболочек из молекул растворителя. Установлена прямая зависимость между толщиной сольватных оболочек и агрегативной устойчивостью.
Характерной особенностью коллоидных растворов являются процессы самопроизвольного изменения размеров частиц: размер может уменьшаться в следствии неполного растворения частиц дисперсной фазы Þ уменьшение удельной поверхности дисперсной фазы Þ уменьшение свободной энергии – процесс дессолюции; или укрупняться – процесс перекристаллизации.
7. Коллоидные системы обладают большой поверхностью раздела и следовательно избытком свободной энергии. Поэтому эти системы не устойчивы, они стремятся к понижению свободной энергии, и это происходит в большинстве случаев за счет уменьшения суммарной поверхности коллоидной частиц, т.е. за счет их укрепления. Этот процесс укрепления коллоидных частиц, носит название коагуляции. Процесс осаждения укрупненных частиц твердой фазы называется седиментацией.
Процесс коагуляции состоит из двух стадий: скрытую коагуляцию – процесс коагуляции не обнаруживается визуально и явную коагуляцию – легко обнаруживается визуально.
Наиболее важным фактором коагуляции гидрофобных золей является действие электролитов. Почти все электролиты в достаточном количестве способны вызвать коагуляцию. Что бы вызвать коагуляцию нужно наличие некоторой минимальной концентрации электролита. Минимальная концентрация электролита способная вызвать коагуляцию получила название порог коагуляции. Установлено, что коагулируещее действие оказывает ион, заряд которого по знаку противоположен заряду поверхности коллоидной частицы. Так для (+) заряженных золей коагулирующие действия оказывают анионы, для (-) – катионы. Кроме того, ионы коагуляторы высшей зарядности обычно вызывают коагуляцию при значительно меньших концентраций, чем ионы низших (правило Шульце-Гатди).
Пороги коагуляции одного знака тоже отличаются друг от друга по коагулирующей способности для них составлены так называемые лиотропные ряды:
Катионы: Сs+>Rb+>NH4+>K+>Na+>Li+ ; анионы: I->NO3->Fr—>Cl-Ö
Коагулирующее действие может вызвать и смесь электролитов. При этом возможны три случая:
1) Коагуляционные действие суммируется;
2) Коагуляционные действие, чем по отдельности - антогонизм;
3) Взаимное усиление коагуляционного действия - синергизм.
Коагуляцию может вызвать смешивание в определенном соотношении гидрофобного золя с другими гидрофобным золем гранулы которого имеют противоположный заряд, это явление носит название взаимная коагуляция. Взаимная коагуляция возможна из-за отсутствия отталкивания между противоположно заряженными мицеллами.
8. Как известно, гидрофобные коллоиды неустойчивы в изоэлектрическом состоянии, т. е. электронентральные частицы коагулируют с наибольшей скоростью.
На рис. 10 показана схема снятия заряда с коллоидной частицы при добавлении электролита с двухзарядными анионами.Ö
Как видим, гранула становится электронейтральной в том случае, если противоионы диффузного слоя, заряженные отрицательно, перемещаются в адсорбционный слой. Чем выше концентрация прибавляемого электролита, тем сильнее сжимается диффузный слой, тем меньше становится x-потенциал и, следовательно, тем быстрее начинается процесс коагуляции. При определенной концентрации электролита практически все противоионы перейдут в адсорбционный слой, заряд гранулы снизится до нуля и коагуляция пойдет с максимальной скоростью, так как отсутствие диффузного слоя обусловит значительное понижение давления расклинивання.
Коагулирующее действие электролитов не сводится только к сжатию диффузного слоя, одновременно протекает избирательная адсорбция на коллоидной частице тех ионов электролита, которые имеют заряд, противоположный грануле. Причем чем выше заряд иона, тем интенсивнее он адсорбируется. Накопление ионов в адсорбированном слое сопровождается уменьшением не только x-потенциала, но и диффузного слоя.
Из всего вышесказанного не следует делать вывод о том, что основная причина коагуляции заключается в достижении некоторого постоянного для всех случаев критического x-потенциала. Исследования показали, что коагулирующее действие электролитов заключается не столько в непосредственном уменьшении сил отталкивания между коллоидными частицами через понижение x-потенциала, сколько в том, что изменение строения двойного электрического слоя и сжатие диффузной его части, влечет за собой понижение расклинивающего действия гидратных (сольватных) оболочек диффузных ионов, разъединяющих коллоидные частицы.
9. В ряде случаев при добавлении к золям электролитов с многозарядными ионами, заряд которых противоположен по знаку заряду коллоидных частиц, может наблюдаться не коагуляция, а стабилизация золя и перемена знака x-потенциала. Это явление получило название в коллоидной химии перезарядки золей. Так, при добавлении к золю платины небольших количеств хлорида железа FеС13 наблюдается понижение отрицательного заряда коллоидных частиц платины и их коагуляция. Дальнейшее увеличение концентрации FеС13 приводит к перезарядке коллоидных частиц платины; они получают положительный заряд.
В процессе перезарядки золь платины претерпевает следующие изменения: отрицательно заряженный золь – коагуляции нет; заряд равен нулю – коагуляция; положительно заряженный золь — коагуляции нет; заряд равен нулю – коагуляция и т. д. Такое чередование состояний электронейтральности и заряженности частиц называют чередованием зон коагуляции.
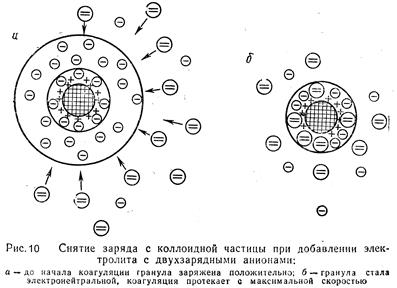
Явление перезарядки коллоидных мицелл золя платины под влиянием FеС13 хорошо видно на кривой изменения x-потенциала (рис. 11).Ö
| Здесь по оси абсцисс отложены значения концентраций прибавляемого электролита-коагулятора, а по оси ординат — измененные значения x-потенциала. Как видим, под влиянием электролита x-потенциал довольно резко уменьшается по абсолютной величине, затем, переходя через нулевое значение, получает положительное значение, которое по мере дальнейшего прибавления электролита проходит через соответствующий максимум и затем уменьшается. |
10.Поскольку коагуляция любого золя совершается не мгновенно, а требует некоторого промежутка времени, возник вопрос о скорости процесса коагуляции. Протекание процесса коагуляции во времени можно наблюдать по изменению свойств коллоидного раствора, например, по изменению окраски, по усилению мутности и т.п.
Многочисленные исследования показали, что наиболее надежным методом наблюдения процесса коагуляции во времени является метод подсчета числа частиц за определенный промежуток времени в ультрамикроскопе. Согласно теории коагуляции золей, началом коагуляции считают соприкосновение двух коллоидных частиц и слипание их в один агрегат. Эти удвоенные частицы, совершая броуновское движение и встречаясь с другими такими же или одиночными частицами, способны образовать тройные, четверные и т. д. частицы – вплоть до начала седиментации. Отличие от химических реакций с точки зрения кинетики заключается в том, что в случае обычной химической реакции прореагировавшие молекулы в дальнейшем не участвуют в реакции, а коллоидные частицы, слипаясь при столкновении, продолжают участвовать в процессе коагуляции, образуя все более сложные комплексы.
В начале коагуляции образование удвоенных, утроенных и т. д. частиц протекает незаметно и более медленно, затем по мере нарастания концентрации электролита-коагулятора скорость коагуляции значительно увеличивается. Таким образом, различают медленную и быструю коагуляцию. Эти понятия не следует смешивать с понятиями скрытой и явной коагуляции.
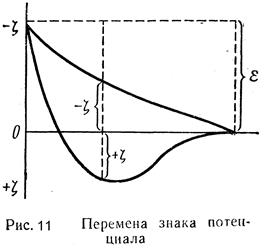
Кривая изменения скорости коагуляции золя в зависимости от концентрации электролита (рис. 12) хорошо поясняет эти понятия и их связь с другими величинами, характеризующими ход коагуляции. Ö
| На кривой OSKN отрезок OS отвечает периоду скрытой коагуляции; точка S выражает одновременно и порог коагуляции и критический потенциал, с которых начинается явная коагуляция; отрезок SK соответствует периоду медленной коагуляции, скорость которой быстро увеличивается с увеличением концентрации электролита, а затем достигает некоторой постоянной величины; точка К выражает не только концентрацию, вызывающую быструю коагуляцию, но и x-потенциал, равный нулю; отрезок КN соответствует быстрой коагуляции, независимой от концентрации прибавляемого электролита. |
Процессы медленной коагуляции весьма слабо изучены и в настоящее время. Предполагают, что медленное протекание процесса коагуляции обусловливается тем, что лишь очень небольшое число столкновений коллоидных частиц приводит к их слипанию (агрегации). Установлено, что слипаются лишь те частицы, у которых по какой-либо причине снизился до критического значения x-потенциал, или частицы, обладающие большой скоростью и при столкновении попадающие в сферу взаимного притяжения.
Процессы быстрой коагуляции изучены значительно лучше. При быстрой коагуляции каждое столкновение коллоидных частиц приводит к их слиянию (соединению). Исходя из этих представлений, М. Смолуховский вывел уравнение, характеризующее скорость быстрой коагуляции:
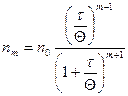
| где: nm – число частиц, каждая из которых состоит из m частиц за время коагуляции t, n0 – первоначальное число частиц, Q – время за которое число частиц уменьшилось вдвое. ÖСлайд № 28 |
11.Типичные гидрофобные золи легко коагулируют при прибавлении к ним малых количеств электролитов. Растворы высокомолекулярных соединений, наоборот, обладают большой устойчивостью против коагулирующего действия электролитов. Многочисленными исследованиями было установлено, что растворы ВМС, будучи прибавлены к гидрофобным золям, сообщают им повышенную устойчивость к электролитам. Так, если к золю золота прибавить небольшое количество желатина, гидрозоль золота становится более устойчивым. При прибавлении электролитов даже в количествах, значительно превосходящих порог коагуляции, а также при длительном стоянии этот золь не испытывает практически никаких изменений. Если этот золь выпарить, то при смешении сухого препарата с водой вновь образуется коллоидный раствор. Таким образом, типичный гидрофобный золь золота при прибавлении к нему желатина как бы приобрел свойства гидрофильного золя и стал обратимым. Подобное явление получило название защитного действия или просто защиты, а сами вещества, повышающие устойчивость гидрофобных золей, получили название защитных. Как правило, защитным действием обладают высокомолекулярные вещества лиофильной природы.
Исследования показали, что степень защитного действия растворов ВМС зависит от природы растворенного полимера и от природы защищаемого гидрофобного золя. Количественной мерой защитного действия растворов ВМС являются золотое, рубиновое и железное число. Наибольшее применение получило более простое и легко доступное железное число которое можно определить как минимальное число миллиграммов защищающего высокополимера, способного защитить 10 мл золя гидроокиси железа от коагулирующего действия 1 мл 0,005 н. раствора Na2SO4. (Желатин – 5; крахмал – 20).
Как показали исследования, наибольшее защитное действие отмечается при одноименных зарядах высокомолекулярного соединения и коллоида, так как в противном случае они взаимно нейтрализуют заряд, и устойчивость большого объединенного комплекса, естественно, снижается.
Механизм защитного действия достаточно хорошо объясняется теорией Зигмонди, в основе которой лежит представление об адсорбционном взаимодействии между частицами защищаемого и защищающего золей. Более крупная частица гидрофобного золя адсорбирует на своей поверхности более мелкие макромолекулы ВМС с их сольватными оболочками, и в результате этого она приобретает лиофильные свойства. В данном случае коллоидные мицеллы необратимого гидрофобного золя предохраняются от непосредственного соприкосновения друг с другом, а следовательно, и от агрегации как в случае действия на такой золь электролита-коагулятора, так и в случае концентрирования золя. На рис. 13а, б, показана схема подобного защитного действия. Ö
| Таким образом, высокомолекулярные соединения выступают в роли стабилизатора лиофобных золей. То, что именно явление адсорбции лежит в основе защитного действия, подтверждается не только избирательным характером взаимодействия между макромолекулами ВМС и мицеллами, но и тем, что степень защитного действия увеличивается с концентрацией защищающего раствора ВМС только до полного адсорбционного насыщения поверхности мицелл защищаемого золя. |
В некоторых случаях прибавление весьма малых количеств высокополимера к гидрофобному золю приводит к прямо противоположному результату: устойчивость золя резко понижается. Это явление называется сенсибилизацией или астабилизацией коллоидного раствора. Согласно теории П. Н. Песковаи Л. Д. Ландау астабилизация происходит тогда, когда защищающий высокополимер добавляют к гидрофобному золю в малых количествах, которые ниже предельного порога его защитного действия, т. е. ниже защитного числа. Иными словами, астабилизация наступает, когда частиц высокополимера не хватает на покрытие и защиту всей поверхности коллоидных частиц гидрофобного золя, но их достаточно для того, чтобы путем адсорбции отнять у последних стабилизирующие ионы. На рис. 10в, в дана схема астабилизированной коллоидной частицы. Астабилизация легче всего осуществляется в том случае, если оба вида частиц заряжены разноименно.
12.Часто продукт коагуляции гидрофобных золей – осадок, или коагель – может быть вновь переведен во взвешенное состояние путем обработки его определенным электролитом. Так, скоагулированный золь гидроокиси железа можно вновь вернуть в исходное состояние, если осадок Fе(ОН)3 обработать водным раствором хлорида железа. Процесс перехода осадка во взвешенное состояние под влиянием внешних факторов получил название пептизации.
Вещества, способствующие переходу коагеля в золь, называют пептизаторами. Обычно пептизаторами являются электролиты, вернее один из ионов. Однако в ряде случаев пептизирующим действием могут обладать и неэлектролиты, например растворитель.
Сам процесс пептизации в основном обусловливается адсорбционными явлениями, в результате которых происходит не только повышение x-потенциала дисперсных частиц, но и увеличение степени их сольватации (гидратации). Сообщение скоагулированным частицам дисперсной фазы золя заряда способствует, с одной стороны, общему разрыхлению осадка, с другой – переводу этих частиц во взвешенное состояние благодаря броуновскому движению. При этом происходит образование вокруг диспергируемых частиц сольватных оболочек, производящих свое расклинивающее действие.
Как и коагуляция, пептизация гидрофобных золей не затрагивает глубинных масс коллоидного ядра. Эти процессы протекают в тончайших слоях на поверхности раздела фаз, поэтому для пептизации требуются незначительные количества электролитов по сравнению с количеством осадка, переводимого в состояние золя (рисунок 14).Ö
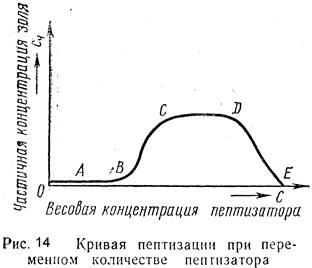
| Так, если брать одинаковое количество коагулянта и пептизировать его различным количеством пептизатора, то при малых количествах происходит лишь его адсорбция без растворения осадка (кривая ОА, рис. 14), при дальнейшем повышении концентрации пептизатора происходит и увеличение растворимости (кривая АВ). Если и дальше увеличивать количество пептизатора, растворимость, быстро увеличиваясь, достигает определенного предела и уже не зависит от количества пептизатора (кривые ВС и СD). При большом избытке пептизатора может наступить коагуляция (кривая DЕ). Рассмотренная нами кривая OD дает типичную картину адсорбционной пептизации. |
Помимо адсорбционной, различают еще диссолюционную пептизацию. Этот вид пептизации охватывает собой все случаи, когда процесс пептизации сопряжен с химической реакцией поверхностно расположенных молекул коллоидных мицелл.
При постоянном количестве пептизатора и возрастающем количестве коагеля пептизируемость последнего сначала возрастает, достигая максимума, затем уменьшается. Эта закономерность, установленная В. Оствальдом и А. Буцагом, получила название правила осадка.
Тиксотропия
Если к золю гидроксида железа прибавить какой-нибудь коагулятор (NаС1) в количестве, недостаточном для полной коагуляции, вязкость золя начнет заметно увеличиваться. С течением времени золь может превратиться в сплошной студень (гель). При сильном встряхивании гель вновь приобретает прежнюю легкоподвижность, вязкость его уменьшается до первоначального исходного значения. Однако стоит золь на некоторое время оставить в покое, он вновь превращается в студень. Это явление изотермического обратимого перехода золь « гель получило название тиксотропии.
Растворы ВМС
Дата добавления: 2022-05-27; просмотров: 82;










