Техническая термодинамика
Под нормальными физическими условиями понимаются следующие параметры: давление 760 мм. рт. ст. и температура 0ºС.
Соотношения шкал температур: 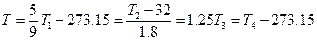 , где T – температура в градусах Цельсия,
, где T – температура в градусах Цельсия, 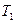 – в градусах Ренкина,
– в градусах Ренкина, 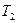 – Фаренгейта,
– Фаренгейта, 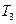 – Реамюра,
– Реамюра, 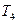 – Кельвина.
– Кельвина.
Соотношения шкал давлений: 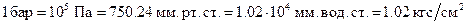 .
.
Удельный объём 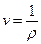 , где r – плотность.
, где r – плотность.
Термодинамической системой называется совокупность материальных тел, взаимодействующих как между собой, так и с окружающей средой. Если хотя бы один из параметров изменяется, то изменяется и состояние системы, т.е. осуществляется термодинамический процесс.
Типы процессов: изотермический 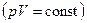 (Бойля-Мариотта), изобарический
(Бойля-Мариотта), изобарический 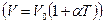 (Гей-Люссака), изохорический
(Гей-Люссака), изохорический 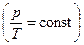 (Шарля), адиабатический
(Шарля), адиабатический 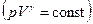 , политропный
, политропный 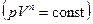 .
.
Закон Менделеева-Клапейрона: 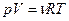 , где
, где 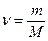 – количество молей вещества, m – масса газа, M –молярная масса,
– количество молей вещества, m – масса газа, M –молярная масса, 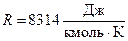 – универсальная газовая постоянная.
– универсальная газовая постоянная.
Чистое вещество – такое вещество, в котором все молекулы одинаковы.
Смесь, состоящая из нескольких чистых веществ называется раствором.
Массовая доля i-го компонента раствора 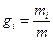 , где m – масса раствора; объёмная доля
, где m – масса раствора; объёмная доля 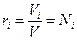 , где
, где 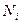 – молярная доля i-го компонента.
– молярная доля i-го компонента. 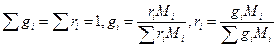 . Давление смеси
. Давление смеси 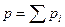 , где
, где 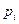 – давление i-го компонента (парциальное давление),
– давление i-го компонента (парциальное давление), 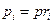 . Кажущаяся молярная масса
. Кажущаяся молярная масса 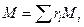 .
.
Теплоёмкость вещества – количество тепла, необходимая для нагрева его на 1 К.
Истинная теплоёмкость – теплоёмкость при данной температуре 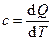 .
.
Удельная теплоёмкость вещества 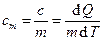 .
.
Средняя теплоёмкость 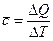 .
.
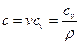 , где
, где 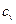 – объёмная теплоёмкость,
– объёмная теплоёмкость, 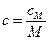 , где
, где 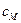 – молярная теплоёмкость,
– молярная теплоёмкость, 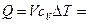
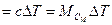 , здесь V – объём при нормальных температуре и давлении.
, здесь V – объём при нормальных температуре и давлении.
Внутренняя энергия и энтальпия тела как функции состояния
Внутренняя энергия тела складывается из поступательного и вращательного движения молекул, потенциальной энергии связей молекул, энергии колебаний молекул, внутриатомной и внутриядерной энергий. Внутренняя энергия обладает экстенсивным свойством, т.е. зависит от массы тела.
Энтальпия 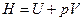 , где U – внутренняя энергия. Удельная энтальпия, соответственно,
, где U – внутренняя энергия. Удельная энтальпия, соответственно, 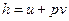 .
.
I закон термодинамики: 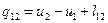 или
или 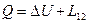 , где Q и q – обычное и удельное тепло, U и u = обычная и удельная внутренняя энергия,
, где Q и q – обычное и удельное тепло, U и u = обычная и удельная внутренняя энергия, 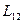 и
и 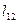 – обычная и удельная работа при переходе из первого состояние во второе. В дифференциальной форме:
– обычная и удельная работа при переходе из первого состояние во второе. В дифференциальной форме: 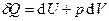 (здесь используется символ «d», т.к. тепло зависит также от способа его передачи, т.е. выражение справа не является полным дифференциалом тепла). Т.к.
(здесь используется символ «d», т.к. тепло зависит также от способа его передачи, т.е. выражение справа не является полным дифференциалом тепла). Т.к. 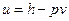 , то
, то 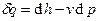 (здесь
(здесь 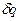 выступает в роли технической работы, т.е. работа, совершённая оборудованием).
выступает в роли технической работы, т.е. работа, совершённая оборудованием).
В случае изотермического процесса теплоёмкость 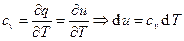 , изобарного:
, изобарного: 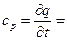
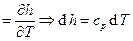 .
.
Другая формулировка I закона термодинамики: Энергия изолированной термодинамической системы остаётся неизменной независимо от того, какие процессы в ней протекают.
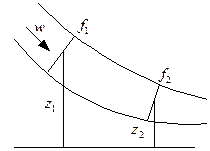 Рассмотрим первый закон термодинамики в применении к движущемуся потоку. Для этого возьмём произвольный канал, по которому движется газ. Возьмём два сечения канала. Пусть площади их соответственно
Рассмотрим первый закон термодинамики в применении к движущемуся потоку. Для этого возьмём произвольный канал, по которому движется газ. Возьмём два сечения канала. Пусть площади их соответственно 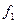 и
и 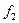 , высота над землёй
, высота над землёй 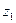 и
и 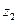 , скорость входящего потока
, скорость входящего потока 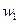 , выходящего
, выходящего 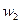 , среднее по сечению давление
, среднее по сечению давление 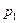 и
и 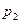 .
.
Рассмотрим изменения энергии: удельная работа проталкивания вещества сквозь канал 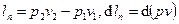 ; изменение удельной кинетической энергии
; изменение удельной кинетической энергии 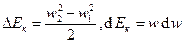 ; изменение удельной потенциальной энергии:
; изменение удельной потенциальной энергии: 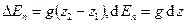 , удельная работа трения:
, удельная работа трения: 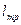 , удельная полезная работа:
, удельная полезная работа: 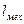 . Тогда суммарная удельная работа
. Тогда суммарная удельная работа 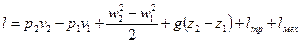 , изменение суммарной удельной работа
, изменение суммарной удельной работа 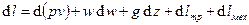 и I-й закон термодинамики выглядит так:
и I-й закон термодинамики выглядит так: 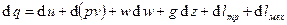 . При этом
. При этом 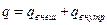 , где
, где 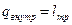 – тепло, получающееся за счёт трения,
– тепло, получающееся за счёт трения, 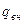 – внешний нагрев. Тогда
– внешний нагрев. Тогда 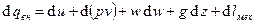 . Если
. Если 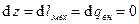 , то
, то 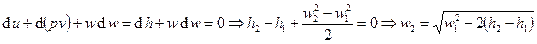 . Если процесс адиабатический (
. Если процесс адиабатический ( 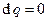 , т.е.
, т.е. 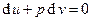 ), то
), то 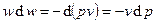 и
и 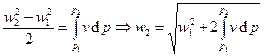 .
.
Функция 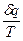 является полным дифференциалом, т.е. является функцией состояния системы и называется энтропией (здесь – удельной). В случае обратимых процессов
является полным дифференциалом, т.е. является функцией состояния системы и называется энтропией (здесь – удельной). В случае обратимых процессов 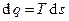 , необратимых –
, необратимых – 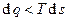 . Энтропия является мерой неупорядоченности системы.
. Энтропия является мерой неупорядоченности системы.
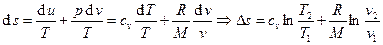 . Аналогично
. Аналогично 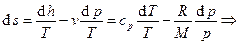
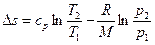 .
.
Схема работы теплового двигателя

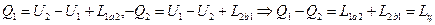
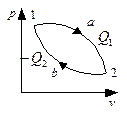 – уравнение теплового баланса в двигателях.
– уравнение теплового баланса в двигателях.
КПД теплового двигателя 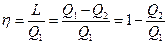 .
.
Пусть у теплоприёмника и теплоотдатчика поддерживаются постоянные температуры 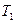 и
и 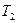 . Рассмотрим цикл двух изотерм и двух адиабат (Цикл Карно):
. Рассмотрим цикл двух изотерм и двух адиабат (Цикл Карно):
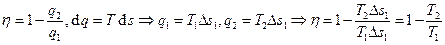
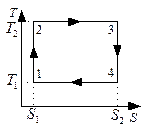 .
.
Теорема Карно: Значение КПД для цикла Карно определяется исключительно температурами теплоотдатчика и теплоприёмника независимо от рода рабочего тела, размеров двигателя и конструктивных особенностей.
Термодинамической вероятностью называют число микросостояний, результирующих данное макросостояние.
Энтропия 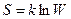 , где k – постоянная Больцмана, W – термодинамическая вероятность.
, где k – постоянная Больцмана, W – термодинамическая вероятность.
Изопроцессы
 Изотермический процесс:
Изотермический процесс:
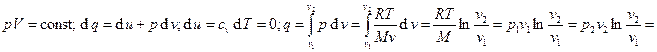
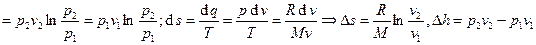 .
.
Изобарный процесс: 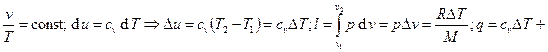
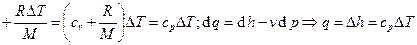 (здесь q – техническая работа);
(здесь q – техническая работа); 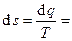
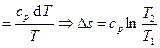 .
.
Изохорный процесс: 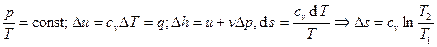 .
.
Адиабатический процесс: 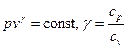 ; g в течение какого-то процесса может, вообще говоря, меняться, например, при изменении агрегатного состояния рабочего вещества (перегретый пар ® насыщенный пар ® обычный пар).
; g в течение какого-то процесса может, вообще говоря, меняться, например, при изменении агрегатного состояния рабочего вещества (перегретый пар ® насыщенный пар ® обычный пар).
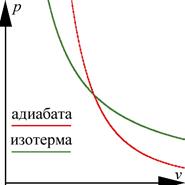 Состояние системы описывается уравнениями:
Состояние системы описывается уравнениями: 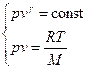 .
. 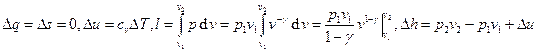
Политропный процесс: 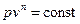 . При
. При 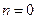 он переходит в изобарный процесс, при
он переходит в изобарный процесс, при 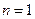 – изотермический,
– изотермический, 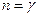 – адиабатический,
– адиабатический, 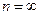 – изохорный (здесь уравнение удобно представлять в виде
– изохорный (здесь уравнение удобно представлять в виде 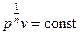 ).
). 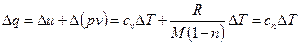 , где
, где 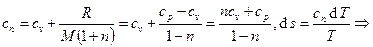
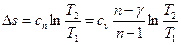 .
.
Дифференциальные уравнения термодинамики. Основные математические методы.
Уравнения Максвелла
Первый закон термодинамики гласит, что 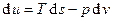 . Пусть x и y – термодинамические параметры, т.е.
. Пусть x и y – термодинамические параметры, т.е. 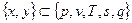 . Тогда
. Тогда 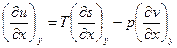 . Аналогично и для y.
. Аналогично и для y. 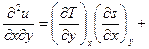
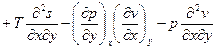 ,
, 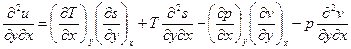 . Т.к. все используемые функции у нас считаются непрерывными, то
. Т.к. все используемые функции у нас считаются непрерывными, то 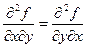 , где
, где 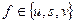 . Тогда, т.к.
. Тогда, т.к. 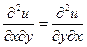 , то
, то 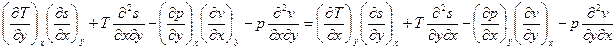 или
или 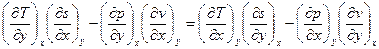 . Начнём перебирать x и y. Заметим, что, например,
. Начнём перебирать x и y. Заметим, что, например, 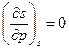 и
и 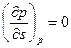 . В результате получаются четыре уравнения Максвелла:
. В результате получаются четыре уравнения Максвелла: 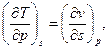
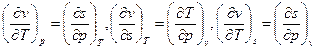 .
.
Частные производные внутренней энергии и энтальпии
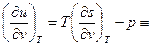 (согласно одному из уравнений Максвелла)
(согласно одному из уравнений Максвелла) 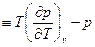 – характеризует зависимость внутренней энергии от удельного объёма в изотермическом процессе.
– характеризует зависимость внутренней энергии от удельного объёма в изотермическом процессе.
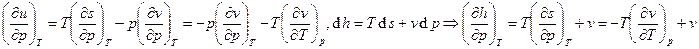 – зависимость энтальпии от давления в изотермическом процессе.
– зависимость энтальпии от давления в изотермическом процессе.
Обратимость и производство работы
Будем рассматривать изолированную систему с источником работы. Производство работы изолированной системой возможно в процессе перехода системы из неравновесного состояния в равновесное, причём величина работы зависит от характера процесса перехода.
Пусть 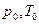 – параметры окружающей среды (которая тоже входит в изолированную систему), p и T – параметры источника работы и пусть
– параметры окружающей среды (которая тоже входит в изолированную систему), p и T – параметры источника работы и пусть 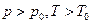 . Пусть также внутренняя энергия и объём источника работы в начале процесса есть
. Пусть также внутренняя энергия и объём источника работы в начале процесса есть 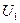 и
и 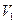 , в конце –
, в конце – 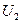 и
и 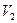 , окружающей среды в начале
, окружающей среды в начале 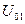 и
и 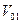 , в конце –
, в конце – 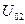 и
и 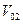 . Тогда работа, совершённая в системе
. Тогда работа, совершённая в системе 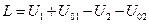 . Пусть
. Пусть 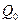 – это количество тепла, которое источник работы передал окружающей среде,
– это количество тепла, которое источник работы передал окружающей среде, 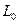 – работа, совершаема источником над окружающей средой. Тогда
– работа, совершаема источником над окружающей средой. Тогда 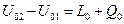 . Т.к.
. Т.к. 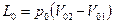 , то
, то 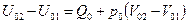 или
или 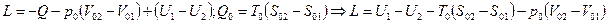 . Это уравнение даёт значение полезной работы, произведённой системой при переходе из неравновесного состояния в равновесное, т.к. из всей произведённой работы
. Это уравнение даёт значение полезной работы, произведённой системой при переходе из неравновесного состояния в равновесное, т.к. из всей произведённой работы 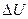 вычитается та её часть, которая затрачивается на сжатие среды, а, следовательно, не может быть использована в наших целях. Однако это уравнение не даёт максимальную величину полезной работы, т.к. не обуславливает обязательной обратимости всех происходящих в системе процессов. Для нахождение максимальной полезной работы (работоспособности) можно воспользоваться тем, что при протекании обратимых процессов энтропия системы не изменяется, т.е.
вычитается та её часть, которая затрачивается на сжатие среды, а, следовательно, не может быть использована в наших целях. Однако это уравнение не даёт максимальную величину полезной работы, т.к. не обуславливает обязательной обратимости всех происходящих в системе процессов. Для нахождение максимальной полезной работы (работоспособности) можно воспользоваться тем, что при протекании обратимых процессов энтропия системы не изменяется, т.е. 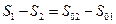 . Максимальная полезная работа
. Максимальная полезная работа 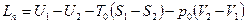 . Удельная максимальная полезная работа называется эксергией. Обозначение: ex.
. Удельная максимальная полезная работа называется эксергией. Обозначение: ex. 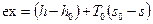 . Потеря работоспособности
. Потеря работоспособности 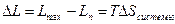 , где
, где 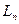 – полезная работа. Также эта величина называется энергетической потерей.
– полезная работа. Также эта величина называется энергетической потерей.
Дросселирование. Эффект Джоуля-Томпсона.
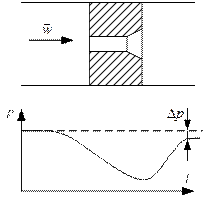 Эффект падения давления в струе рабочего тела в процессе протекания через сужение в канале называется дросселированием или мятием.
Эффект падения давления в струе рабочего тела в процессе протекания через сужение в канале называется дросселированием или мятием.
Считая, что нет трения, не производится механическая работа и не меняется потенциальная энергия, получим: 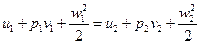 , где первая точка – точка на поперечном сечении до сужения, вторая – после. При этом точки достаточно далеко от сужения, т.е. давление в их окрестности постоянно. Тогда
, где первая точка – точка на поперечном сечении до сужения, вторая – после. При этом точки достаточно далеко от сужения, т.е. давление в их окрестности постоянно. Тогда 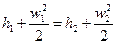 . Исходя из закона сохранения массы,
. Исходя из закона сохранения массы, 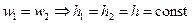 . Если газ идеальный, то
. Если газ идеальный, то 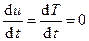 .
.
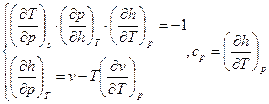 . Величина
. Величина 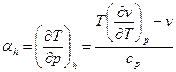 называется коэффициентом адиабатического дросселирования или коэффициентом дифференциального эффекта.
называется коэффициентом адиабатического дросселирования или коэффициентом дифференциального эффекта.
Явление изменения температуры газов при адиабатическом дросселировании называется эффектом Джоуля-Томпсона. Изменение температуры газа или жидкости при значительном перепаде давления называется интегральным дроссель-эффектом.
Если 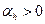 , то температура вещества после прохода сужения будет понижаться, если
, то температура вещества после прохода сужения будет понижаться, если 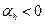 , то повышаться. Если
, то повышаться. Если 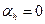 , то температура не меняется. В этом случае температура называется температурой инверсии. Для ван-дер-ваальсовского газа
, то температура не меняется. В этом случае температура называется температурой инверсии. Для ван-дер-ваальсовского газа 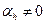 . Для одного и того же вещества знак
. Для одного и того же вещества знак 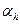 оказывается различным в различных областях состояния. Состояние газа (жидкости), в котором
оказывается различным в различных областях состояния. Состояние газа (жидкости), в котором 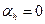 называется точкой инверсии эффекта Джойля-Томпсона.
называется точкой инверсии эффекта Джойля-Томпсона.
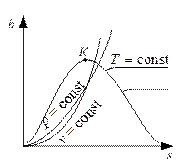
Реальный газ и уравнения состояния реального газа. Опыты Эндрюса. Критическая точка. Уравнение Ван-дер-Ваальса.
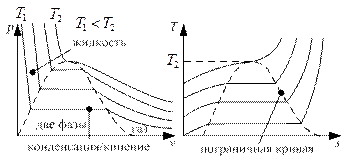 Температура
Температура 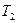 называется критической температурой.
называется критической температурой.
В критической точке 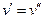 , где
, где 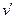 – удельный объём кипящей жидкости,
– удельный объём кипящей жидкости, 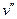 – удельный объём сухого пара.
– удельный объём сухого пара.
Степень сухости 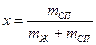 ; Степень влажности
; Степень влажности 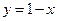 .
.
Некоторые данные по реальным веществам:
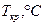
| 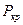 , МПа , МПа
| |
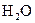
| 374.15 | 22.129 |
| He | –267.9 | 0.228 |
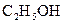
| 243.1 | 6.38 |
| C | ||
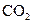
| 31.04 | 7.412 |
Уравнение Ван-дер-Ваальса: 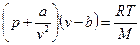 , где a и b параметры газа.
, где a и b параметры газа.
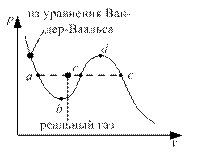 Область
Область 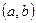 – область перегретой жидкости. Получается из обычной жидкости при осторожном и постепенном нагревании её выше точки кипения. При этом из неё должны быть удалены зародыши для возникновения пузырьков. Область
– область перегретой жидкости. Получается из обычной жидкости при осторожном и постепенном нагревании её выше точки кипения. При этом из неё должны быть удалены зародыши для возникновения пузырьков. Область 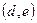 – область переохлаждённого пара. Получается из обычного пара при осторожном и медленном нагревании при отсутствии зародышей конденсации. Области
– область переохлаждённого пара. Получается из обычного пара при осторожном и медленном нагревании при отсутствии зародышей конденсации. Области 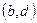 в реальности не существует.
в реальности не существует.
Постоянные a и b в уравнении Ван-дер-Ваальса можно получить из системы уравнений 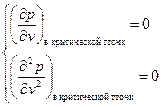 . Тогда
. Тогда 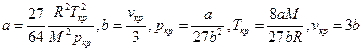 . Пусть
. Пусть 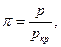
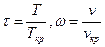 . Тогда уравнение Ван-дер-Ваальса станет приведённым:
. Тогда уравнение Ван-дер-Ваальса станет приведённым: 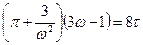 . Оно справедливо для всех ван-дер-ваальсовских газов.
. Оно справедливо для всех ван-дер-ваальсовских газов.
Пусть 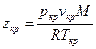 . Для Ван-дер-ваальсовского газа
. Для Ван-дер-ваальсовского газа 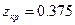 .
.
| Вещество | He | H | N | 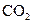
| Xe | 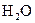
|
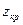
| 0.32 | 0.33 | 0.293 | 0.288 | 0.78 | 0.224 |
При выводе уравнения Ван-дер-Ваальса не была учтена тенденция молекул группироваться в ассоциации. Более точное уравнение: 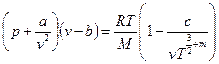 .
.
Вириальный ряд: 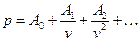 . Число членов зависит от точности исследования.
. Число членов зависит от точности исследования. 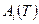 – вириальные коэффициенты.
– вириальные коэффициенты.
Другое более точное уравнение: 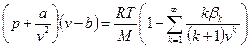 , где
, где 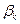 – вириальные коэффициенты.
– вириальные коэффициенты.
Пары. Испарение. Кипение.
Газообразные тела с примесью одноимённой жидкости в виде взвешенных мелкодисперсных частиц или без них принято называть парами.
Испарением называется парообразование, происходящее только с поверхности жидкости.
Кипение – это процесс парообразования, происходящий во всей массе жидкости.
При кипении образуются пузырьки пара как на поверхности, так и внутри жидкости. Они поднимаются вверх, объединяясь с другими пузырьками и по достижении поверхности схлопываются.
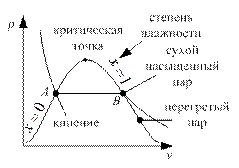 Насыщенный пар – такой пар, который образуется в присутствии жидкости и находится с ней в равновесном состоянии. Его давление зависит от температуры.
Насыщенный пар – такой пар, который образуется в присутствии жидкости и находится с ней в равновесном состоянии. Его давление зависит от температуры.
Сухим насыщенным паром называется такой пар, который не содержит капелек жидкости.
Влажным насыщенным паром называется смесь сухого пара и кипящей жидкости.
Перегретый пар – пар, имеющий более высокую температуру, чем насыщенный пар при том же давлении.
Для воды 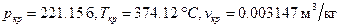 .
.
 Теплота парообразования
Теплота парообразования 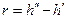 , где
, где 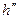 – энтальпия сухого насыщенного пара,
– энтальпия сухого насыщенного пара, 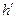 – энтальпия кипящей жидкости.
– энтальпия кипящей жидкости.
Степень влажности 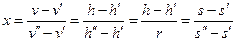 (где v, h и s – удельный объём, энтальпия и энтропия смеси).
(где v, h и s – удельный объём, энтальпия и энтропия смеси).
Равновесие термодинамических систем и фазовые переходы
Гомогенные и гетерогенные термодинамические системы
Гомогенной называется такая система, физические свойства и химический состав которой постоянны или изменяется непрерывно.
Гетерогенной называется система, состоящая из двух или более гомогенных областей. Эти области называются фазами.
Состояние равновесия – такое состояние, к которому при данных внешних условиях стремиться термодинамическая система.
Состояние устойчивого равновесия (стабильное состояние) характерно тем, что если каким-либо внешним воздействием вывести из него систему, а затем снять воздействие, то система снова вернётся в состояние равновесия.
Если систему, находящуюся в состоянии неустойчивого равновесия (лабильном состоянии), из него вывести, то она в это состояние уже не вернётся.
Относительно устойчивое (метастабильное) состояние – состояние, в котором система может находиться длительное время и небольшие воздействия не выводят её из этого состояния.
В равновесном состоянии энтропия принимает минимальное значение.
Равновесные состояния:
1. 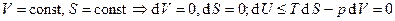 , т.е. при приближении к состоянию равновесия внутренняя энергия убывает, достигая минимума в состоянии равновесия.
, т.е. при приближении к состоянию равновесия внутренняя энергия убывает, достигая минимума в состоянии равновесия.
2. 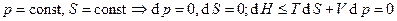 .
.
3. 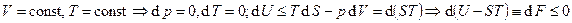 , F – изохорно-изотермический потенциал (или свободная энергия).
, F – изохорно-изотермический потенциал (или свободная энергия).
4. 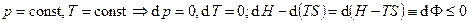 , F – изобарно-изотермический потенциал.
, F – изобарно-изотермический потенциал.
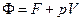 . Удельный изобарно-изотермический потенциал называется химическим потенциалом.
. Удельный изобарно-изотермический потенциал называется химическим потенциалом.
Условие устойчивости и равновесие в изолированной однородной системе
Для любого газа выполняются неравенства 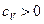 и
и 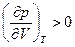 . Первое неравенство называется условием термической устойчивости, второе – механической устойчивостью.
. Первое неравенство называется условием термической устойчивости, второе – механической устойчивостью.
Принцип Ле Шателье-Брауна: Если система, находящаяся в равновесии, выводится из него, то все её параметры изменяются таким образом, чтобы система вернулась в состояние равновесия.
Пусть система состоит из двух систем с заданными параметрами. Тогда 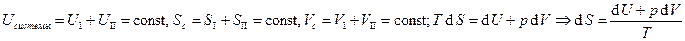 , следовательно,
, следовательно, 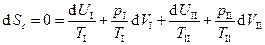 . Т.к.
. Т.к. 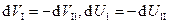 , то
, то 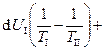
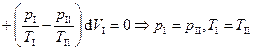 . Пусть
. Пусть 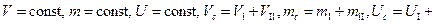
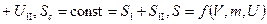 , где f – некоторая функция. Тогда
, где f – некоторая функция. Тогда 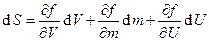 . Т.к.
. Т.к. 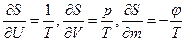 (j – химический потенциал), то
(j – химический потенциал), то 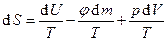 и, т.к.
и, т.к. 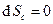 , то
, то 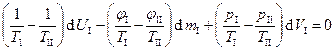 , следовательно, равновесия происходит, когда
, следовательно, равновесия происходит, когда 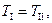
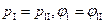 .
.
Фазовые переходы
Фазовым переходом называется переход из оной фазы в другую, сосуществующую с ней.
Фазовый переход из твёрдого состояния в жидкость называется плавлением, твердое состояние ® пар – сублимацией, жидкость ® твёрдое состояние – затвердеванием, жидкость ® пар – кипением, пар ® твёрдое тело – возгонкой, пар ® жидкость – конденсацией.
Правило Гиббса: 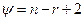 , где y – число степеней свободы системы, n – число компонентов, r – число фаз.
, где y – число степеней свободы системы, n – число компонентов, r – число фаз.
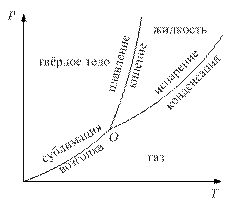 Точка O называется тройной.
Точка O называется тройной.
Уравнение Клапейрона-Клаузиуса
Пусть есть две вазы 1 и 2, находящиеся в равновесии при давлении p и температуре T: 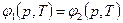 , где
, где 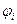 – химический потенциал.
– химический потенциал. 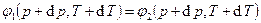 , т.к.
, т.к. 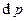 и
и 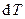 – бесконечно малые изменения. Тогда, т.к.
– бесконечно малые изменения. Тогда, т.к. 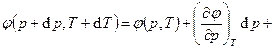
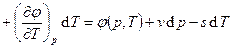 (последнее – из уравнений Максвелла), то
(последнее – из уравнений Максвелла), то 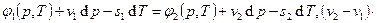
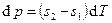 или
или 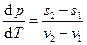 – уравнение кривой фазового перехода (уравнение Клапейрона-Клаузиуса). Оно однозначно связывает наклон линии фазового перехода в p-T диаграмме с разностью удельных энтропий и объёмов этих фаз.
– уравнение кривой фазового перехода (уравнение Клапейрона-Клаузиуса). Оно однозначно связывает наклон линии фазового перехода в p-T диаграмме с разностью удельных энтропий и объёмов этих фаз.
Из второго и первого законов термодинамики следует, что 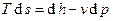 или
или 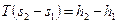 при постоянном давлении. Тогда
при постоянном давлении. Тогда 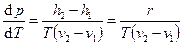 , где r – удельная теплота перехода из одной фазы в другую. При переходе из жидкости в пар
, где r – удельная теплота перехода из одной фазы в другую. При переходе из жидкости в пар 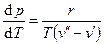 . Обычно
. Обычно 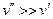 , следовательно,
, следовательно, 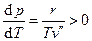 . Если давление мало, то выполняется неравенство
. Если давление мало, то выполняется неравенство 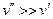 и можно пользоваться уравнением состояния идеального газа:
и можно пользоваться уравнением состояния идеального газа: 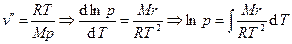 . При низких давлениях r не зависит от температуры, следовательно,
. При низких давлениях r не зависит от температуры, следовательно, 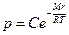 , где C – некоторая постоянная. Обычно это рассматривается при нормальных условиях и тогда
, где C – некоторая постоянная. Обычно это рассматривается при нормальных условиях и тогда 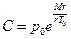 и
и 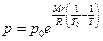 .
.
Устойчивость фаз
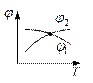 Т.к.
Т.к. 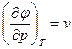 , то
, то 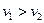 . Пусть 1 – жидкость, а 2 – насыщенный пар (j – химический потенциал). Тогда изобарно-изотермический потенциал системы
. Пусть 1 – жидкость, а 2 – насыщенный пар (j – химический потенциал). Тогда изобарно-изотермический потенциал системы 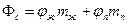 . В состоянии равновесия
. В состоянии равновесия 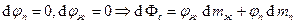 . Кроме того,
. Кроме того, 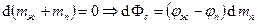 . В процессе установления равновесия в изобарно-изотермической системе
. В процессе установления равновесия в изобарно-изотермической системе 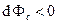 всегда, следовательно, если
всегда, следовательно, если 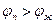 , то происходит конденсация, иначе – испарение.
, то происходит конденсация, иначе – испарение.
Термодинамические свойства веществ
Термические и калорические свойства твёрдых тел
Для большинства твёрдых тел коэффициент изотермической сжимаемости 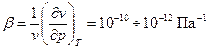 . Удельный объём твёрдых тел существенно изменяется только в случае сжатия большими давлениями.
. Удельный объём твёрдых тел существенно изменяется только в случае сжатия большими давлениями.
Температурный коэффициент объёмного расширения: 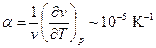 , кроме областей вблизи фазового превращения. Для анизотропных тел вводится коэффициент линейного расширения
, кроме областей вблизи фазового превращения. Для анизотропных тел вводится коэффициент линейного расширения 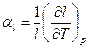 , где l – ось анизотропности.
, где l – ось анизотропности.
При средних и высоких температурах 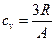 – уравнение Дюлонга и Пти (здесь A – атомарная масса). Формула Дебая:
– уравнение Дюлонга и Пти (здесь A – атомарная масса). Формула Дебая: 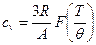 , где T – текущая температура, q – дебаевская температура, которая является характеристикой вещества. Т.к. v практически не зависит от p, то
, где T – текущая температура, q – дебаевская температура, которая является характеристикой вещества. Т.к. v практически не зависит от p, то 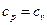 .
.
Вещество в твёрдой фазе может существовать в различных аллотропических модификациях. При этом каждая модификации существует лишь в некоторых областях параметров состояния и переход из одной модификации в другую эквивалентен переходу из одной фазы в другую.
Термические и калорические свойства жидкостей
Коэффициент термической сжимаемости 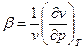 . Для воды он равен
. Для воды он равен 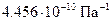 .
. 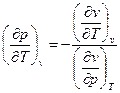 . Для воды при 50°С
. Для воды при 50°С 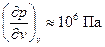 . При изменении давления теплоёмкость обычно меняется очень мало – порядка 5%.
. При изменении давления теплоёмкость обычно меняется очень мало – порядка 5%.
Удельная теплоёмкость при постоянном давлении 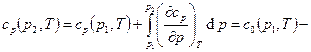
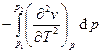 . Последний интеграл обычно вычисляется графически или численным методом. Теплоёмкость с ростом температуры может как возрастать, так и убывать – зависит от параметров состояния. Теплоёмкость воды минимальна при примерно 20°С. При приближении к линии насыщения заметно возрастает. В тройной точке, а также в точки минимальной плотности (для воды – 3.94°С)
. Последний интеграл обычно вычисляется графически или численным методом. Теплоёмкость с ростом температуры может как возрастать, так и убывать – зависит от параметров состояния. Теплоёмкость воды минимальна при примерно 20°С. При приближении к линии насыщения заметно возрастает. В тройной точке, а также в точки минимальной плотности (для воды – 3.94°С) 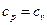 (т.е.
(т.е. 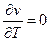 ).
).
Энтальпия: 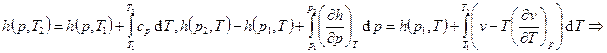
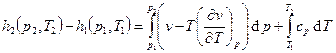 . Энтальпия жидкости слабо зависит от давления.
. Энтальпия жидкости слабо зависит от давления.
По решению III международной конференции по свойствам воды и водяного пара внутренняя энергия в тройной точке принимается за 0, удельный объём – за 1.0002 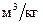 , энтропия – за 0, энтальпия – за 0.2 Дж/кг.
, энтропия – за 0, энтальпия – за 0.2 Дж/кг.
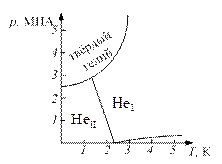 Температура сжижения гелия при давлении 2.5 бар равна 4.2 К. При этом давлении гелий остаётся жидким до 0 К. Твёрдый гелий может существовать лишь при повышенном давлении. При охлаждении ниже 0.12 К жидкий гелий переходит в новую модификацию, обладающую свойством сверхтекучести. Точка перехода
Температура сжижения гелия при давлении 2.5 бар равна 4.2 К. При этом давлении гелий остаётся жидким до 0 К. Твёрдый гелий может существовать лишь при повышенном давлении. При охлаждении ниже 0.12 К жидкий гелий переходит в новую модификацию, обладающую свойством сверхтекучести. Точка перехода 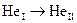 называется l-точкой. Тройной точки гелия не существует.
называется l-точкой. Тройной точки гелия не существует.
Адиабатное расширение реального газа в вакуум (процесс Джоуля)
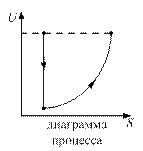 Пусть есть сосуд, разделённый на две половины перегородкой. В одной части сосуда объёмом
Пусть есть сосуд, разделённый на две половины перегородкой. В одной части сосуда объёмом 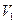 находится газ под давлением
находится газ под давлением 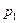 при температуре
при температуре 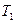 , в другой – объёмом
, в другой – объёмом 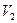 – вакуум. Тогда будут выполняться следующие равенства:
– вакуум. Тогда будут выполняться следующие равенства:
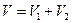 , где V – объём сосуда. Согласно первому закону термодинамики,
, где V – объём сосуда. Согласно первому закону термодинамики, 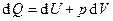 . Т.к. процесс адиабатический, то
. Т.к. процесс адиабатический, то 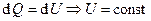 .
. 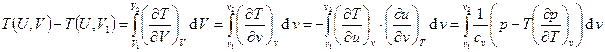 Т.к.
Т.к. 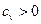 и
и 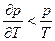 , то
, то 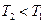 . Для идеального газа
. Для идеального газа 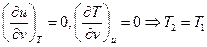 . Изменение энтропии
. Изменение энтропии 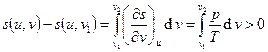 . Для идеального газа
. Для идеального газа 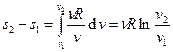 .
.
Процесс течения газов, паров жидкостей
Первый закон термодинамики для движущегося газа гласит: 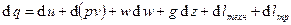 , где q – тепло, подведённое к газу в процессе движения, u – внутренняя энергия газа, p – давление в газе, v – его удельный объём, w – скорость, g – ускорение свободного падения, z – высота в поле гравитации,
, где q – тепло, подведённое к газу в процессе движения, u – внутренняя энергия газа, p – давление в газе, v – его удельный объём, w – скорость, g – ускорение свободного падения, z – высота в поле гравитации, 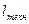 – техническая работа, которую совершает газ на рассматриваемом участке,
– техническая работа, которую совершает газ на рассматриваемом участке, 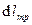 – работа, совершаемая потоком против сил трения. Этот закон можно переписать так:
– работа, совершаемая потоком против сил трения. Этот закон можно переписать так: 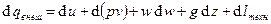 , где
, где 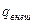 – подведённое извне тепло. Проинтегрировав:
– подведённое извне тепло. Проинтегрировав: 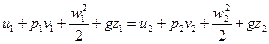 . При малых скоростях (для жидкостей меньше 1 маха, для газов – меньше четверти маха) можно считать газ несжимаемым и тогда
. При малых скоростях (для жидкостей меньше 1 маха, для газов – меньше четверти маха) можно считать газ несжимаемым и тогда 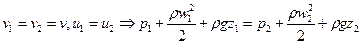 – уравнение Бернулли (здесь
– уравнение Бернулли (здесь 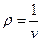 – плотность газа). p называют статическим напором,
– плотность газа). p называют статическим напором, 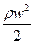 – динамическим напором,
– динамическим напором, 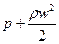 – полным напором. Если записать первый закон термодинамики через энтальпию, то можно получить соотношение:
– полным напором. Если записать первый закон термодинамики через энтальпию, то можно получить соотношение: 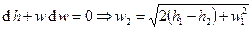 . Если нельзя считать газ несжимаемым, то
. Если нельзя считать газ несжимаемым, то 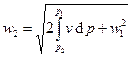 .
.
Скорость звука в газе 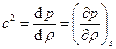 (процесс распространения звука адиабатный),
(процесс распространения звука адиабатный), 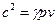 , где g - адиабатическая постоянная
, где g - адиабатическая постоянная 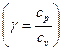 , p и v – параметры, снятые в той точке, в которой измеряется скорость (т.е.
, p и v – параметры, снятые в той точке, в которой измеряется скорость (т.е. 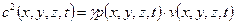 ). Из закона сохранения массы следует, что поток массы через поперечное сечение (трубу)
). Из закона сохранения массы следует, что поток массы через поперечное сечение (трубу) 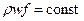 , где f – площадь этого сечения. Тогда
, где f – площадь этого сечения. Тогда 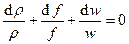 или
или 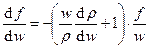 . Из первого закона термодинамики получим:
. Из первого закона термодинамики получим: 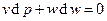 , т.е.
, т.е. 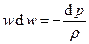 , следовательно,
, следовательно, 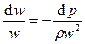 и
и 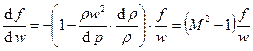 , где
, где 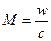 – число Маха – уравнение Лапласа.
– число Маха – уравнение Лапласа.
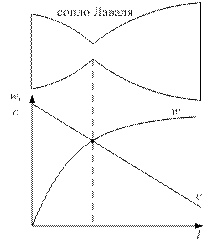 Для изменения скорости потока газа используются насадки: сопла – в них происходит расширение газа и за счёт этого уменьшение его скорости – и диффузоры – в них происходит сжатие газа и, соответственно, увеличение скорости. Максимальная скорость, которую можно достичь на выходе диффузора – звуковая, поэтому для превышения звуковой скорости используется сопло Лаваля.
Для изменения скорости потока газа используются насадки: сопла – в них происходит расширение газа и за счёт этого уменьшение его скорости – и диффузоры – в них происходит сжатие газа и, соответственно, увеличение скорости. Максимальная скорость, которую можно достичь на выходе диффузора – звуковая, поэтому для превышения звуковой скорости используется сопло Лаваля.
Истечение из суживающихся сопел
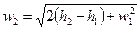
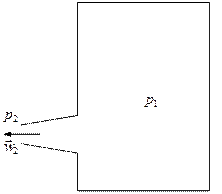 . Обычно
. Обычно 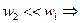
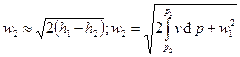 . Для реальных газов этот интеграл берётся на основании экспериментальных данных. Процесс при этом адиабатный, т.е.
. Для реальных газов этот интеграл берётся на основании экспериментальных данных. Процесс при этом адиабатный, т.е. 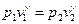 , следовательно,
, следовательно, 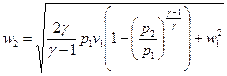 .
.
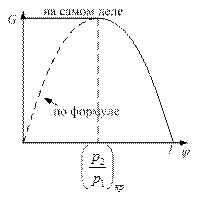 Объёмный расход газа
Объёмный расход газа 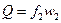 , массовый –
, массовый – 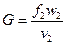 при этом, т.к.
при этом, т.к. 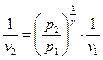 , то
, то 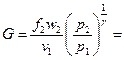
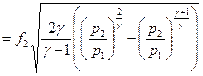 . Обозначим
. Обозначим 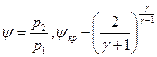 и
и 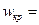
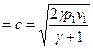 .
.
 Адиабатическое течение с трением
Адиабатическое течение с трением
Изменение энтальпии при адиабатическом и при реальном процессе немного отличается. Введём скоростной коэффициент j: 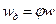 , где
, где 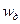 – действительная скорость, w – расчётная скорость; j просто корректирует вычисления.
– действительная скорость, w – расчётная скорость; j просто корректирует вычисления.
Циклы газовых двигателей и установок
Пределы сжатия в компрессоре
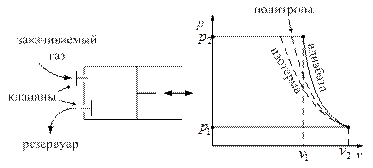 Компрессор – это машина для сжатия газа. Бывают лопаточные компрессоры (динамического сжатия) и объёмные (статического сжатия). Объёмные компрессоры бывают поршневые и ротационные.
Компрессор – это машина для сжатия газа. Бывают лопаточные компрессоры (динамического сжатия) и объёмные (статического сжатия). Объёмные компрессоры бывают поршневые и ротационные.
Поршневой компрессор:
Совершаемая над газом работа 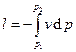 . В случае политропного процесса
. В случае политропного процесса 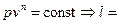
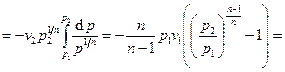 (для идеального газа)
(для идеального газа) 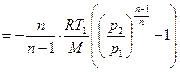 . Затраченная энергия
. Затраченная энергия 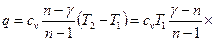
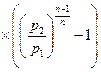 .
.
Если нужно высокое давление, то применяют несколько ступеней, каждое из которых состоит из компрессора и холодильника. Тогда 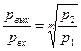 , где m – число ступеней,
, где m – число ступеней, 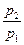 – соотношение давлений на входе и выходе каждой ступени.
– соотношение давлений на входе и выходе каждой ступени.
Струйный компрессор (эжектор):
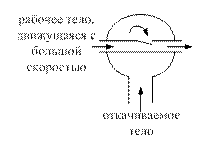 По виду сред эжекторы подразделяются на типа: газо-газовые, паро-газовые, жидкостно-газовые, жидкостно-жидкостные, паро-жидкостные (в этом случае струйные компрессоры называются инжекторами). Первое слово в названии типа обозначает рабочее тело, второе – откачиваемое тело.
По виду сред эжекторы подразделяются на типа: газо-газовые, паро-газовые, жидкостно-газовые, жидкостно-жидкостные, паро-жидкостные (в этом случае струйные компрессоры называются инжекторами). Первое слово в названии типа обозначает рабочее тело, второе – откачиваемое тело.
Циклы двигателей внутреннего сгорания
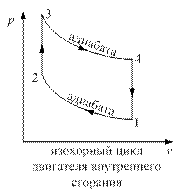 Двигатель внутреннего сгорания – это тепловая машина, в которой подвод тепла к рабочему телу осуществляется за счёт сгорания топлива внутри самого двигателя.
Двигатель внутреннего сгорания – это тепловая машина, в которой подвод тепла к рабочему телу осуществляется за счёт сгорания топлива внутри самого двигателя.
Коэффициент предварительного расширения 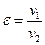 .
.
КПД 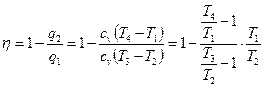 . Из уравнения Пуассона
. Из уравнения Пуассона 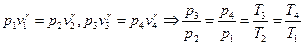
 и тогда
и тогда 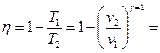
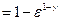 .
.
Цикл Дизеля
| <== предыдущая лекция | | | следующая лекция ==> |
| ПОЛЫ ПРОМЫШЛЕННЫХ ЗДАНИЙ | | | Техническая термодинамика |
Дата добавления: 2021-07-22; просмотров: 155;










