Дисперсные системы: определение, классификации.
Дисперсными называют гетерогенные системы, в которых одно вещество в виде очень мелких частиц равномерно распределено в объеме другого.
То вещество, которое присутствует в меньшем количестве и распределено в объеме другого, называют дисперсной фазой. Она может состоять из нескольких веществ.
Вещество, присутствующее в большем количестве, в объеме которого распределена дисперсная фаза, называют дисперсионной средой. Между ней и частицами дисперсной фазы существует поверхность раздела, поэтому дисперсные системы называют гетерогенными (неоднородными).
И дисперсионную среду, и дисперсную фазу могут представлять вещества, находящиеся в различных агрегатных состояниях − твердом, жидком и газообразном.
В зависимости от сочетания агрегатного состояния дисперсионной среды и дисперсной фазы можно выделить 8 видов таких систем.
По величине частиц веществ, составляющих дисперсную фазу, дисперсные системы делят на грубодисперсные (взвеси) с размерами частиц более 100 нм и тонкодисперсные (коллоидные растворы или коллоидные системы) с размерами частиц от 100 до 1 нм. Если же вещество раздроблено до молекул или ионов размером менее 1 нм, образуется гомогенная система − раствор. Она однородна (гомогенна), поверхности раздела между частицами дисперсной фазы и средой нет.
Уже беглое знакомство с дисперсными системами и растворами показывает, насколько они важны в повседневной жизни и в природе (см. таблицу).
Таблица. Примеры дисперсных систем
| Дисперсионная среда | Дисперсная фаза | Примеры некоторых природных и бытовых дисперсных систем |
| Газ | Жидкость | Туман, попутный газ с капельками нефти, карбюраторная смесь в двигателях автомобилей (капельки бензина в воздухе), аэрозоли |
| Твердое вещество | Пыли в воздухе, дымы, смог, самумы (пыльные и песчаные бури), аэрозоли | |
| Жидкость | Газ | Шипучие напитки, пены |
| Жидкость | Эмульсии. Жидкие среды организма (плазма крови, лимфа, пищеварительные соки), жидкое содержимое клеток (цитоплазма, кариоплазма) | |
| Твердое вещество | Золи, гели, пасты (кисели, студни, клеи). Речной и морской ил, взвешенные в воде; строительные растворы | |
| Твердое вещество | Газ | Снежный наст с пузырьками воздуха в нем, почва, текстильные ткани, кирпич и керамика, поролон, пористый шоколад, порошки |
| Жидкость | Влажная почва, медицинские и косметические средства (мази, тушь, помада и т. д.) | |
| Твердое вещество | Горные породы, цветные стекла, некоторые сплавы |
Судите сами: без нильского ила не состоялась бы великая цивилизация Древнего Египта; без воды, воздуха, горных пород и минералов вообще бы не существовала живая планета − наш общий дом − Земля; без клеток не было бы живых организмов и т. д.
Если все частицы дисперсной фазы имеют одинаковые размеры, то такие системы называют монодисперсными (рис. 1, а и б). Частицы дисперсной фазы неодинакового размера образуют полидисперсные системы (рис.1, в).
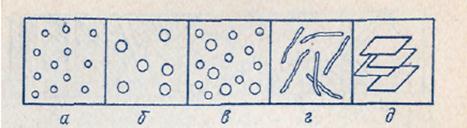
Рис. 1. Свободнодисперсные системы: корпускулярно − (а-в), волокнисто − (г) и пленочно-дисперсные − (д); а, б − монодисперсные; в − полидисперсная система.
Дисперсные системы могут быть свободнодисперсными(рис. 1) и связнодисперсными (рис. 2, а − в) в зависимости от отсутствия или наличия взаимодействия между частицами дисперсной фазы. К свободнодисперсным системам относятся аэрозоли, разбавленные суспензии и эмульсии. Они текучи, в этих системах частицы дисперсной фазы не имеют контактов, участвуют в беспорядочном тепловом движении, свободно перемещаются под действием силы тяжести. Связнодисперсные системы − твердообразны; они возникают при контакте частиц дисперсной фазы, приводящем к образованию структуры в виде каркаса или сетки. Такая структура ограничивает текучесть дисперсной системы и придает ей способность сохранять форму. Порошки, концентрированные эмульсии и суспензии (пасты), пены, гели – примеры связнодисперсных систем. Сплошную массу вещества могут пронизывать поры и капилляры, образующие капиллярно-дисперсные системы (кожа, картон, ткани, древесина).
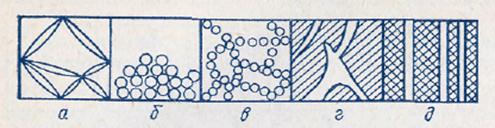
Рис. 3. Связнодисперсные (а-в) и капиллярно-дисперсные (г, д) системы: гель (а), коагулянт с плотной (б) и рыхлой – арочной (в) структурой.
Дисперсные системы, в соответствии с их промежуточным положением между миром молекул и крупных тел, могут быть получены двумя путями: методами диспергирования, т. е. измельчения крупных тел, и методами конденсации молекулярно- или ионнорастворенных веществ.
Под взаимодействием фаз дисперсных систем подразумевают процессы сольватации (гидратации в случае водных систем), т. е. образование сольватных (гидратных) оболочек из молекул дисперсионной среды вокруг частиц дисперсной фазы. Соответственно, по интенсивности взаимодействия между веществами дисперсной фазы и дисперсионной среды (только для систем с жидкой дисперсионной средой), по предложению Г. Фрейндлиха различают следующие дисперсные системы:
− Лиофильные (гидрофильные, если ДС – вода): мицеллярные растворы ПАВ, критические эмульсии, водные растворы некоторых природных ВМС, например, белков (желатина, яичного белка), полисахаридов (крахмала). Для них характерно сильное взаимодействие частиц ДФ с молекулами ДС. В предельном случае наблюдается полное растворение. Лиофильные дисперсные системы образуются самопроизвольно вследствие процесса сольватации. Термодинамически агрегативно устойчивы.
− Лиофобные (гидрофобные, если ДС – вода): эмульсии, суспензии, золи. Для них характерно слабое взаимодействие частиц ДФ с молекулами ДС. Самопроизвольно не образуются, для их образования необходимо затратить работу. Термодинамически агрегативно неустойчивы (т. е. имеют тенденцию к самопроизвольной агрегации частиц дисперсной фазы), их относительная устойчивость (так называемая метастабильность) обусловлена кинетическими факторами (т. е. низкой скоростью агрегации).
3. Взвеси.
Взвеси – это дисперсные системы, в которых размер частицы фазы более 100 нм. Это непрозрачные системы, отдельные частицы которых можно заметить невооруженным глазом. Дисперсная фаза и дисперсная среда легко разделяются отстаиванием, фильтрованием. Такие системы разделяются на:
1. Эмульсии (и среда, и фаза – нерастворимые друг в друге жидкости). Из воды и масла можно приготовить эмульсию длительным встряхиванием смеси. Это хорошо известные вам молоко, лимфа, водоэмульсионные краски и т.д.
2. Суспензии( среда – жидкость, фаза – нерастворимое в ней твердое вещество).Чтобы приготовить суспензию , надо вещество измельчить до тонкого порошка, высыпать в жидкость и хорошо взболтать. Со временем частица выпадут на дно сосуда. Очевидно, чем меньше частицы, тем дольше будет сохраняться суспензия. Это строительные растворы, взвешенный в воде речной и морской ил, живая взвесь микроскопических живых организмов в морской воде – планктон, которым питаются гиганты – киты, и т.д.
3. Аэрозоли взвеси в газе (например, в воздухе) мелких частиц жидкостей или твердых веществ. Различаются пыли, дымы, туманы. Первые два вида аэрозолей представляют собой взвеси твердых частиц в газе (более крупные частицы в пылях), последний – взвесь капелек жидкости в газе. Например: туман, грозовые тучи – взвесь в воздухе капелек воды, дым – мелких твердых частиц. А смог, висящий над крупнейшими городами мира, также аэрозоль с твердой и жидкой дисперсной фазой. Жители населенных пунктов вблизи цементных заводов страдают от всегда висящей в воздухе тончайшей цементной пыли, образующейся при размоле цементного сырья и продукта его обжига – клинкера. Дым заводских труб, смоги, мельчайшие капельки слюны, вылетающих изо рта больного гриппом, также вредные аэролози. Аэрозоли играют важную роль в природе, быту и производственной деятельности человека. Скопление облаков, обработка полей химикатами, нанесение лакокрасочных покрытий при помощи пульверизатора, лечение дыхательных путей (ингаляция) – примеры тех явлений и процессов, где аэрозоли приносят пользу. Аэрозоли – туманы над морским прибоем, вблизи водопадов и фонтанов, возникающая в них радуга доставляет человеку радость, эстетическое удовольствие.
Для химии наибольшее значение имеют дисперсные системы, в которых средой является вода и жидкие растворы.
Природная вода всегда содержит растворенные вещества. Природные водные растворы участвуют в процессах почвообразования и снабжают растения питательными веществами. Сложные процессы жизнедеятельности, происходящие в организмах человека и животных, также протекают в растворах. Многие технологические процессы в химической и других отраслях промышленности, например получение кислот, металлов, бумаги, соды, удобрений, протекают в растворах.
4. Коллоидные системы.
Коллоидные системы (в переводе с греческого “колла” – клей, “еидос” вид клееподобные) – это такие дисперсные системы, в которых размер частиц фазы от 100 до 1 нм. Эти частицы не видны невооруженным глазом, и дисперсная фаза и дисперсная среда в таких системах отстаиванием разделяются с трудом.
Из курса общей биологии вам известно, что частицы такого размера можно обнаружить при помощи ультрамикроскопа, в котором используется принцип рассеивания света. Благодаря этому коллоидная частица в нем кажется яркой точкой на темном фоне.
Их подразделят на золи (коллоидные растворы) и гели (студни).
1. Коллоидные растворы, или золи. Это большинство жидкостей живой клетки (цитоплазма, ядерный сок – кариоплазма, содержимое органоидов и вакуолей). И живого организма в целом (кровь, лимфа, тканевая жидкость, пищеварительные соки и т.д.) Такие системы образуют клеи, крахмал, белки, некоторые полимеры.
Коллоидные растворы могут быть получены в результате химических реакций; например, при взаимодействии растворов силикатов калия или натрия (“растворимого стекла”) с растворами кислот образуется коллоидный раствор кремниевой кислоты. Золь образуется и при гидролизе хлорида железа (III) в горячей воде.
Характерное свойство коллоидных растворов – их прозрачность. Коллоидные растворы внешне похожи на истинные растворы. Их отличают от последних по образующейся “светящейся дорожке” – конусу при пропускании через них луча света. Это явление называют эффектом Тиндаля. Более крупные, чем в истинном растворе, частицы дисперсной фазы золя отражают свет от своей поверхности, и наблюдатель видит в сосуде с коллоидным раствором светящийся конус. В истинном растворе он не образуется. Аналогичный эффект, но только для аэрозольного, а не жидкого коллоида, вы можете наблюдать в лесу и в кинотеатрах при прохождении луча света от киноаппарата через воздух кинозала.
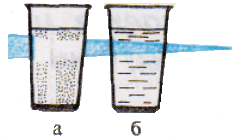
Пропускание луча света через растворы:
а – истинный раствор хлорида натрия;
б – коллоидный раствор гидроксида железа (III).
Частицы дисперсной фазы коллоидных растворов нередко не оседают даже при длительном хранении из-за непрерывных соударений с молекулами растворителя за счет теплового движения. Они не слипаются и при сближении друг с другом из-за наличия на их поверхности одноименных электрических зарядов. Это объясняется тем, что вещества в коллоидном, т.е., в мелкораздробленном, состоянии обладают большой поверхностью. На этой поверхности адсорбируются либо положительно, либо отрицательно заряженные ионы. Например, кремниевая кислота адсорбирует отрицательные ионы SiO32-, которых в растворе много вследствие диссоциации силиката натрия:
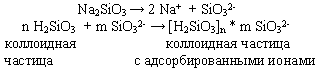
Частицы же с одноименными зарядами взаимно отталкиваются и поэтому не слипаются.
Но при определенных условиях может происходить процесс коагуляции. При кипячении некоторых коллоидных растворов происходит десорбция заряженных ионов, т.е. коллоидные частицы теряют заряд. Начинают укрупняться и оседают. Тоже самое наблюдается при приливании какого-либо электролита. В этом случае коллоидная частица притягивает к себе противоположно заряженный ион и ее заряд нейтрализуется.
Коагуляция – явление слипания коллоидных частиц и выпадения их в осадок – наблюдается при нейтрализации зарядов этих частиц, когда в коллоидный раствор добавляют электролит. При этом раствор превращается в суспензию или гель. Некоторые органические коллоиды коагулируют при нагревании (клей, яичный белок) или при изменении кислотно-щелочной среды раствора.
2. Гели или студни представляют собой студенистые осадки, образующиеся при коагуляции золей. К ним относят большое количество полимерных гелей, столь хорошо известные вам кондитерские, косметические и медицинские гели (желатин, холодец, мармелад, хлеб, мясо, джем, желе, мармелад, кисель, сыр, творог, простокваша, торт “Птичье молоко”) и конечно же бесконечное множество природных гелей: минералы (опал), тела медуз, хрящи, сухожилия, волосы, мышечная и нервная ткани и т.д. Историю развития на Земле можно одновременно считать историей эволюции коллоидного состояния вещества. Со временем структура гелей нарушается (отслаивается) – из них выделяется вода. Это явление называют синерезисом.
Студни − это структурированные системы со свойствами эластичных твердых тел. Студнеобразное состояние вещества можно рассматривать как промежуточное между жидким и твердым состоянием.
Студни высокомолекулярных веществ могут быть получены в основном двумя путями: методом образования студней из растворов полимеров и методом набухания сухих высокомолекулярных веществ в соответствующих жидкостях.
Процесс перехода раствора полимера или золя в студень называется студнеобразованием. Студнеобразование связано с увеличением вязкости и замедлением броуновского движения и заключается в объединении частиц дисперсной фазы в форме сетки или ячеек и связывании при этом всего растворителя.
На процесс студнеобразования существенно влияет природа растворенных веществ, форма их частиц, концентрация, температура, время процесса и примеси других веществ, особенно электролитов.
На основании свойств студни делят на две большие группы:
а) эластичные, или обратимые, получаемые из высокомолекулярных веществ;
б) хрупкие, или необратимые, получаемые из неорганических гидрофобных золей.
Как уже говорилось, студни высокомолекулярных веществ могут быть получены не только методом студнеобразования растворов, но и методом набухания сухих веществ. Ограниченное набухание заканчивается образованием студня и не переходит в растворение, а при неограниченном набухании студень - промежуточная стадия на пути к растворению.
Для студней характерен ряд свойств твердых тел: они сохраняют форму, обладают упругими свойствами и эластичностью. Однако их механические свойства определяются концентрацией и температурой.
При нагревании студни переходят в вязкотекучее состояние. Этот процесс называется плавлением. Он обратим, так как при охлаждении раствор снова образовывает студень.
Многие студни способны разжижаться и переходить в растворы при механическом воздействии (перемешивание, встряхивание). Этот процесс обратим, так как в состоянии покоя через некоторое время раствор образовывает студень. Свойство студней многократно изотермически разжижаться при механических воздействиях и образовывать студень в состоянии покоя называется тиксотропией. К тиксотропным изменениям способны, например, шоколадная масса, маргарин, тесто.
Имея в своем составе огромное количество воды, студни, кроме свойств твердых тел, обладают и свойствами жидкого тела. В них могут протекать различные физико-химические процессы: диффузия, химические реакции между веществами.
Свежеприготовленные студни с течением времени подвергаются изменениям, так как процесс структурирования в студне продолжается. При этом на поверхности студня начинают появляться капельки жидкости, которые, сливаясь, образуют жидкую среду. Образующаяся дисперсионная среда является разбавленным раствором полимера, а дисперсная фаза – студнеобразная фракция. Такой самопроизвольный процесс разделения студня на фазы, сопровождающийся изменением объема студия, называет синерезисом (отмоканием).
Синерезис рассматривается как продолжение процессов, обусловливающих образование студня. Скорость синерезиса различных студней различна и зависит в основном от температуры и концентрации.
Синерезис у студней, образованных полимерами, частично обратим. Иногда достаточно нагревания, чтобы студень, претерпевший синерезис, вернуть в исходное состояние, В кулинарной практике этим способом пользуются, например, для освежения каш, пюре, черствого хлеба. Если при хранении студней возникают химические процессы, то синерезис усложняется и его обратимость теряется, происходит старение студня. При этом студень теряет способность удерживать связанную воду (черствение хлеба). Практическое значение синерезиса довольно велико. Чаще всего синерезис в быту и промышленности нежелателен. Это черствение хлеба, отмокание мармелада, желе, карамели, фруктовых джемов.
5. Растворы высокомолекулярных веществ.
Полимеры, подобно низкомолекулярным веществам, в зависимости от условий получения раствора (природа полимера и растворителя, температура и др.) могут образовывать как коллоидные, так и истинные растворы. В связи с этим принято говорить о коллоидном или истинном состоянии вещества в растворе. Мы не будем касаться систем «полимер – растворитель» коллоидного типа. Рассмотрим только растворы полимеров молекулярного типа. Следует отметить, что вследствие больших размеров молекул и особенностей их строения, растворы ВМС обладают рядом специфических свойств:
1. Равновесные процессы в растворах ВМС устанавливаются медленно.
2. Процессу растворения ВМС, как правило, предшествует процесс набухания.
3. Растворы полимеров не подчиняются законам идеальных растворов, т.е. законам Рауля и Вант-Гоффа.
4. При течении растворов полимеров возникает анизотропия свойств (неодинаковые физические свойства раствора в разных направлениях) за счет ориентации молекул в направлении течения.
5. Высокая вязкость растворов ВМС.
6. Молекулы полимеров, благодаря большим размерам, проявляют склонность к ассоциации в растворах. Время жизни ассоциатов полимеров более длительное, чем ассоциатов низкомолекулярных веществ.
Процесс растворения ВМС протекает самопроизвольно, но в течение длительного времени, и ему часто предшествует набухание полимера в растворителе. Полимеры, макромолекулы которых имеют симметричную форму, могут переходить в раствор, предварительно не набухая. Например, гемоглобин, печеночный крахмал – гликоген при растворении почти не набухают, а растворы этих веществ не обладают высокой вязкостью даже при сравнительно больших концентрациях. В то время, как вещества с сильно асимметрическими вытянутыми молекулами при растворении очень сильно набухают (желатин, целлюлоза, натуральный и синтетические каучуки).
Набухание – это увеличение массы и объема полимера за счет проникновения молекул растворителя в пространственную структуру ВМС.
Различают два вида набухания: неограниченное, заканчивающееся полным растворением ВМС (например, набухание желатины в воде, каучука в бензоле, нитроцеллюлозы в ацетоне) и ограниченное, приводящее к образованию набухшего полимера – студня (например, набухание целлюлозы в воде, желатина в холодной воде, вулканизованного каучука в бензоле).
Дата добавления: 2017-05-02; просмотров: 20096;











