ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ
Вода является очень слабым электролитом.
Процесс электролитической диссоциации воды протекает по схеме
Н2О ⇄ Н+ + ОН– , DН = 57,4 кДж/моль.
С учетом гидратации водородного иона, сопровождающейся образованием гидроксоний-иона H3O+, уравнение электролитической диссоциации воды можно записать более строго
2H2O ⇄ H3O+ + OН– .
Процессу электролитической диссоциации воды соответствует константа диссоциации
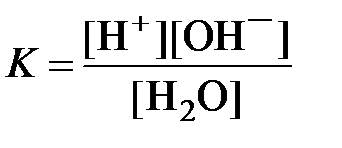 .
.
По электрической проводимости экспериментально установлено, что при 22 0С К = 1,8·10 –16. Так как вода диссоциирует в очень малой степени, можно считать, что равновесная концентрация воды [H2O] постоянная величина.
В 1 л воды (1 л @ 1 кг) содержится 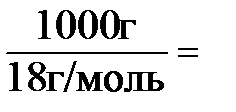 55,6 моль воды.
55,6 моль воды.
Уравнение (76) можно представить в форме
[H+] [OH–] = K [H2O] = 1,8 ·10 –16·55,6 = 10 –14
Следовательно, произведение концентраций ионов является при данной температуре постоянной величиной
[H+]·[OH–] = Kв.
Константа Kв называется ионным произведением воды.
Так как в воде концентрации катионов водорода (гидроксония) и гидроксид-анионов равны, то
[H+] = [OH–] = 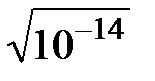 = 10 – 7 (моль/л)
= 10 – 7 (моль/л)
Растворы, в которых [H+] = [OH–], являются нейтральными. В кислой среде [H+] > 10 –7 моль/л и соответственно [OH– ] < 10 –7 моль/л. В щелочной среде [H+] < 10 –7 моль/л и соответственно [OH–] > 10 –7 моль/л.
На практике для оценки характера среды пользуются концентрацией ионов водорода, причем для удобства берут отрицательный десятичный логарифм концентрации, который обозначается символом рН и называется водородным показателем.
Водородный показатель рН представляет собой десятичный логарифм концентрации ионов водорода, взятый с обратным знаком
рН = – lg[H+].
Для нейтрального раствора (при 22оC) pH = 7. В кислой среде
рН < 7, а в щелочной рН > 7.
Изменение pH раствора от 0 до 6 означает ослабление кислотности; при pH = 7 раствор нейтральный; при изменении pH от
7 до 14 происходит усиление щелочности раствора.
Измерение концентрации водородных ионов ведут колориметрическим методом или методом, основанным на измерении электродвижущих сил (ЭДС). Последний метод наиболее точен и применим к любым растворам (окрашенным и непрозрачным).
Колориметрический, или индикаторный, метод требует прозрачных окрашенных растворов и является менее точным. Он позволяет определить pH растворов от целых до десятых долей единицы. Индикаторный метод основан на сравнении изменяющейся окраски индикатора в определенных интервалах pH.
Дата добавления: 2019-12-09; просмотров: 618;











