ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
СВОЙСТВА РАСТВОРОВ ЭЛЕКТРОЛИТОВ
Распад вещества в растворе или в расплаве на ионы называетсяэлектролитической диссоциацией.
Вещества, распадающиеся в растворах или расплавах на ионы, называются электролитами.
К электролитам относятся вещества, имеющие ионную кристаллическую решетку (большинство солей и оснований), или вещества, состоящие из молекул с полярной связью (кислоты).
Положительно заряженные ионы называются катионами. Отрицательно заряженные ионы называются анионами.
Теорию электролитической диссоциации разрабатывали Аррениус, Д.И. Менделеев, И.А. Каблуков, Нернст, Дебай, Хюккель и другие ученые.
Основные положения теории электролитической диссоциации:
· возможность диссоциации определяется природой растворенного вещества и растворителя;
· электролитической диссоциации подвергаются ионные соединения и молекулярные соединения с полярным типом связи в полярных растворителях;
· вещества распадаются на ионы под действием растворителя;
· диссоциация – процесс обратимый. Наряду с прямым процессом диссоциации, происходит обратный процесс – ассоциация.
· ионы в растворе сольватированы (в водном растворе гидратированы), т. е. окружены оболочкой из молекул растворителя.
Источником энергии, необходимой для разрушения связей в растворяемом веществе, является взаимодействие растворенного вещества с растворителем. В общем случае это взаимодействие называется сольватацией, а если растворителем является вода, то взаимодействие называется гидратацией. Схематически гидратация ионов при растворении NaCl показана на рис. 1.
| – |
| + |
| + - |
| + |
| + |
| + |
| + |
| + |
| – |
| – |
| – |
| – |
| – |
| – |
| + |
| + - |
| - + |
| - + |
| - + |
| - + |
| + |
| – то |
| + |
| – то |
| + |
| – то |
| + |
| – |
| + |
| – |
| ++ |
| + |
| + |
| – |
| – |
| – |
| Cl— |
| + |
| – то |
| – |
| – |
| – |
| – |
| – |
| – |
| – |
| + |
| + |
| + |
| + |
| + |
| + |
| + |
| Na+ |
| NaCl |
Рис. 1. Электролитическая диссоциация соли в раствор
В водном растворе ионы гидратированы, т. е. окружены оболочкой из молекул воды. Гидратированные (сольватированные) ионы – это соединения с сильно полярной связью между катионом или анионом, с одной стороны, и окружающей их гидратной (сольватной) оболочкой, с другой стороны.
Иначе протекает диссоциация полярных молекул (рис. 2). Молекулы воды, притянувшиеся к концам полярной молекулы (диполь - дипольное взаимодействие) вызывают расхождение ее полюсов - поляризуют молекулу. Такая поляризация в сочетании с колебательным тепловым движением атомов в молекуле, а также с непрерывным тепловым движением окружающих ее молекул воды приводит к распаду полярной молекулы на ионы. Как и в случае растворения ионного кристалла, эти ионы гидратируются. При этом ион водорода Н+ (протон) оказывается прочно связанным с молекулой воды в ион гидроксония Н3О+. Так, при растворении в воде хлороводорода происходит процесс, который схематически можно выразить уравнением:
HCl + H2O ® H3O+ + Cl-.
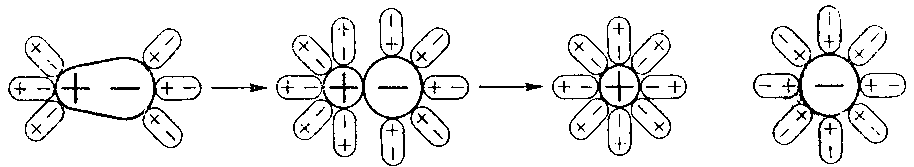
Рис. 2. Схема электролитической диссоциации
полярных молекул в растворе.
Теория электролитической диссоциации определяет кислоты, основания и соли по характеру их диссоциации.
Кислоты диссоциируют на катионы водорода (точнее – ионы гидроксония) и анионы кислотного остатка. Одноосновные кислоты диссоциируют в одну ступень, а многоосновные – в несколько ступеней:
Одноосновная кислота HNO3 + H2O ® H3O+ + NO3-,
или в упрощенном виде HNO3 ® H+ + NO3-.
Трёхосновная кислота
1 ступень: H3PO4 Û H+ + H2PO4-
2 ступень: H2PO4- Û H+ + HPO42-
3 ступень: HPO42- Û H+ + PO43-.
Основания диссоциируют на катион металла и анионы ОН-. Однокислотные основания диссоциируют в одну ступень, а многокислотные – в несколько ступеней:
Однокислотное основание КОН ® К+ + ОН-
Двухкислотное основание
1 ступень: Mg(OH)2 ® MgОH+ + ОH-
2 ступень: MgОH+ ® Mg2+ + ОH-
Амфотерные гидроксиды могут диссоциировать как по типу кислоты, так и по типу основания:
Zn2+ + 2OH- Û Zn(OH)2 + 2H2O Û 2H+ + [Zn(OH)4]2-
в кислой среде в щелочной среде
Например, при взаимодействии гидроксида цинка с кислотой протекает реакция:
Zn(OH)2 + 2HCl ® ZnCl2 + 2H2O
При взаимодействии этого же гидроксида со щёлочью будет протекать реакция:
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Соли диссоциируют на катионы металла или аммония и анионы кислотного остатка. Средние и двойные соли диссоциируют полностью в одну ступень:
К2SO3 ® 2К+ + SO32-
NН4Сr(SO4)2 ® NН4+ + Cr3+ + 2SO42-
Кислые и основные соли диссоциируют ступенчато:
1 ступень: КHSO3 ® K+ + HSO3-
2 ступень: HSO3- Û H+ + SO32-
1 ступень: CuOHCl ® CuOH+ + Cl-
2 ступень: CuOH+ Û Cu2+ + OH-
Дата добавления: 2019-12-09; просмотров: 423;










