Кристаллическое строение металлов
Согласно теории металлического состояния, металл представляет собой вещество, состоящее из положительных ядер, вокруг которых по орбиталям вращаются электроны. На последнем уровне число электронов невелико и они слабо связаны с ядром. Эти электроны имеют возможность перемещаться по всему объёму металла, т.е. принадлежать целой совокупности атомов. Таким образом, пластичность, теплопроводность и электропроводность обеспечиваются наличием «электронного газа».
Все металлы – тела кристаллические. Атомы в кристалле располагаются в определенных местах. Кристаллическое строение можно представить себе в виде решетки, в узлах которой расположены атомы. Расстояние между центрами атомов измеряются в «ангстремах» (1А = 1·10-8 см). Элементарная ячейка – элемент объёма из минимального числа атомов, многократным переносом которого в пространстве можно построить весь кристалл.
Элементарная ячейка характеризует особенности строения кристалла. Основными параметрами кристалла являются (рисунок 1):
• размеры рёбер элементарной ячейки. а, b, с - периоды решётки - расстояния между центрами ближайших атомов. В одном направлении выдерживаются строго определёнными;
• углы между осями (α, β, χ);
• координационное число (К) указывает на число атомов, расположенных на ближайшем одинаковом расстоянии от любого атома в решетке;
• базис решетки количество атомов, приходящихся на одну элементарную ячейку решетки;
• плотность упаковки атомов в кристаллической решетке – объем, занятый атомами, которые условно рассматриваются как жесткие шары. Ее определяют как отношение объема, занятого атомами к объему ячейки (для объемно-центрированной кубической решетки - 0,68, для гранецентрированной кубической решетки - 0,74) .

Рисунок 1. Элементарная ячейка
Классификация возможных видов кристаллических решеток была проведена французским ученым О. Браве, соответственно они получили название «решетки Браве». Всего для кристаллических тел существует четырнадцать видов решеток, разбитых на четыре типа;
• примитивный – узлы решетки совпадают с вершинами элементарных ячеек;
• базоцентрированный – атомы занимают вершины ячеек и два места в противоположных гранях;
• объемно-центрированный – атомы занимают вершины ячеек и ее центр;
• гранецентрированный – атомы занимают вершины ячейки и центры всех шести граней.
Основными типами кристаллических решёток являются (рисунок 2):
1. Объемно-центрированная кубическая (ОЦК) (рисунок 2 а), атомы располагаются в вершинах куба и в его центре (V, W, Ti, Feα);
2. Гранецентрированная кубическая (ГЦК) (рисунок 2 б), атомы располагаются в вершинах куба и по центру каждой из 6 граней (Ag, Au, Feγ);
3. Гексагональная, основой которой является шестиугольник, может быть простая – когда атомы располагаются в вершинах и по центру оснований (графит), и плотноупакованная (ГПУ) (рисунок 2 в) – когда решетка имеет 3 атома, расположенных на некотором расстоянии от центров трех граней (цинк).
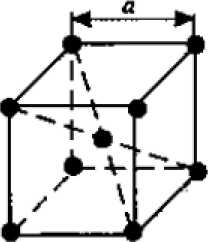
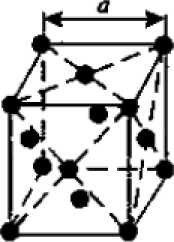
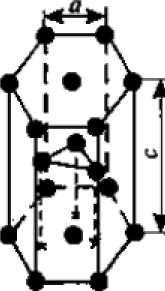
а) б) в)
Рисунок 2. Основные типы кристаллических решеток:
а) ОЦК; б) ГЦК; в) ГПУ
Дата добавления: 2017-04-05; просмотров: 2400;











