Сосудисто-тромбоцитарный гемостаз сводится к образованию тромбоцитарной пробки, или тромбоцитарного тромба.
Условно разделяют на три стадии:
1) временный (первичный) спазм сосудов;
2) образование тромбоцитарной пробки за счет адгезии и агрегации тромбоцитов.
Адгезия – прикрепление к поврежденной поверхности.
Агрегация – склеивание между сосбой.
3) ретракция (сокращение и уплотнение) тромбоцитарной пробки.
Первичный спазм кровеносных сосудов наблюдается сразу после травмы. В первые секунды кровотечение может не возникнуть или носит ограниченный характер. Спазм обусловлен выбросом в кровь (в ответ на болевое раздражение) адреналина и норадреналина и длится не более 10 – 15 с.
В дальнейшем наступает вторичный спазм, обусловленный активацией тромбоцитов и отдачей в кровь сосудосуживающих агентов – серотонина, ТхА2, адреналина и др.
Повреждения сосудов сопровождаются немедленной активацией тромбоцитов. Это обусловлено появлением высоких концентраций АДФ (из разрушающихся эритроцитов и травмированных сосудов). Также – обнажение субэндотелия, коллагеновых и фибриллярных структур. В результате «раскрываются» вторичные рецепторы и создаются оптимальные условия для адгезии, агрегации тромбоцитов и образования тромбоцитарной пробки.
Адгезия обусловлена наличием в плазме и тромбоците особого белка – фактора Виллебранда (FW). Он имеет три активных центра связывания, 2 – связываются с экспрессированными рецепторами тромбоцитов, а один – с рецепторами субэндотелия и коллагеновых волокон. Т.е. тромбоцит с помощью FW оказывается «подвешенным» к травмированной поверхности сосуда.
Одновременно с адгезией наступает агрегация тромбоцитов осуществляющаяся с помощью фибриногена – белка, содержащегося в плазме и тромбоцитах и образующего между тромбоцитами связывающие мостики. Это приводит к образованию тромбоцитарной пробки.
Важную роль в адгезии и агрегации играет комплекс белков и полипептидов, называемых «интегрины». Служат связывающими агентами между тромбоцитами и между тромбоцитами и структурами поврежденного сосуда.
Агрегация может носить обратный характер. При недостаточной дозе агрегирующего (активирующего) агента наступает дезагрегация.
Из тромбоцитов, подвергающихся агрегации, усиленно секретируются гранулы и содержащиеся в них БАВ – АДФ, адреналин, норадреналин, фактор Р4 (антигепариновый), ТхА2 (тромбоксан А2) и др. (реакция высвобождения). Это приводит к вторичной, необратимой агрегации.
Одновременно с высвобождением тромбоцитарных факторов происходит образование тромбина, резко усиливающего агрегацию и приводящего к появлению сети фибрина, в которой застревают отдельные эритроциты и лейкоциты.
Благодаря контрактильному белку тромбостенину тромбоциты подтягиваются друг к другу, тромбоцитарная пробка сокращается и уплотняется, т.е. наступает ее ретракция.
В норме остановка кровотечения из мелких сосудов занимает 2 – 4 мин.
Важную роль для сосудисто-тромбоцитарного гемостаза играют производные арахидоновой кислоты – простагландин I2 (РgI2) или простациклин, и ТхА2 (тромбоксан). При сохранении целости эндотелиального покрова действие PgI2 преобладает над действием TxA2 (т.е. не наблюдается адгезии и агрегации). При повреждении эндотелия в месте травмы синтеза PgI2 не происходит, и тогда проявляется влияние тромбоксана, приводящее к образованию тромбоцитарной пробки.
При повреждении крупных кровеносных сосудов тромбоцитарная пробка не способна остановить кровотечения, т.к. она вымывается током крови.
В этих случаях повышается значимость процесса свертывания крови, сопровождающегося образованием фибринового сгустка.
В этом процессе принимают участие плазменные факторы гемокоагуляции (плазменный гемостаз). Это комплекс белков, находящихся в плазме, большинство являются проферментами. В отличие от тромбоцитарных факторов обозначаются римскими цифрами.
I – фибриноген. Белок. Образуется в печени, под влиянием тромбина переходит в фибрин. Участвует в агрегации тромбоцитов. Необходим для репарации тканей.
II – протромбин. Гликопротеид. Образуется в печени в присутствии витамина К. Под влиянием протромбиназы переходит в тромбин (фактор II а).
III – тромбопластин. Состоит из белка апопротеина III и комплекса фосфолипидов. Входит в состав мембран многих тканей. Является матрицей для развертывания реакций, направленных на образование протромбиназы по внешнему механизму.
IV - ион Са2+. Участвует в образовании комплексов, входит в состав протромбиназы. Способствует агрегации тромбоцитов. Связывает гепарин. Принимает участие в ретракции сгустка и тромбоцитарной пробки. Тормозит фибринолиз.
V - акцелератор-глобулин. Белок. Образуется в печени. Активируется тромбином (IIа). Создает оптимальные условиях для взаимодействия фактора Xа и протромбина (II)
VI – исключен из классификации.
VII – проконвертин. Гликопротеид. Образуется в печени под влиянием витамина К. Принимает участие в формировании протромбиназы по внешнему механизму. Активируется факторами XIIа, Xа, IХа, IIа и при взаимодействии с тромбопластином (III).
VIII - антигемофильный глобулин А. Гликопротеид. Синтезируется в печени, селезенке, лейкоцитах. Образует комплексную молекулу с фактором Виллебранда (FW) и специфическим антигеном. Активируется тромбином. Создает оптимальные условия для взаимодействия факторов IХа и X. При его отсутствии возникает заболевание гемофилия А.
VIII – FW. компонент комплекса ф. VIII. Образуется эндотелиальными клетками. Обеспечивает устойчивость фактора VIII. Необходим для адгезии тромбоцитов. При его недостатке развивается болезнь Виллебранда, сопровождающаяся нарушением сосудисто-тромбоцитарного гемостаза.
IX - Кристмас-фактор, антигемофильный ф. В. Гликопротеид. Образуется в печени под влиянием витамина К. Активируется XIа, VIIа, и IIа. Приводит фактор X в Xа. При его отсутствии – гемофилия В.
X - Стюарт-Прауэр-фактор. Гликопротеид. Образуется в печени под влиянием витамина К. Являясь протромбиназой, активируется VIIа и IХа. Переводит II в IIа.
XI - плазменный предшественник тромбопластина. Гликопротеид. Образуется в печени. Активируется XIIа, калликреином совместно с высокомолекулярным кининогеном (ВМК).
XII - фактор Хагемана. Белок. Предп., образуется эндотелиальными клетками, лейкоцитами, макрофагами. Активируется отрицательно заряженными поверхностями, адреналином, калликреином. Запускает внешний и внутренний механизм образования протромбиназы и фибринолиза, активирует фактор XI и прекалликреин.
XIII - фибринстабилизирующий фактор (ФСФ) фибринолиза. ФСФ – глобулин. Синтезируется фибробластами и мегакариоцитами.
Фактор Флетчера, или прекалликреин. Белок. Участвует в активации XII, плзминогена и ВМК.
Фактор Фитцджеральда, высокомолекулярный кининоген (ВМК). Образуется в тканях. Активируется калликреином. Принимает участие в активации XII, XI и фибринолиза.
Активация плазменных факторов происходит главным образом за счет протеолиза и сопровождается отщеплением пептидных ингибиторов. Активные состояния обозначаются присоединением к номеру «а».
Плазменные фаторы делят на:
1. витамин К- зависимые (образуется преимущественно в печени под влиянием К).
2. витамин К- независимые.
В эритроцитах много соединений, аналогичных тромбоцитарным факторам. Важнейший – частичный тромбопластин (напоминает Р3), входящий в состав мембраны. Также большое количество АДФ, фибриназы и т.д. При травме около 1 % эритроцитов вытекающей крови разрушается, способствуя образованию тромбоцитарной пробки и фибринового сгустка.
Лейкоциты – содержат лейкоцитарные факторы. Моноциты и макрофаги при стимуляции антигеном синтезируют белковую часть тромбопластина (III) – апопротеин III. Является продуцентами витамин К-зависимых факторов свертывания: II, VII, IX и X.
Процесс свертывания крови – преимущественно проферментно-ферментный каскад, в котором проферменты, переходя в активное состояние, приобретают способность активировать другие факторы свертывания крови. Подобная активация может носить последовательный и ретроградный характер.
Три фазы процесса свертывания крови:
1) комплекс последовательных реакций, приводящий к образованию протромбиназы;
2) под влиянием протромбиназы переход протромбина (II) в тромбин (IIа).
3) под влиянием тромбина из фибриногена образуется фибрин.
Первая фаза - образование протромбиназы – может происходить по внешним и внутренним механизмам (Рис. 21).
Внешний механизм предполагает обязательное присутствие тромбопластина (III). Формирование протромбиназы начинается с активации фактора VII при его взамодействии с тромбопластином и фактором XIIа.
VII может переходить в деятельное состояние под влиянием XIа, IXа, Xа, IIа и калликреина.
VIIа переводит X в Xа (появление протромбиназы), а также активирует IX, и этим участвует в образовании протромбиназы по внутреннему механизму.
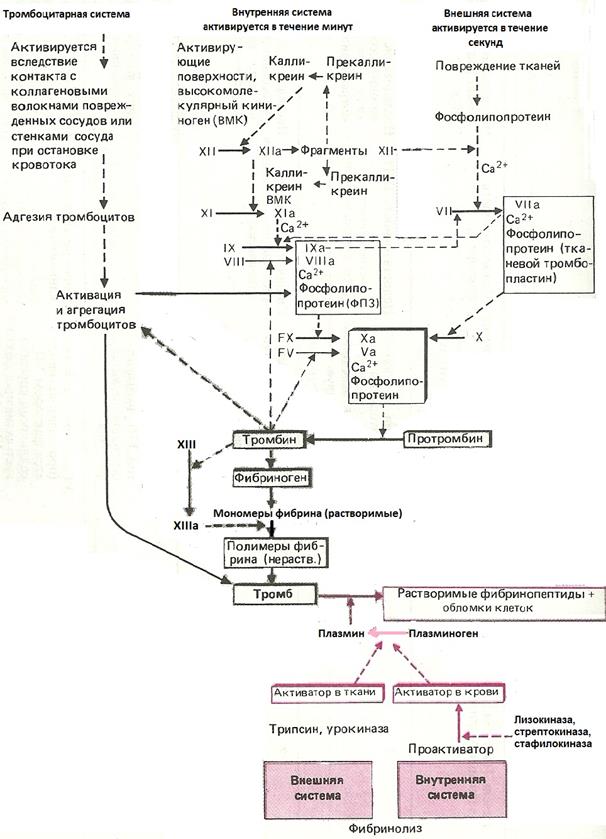
Рис. 21. Схема свёртывания крови и фибринолиза.
Образование протромбиназы по внешнему пути происходит быстро (20 – 30 с), ведет к появлению небольшой порции тромбина (IIа), который способствуют необратимой агрегации тромбоцитов, активации факторов XIII и V и значительно ускоряет формирование протромбиназы по внутреннему механизму.
Внутренний механизм связан с участием тромбоцитов (фактор Р3) или разрушенных эритроцитов. Инициатором внутреннего механизма образования протромбиназы является фактор XII, который активируется травмированной поверхностью стенки сосуда, кожей, коллагеном, адреналином (в лабораторных условиях – при контакте со стеклом).
XIIа переводит XI в XIа. В этой реакции может принимать участие калликреин (активируется XIIа) и ВМК (активируется калликреином).
XIа оказывает влияние на IX, переводя его в IХа. IХа – направляется на протеолиз Х при обязательном участии VIII (VIIIа). Активация Х под влиянием VIII и IXа называется теназной реакцией.
Вторая фаза: переход II в IIа осуществляется под влиянием протромбиназы (Ха) в присутствии Vа и сводится к протеолитическому расщеплению протромбина; появляется фермент тромбин, обладающий свертывающей активностью.
Третья фаза: переход фибриногена в фибрин носит поэтапный характер.
Под влиянием IIа от фибриногена отщепляются фибринопептиды и образуют фибрин–мономер Iм. Из него, за счет полимеризации формируются олигомеры и димеры фибрина (Iо и Id). Из них за счет продольного и поперечного связывания образуются протофибриллы – легкорастворимый фибрин Is (быстро лизирующийся под влиянием плазмина, трипсина).
В дальнейшем под влиянием XIII (ФСФ), который после активации тромбином в присутствии Са2+ прошивает фибринполимеры дополнительными перекрестными связями, появляется труднорастворимый фибрин, i (insolulle).
Сгусток становится резистентным к фибринолитическим (протеолитическим) агентам.
Образовавщийся фибриновый сгусток благодаря тромбоцитам, входящим в его структуру, сокращается и уплотняется (наступает ретракция) и прочно закупоривает сосуд.
Свертывание крови, контактирующей с травмированными тканями, осуществляется за 5 – 10 минут. Основное время уходит на образование протромбиназы. Переход протромбина в тромбин и фибриногена в фибрин осуществляется довольно быстро.
В естественных условиях время свертывания крови может уменьшаться (гиперкоагуляция) или удлиняться (гипокоагуляция).
Фибринолиз.
Фибринолиз является неотъемлемой частью системы гемостаза, всегда сопровождает процесс свертывания крови и активируется факторами, принимающими участие в этом процессе.
Предотвращает закупорку кровеносных сосудов фибриновыми сгустками.
Ведет к реканализации сосудов после остановки кровотечения.
Ферментом, разрущающим фибрин, является «плазмин» («фибринолизин»). В циркуляции находятся в неактивном состоянии в виде профермента плазминогена.
Может протекать по внешнему и внутреннему механизму.
Внешний фибринолиз осуществляется при участии тканевых активаторов, которые синтезируются в эндотелии сосудов – тканевой активатор плазминогена (ТАП), урокиназа. Последняя также образуется в юкстагломерулярном аппарате почки.
Внутренний фибринолиз осуществляется плазменными активаторами, а также активаторами форменных элементов. Разделен на Хагеман-зависимый и Хагеман – независимый.
Хагеман-зависимый протекает под влиянием XIIа, калликреина и ВМК, которые переводят плазминоген в плазмин.
Хагеман-независимый (под влиянием активаторов плазминогена форменных элементов и активированных протеинов) определяется наиболее быстро и носит срочный характер. Его основное назначение сводится к очищению сосудистого русла от нестабилизированного фибрина, образующегося в процессе внутрисосудистого свертывания крови.
Образовавшийся в результате активации плазмин вызывает расщепление фибрина. При этом появляются ранние (крупномолекулярные) и поздние (низкомолекулярные) продукты фибринолиза.
В плазме находятся и ингибиторы фибринолиза: α2 – антиплазмин (связ. плазмин, трипсин, калликреин, урокиназу, ТАП). α2 – протеазный ингибитор α2-макроглобулин, С1 – протеазный ингибитор. Ряд ингибиторов активатора плазминогена, синтезируется эндотелием, макрофагами, моноцитами, фибробластами.
Дата добавления: 2017-03-12; просмотров: 3222;











