Строение и свойство белков
После того как было выяснено,что аминокислоты это структурныеэлементы белка, встал вопрос о том как они связаны между собой в белковой молекуле.
Еще 1888г. Данилевский А.Я. на основании изучения биуретовой с которой Вы знакомы реакцией высказал сообщение, что тип соединения групп в разных белковых веществах одинаков, таким типом связи является –СО – NH -,которая возникает при взаимодействии «СОО» групп одной аминокислоты и NH2 – другой с выделением Н2О(написать пептид)
Если связь -СО – NH – возникает в результате отщепления Н2О, значит гидролиз должен сопровождаться образованием свободных «СООН» и «NH2» - групп в эквивалентных количествах.
После того как был установлен аминокислотный состав м.в. тип связи в молекулах белка, возникла необходимость определить в какой последовательности соединяются аминокислоты в белке. Первичная структура – это последовательное расположение аминокислот в полипептидной цепи именно: порядок расположения аминокислот в полипептидной цепи, обуславливает огромное разнообразие белков в природе и в организме человека(рис.1). 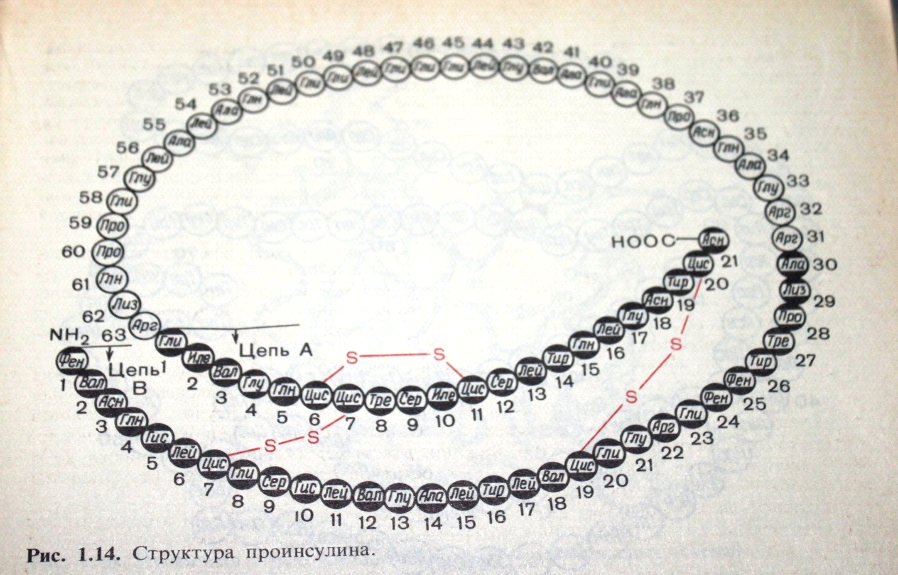 Эта структура определена самим синтезом белка и является наследственной. Пептидная связь может существовать в транс-форме (радикалы по углам от пептидной связи) в цис-форме (по одну сторону). В белки входит пептидная связь в транс-форме и она позволяет образовывать регулярную структуру в виде альфа спирали. Вторичная структура белка – это винтообразное расположение аминокислотных остатков на предполагаемой цилиндрической поверхности белка. Фиксирована альфа спираль «Н» - связями, они слабые, но их много, поэтому более прочно стабилизируют 2ю структуру белка в соответствии с программой заложения в 10 структуре.
Эта структура определена самим синтезом белка и является наследственной. Пептидная связь может существовать в транс-форме (радикалы по углам от пептидной связи) в цис-форме (по одну сторону). В белки входит пептидная связь в транс-форме и она позволяет образовывать регулярную структуру в виде альфа спирали. Вторичная структура белка – это винтообразное расположение аминокислотных остатков на предполагаемой цилиндрической поверхности белка. Фиксирована альфа спираль «Н» - связями, они слабые, но их много, поэтому более прочно стабилизируют 2ю структуру белка в соответствии с программой заложения в 10 структуре. 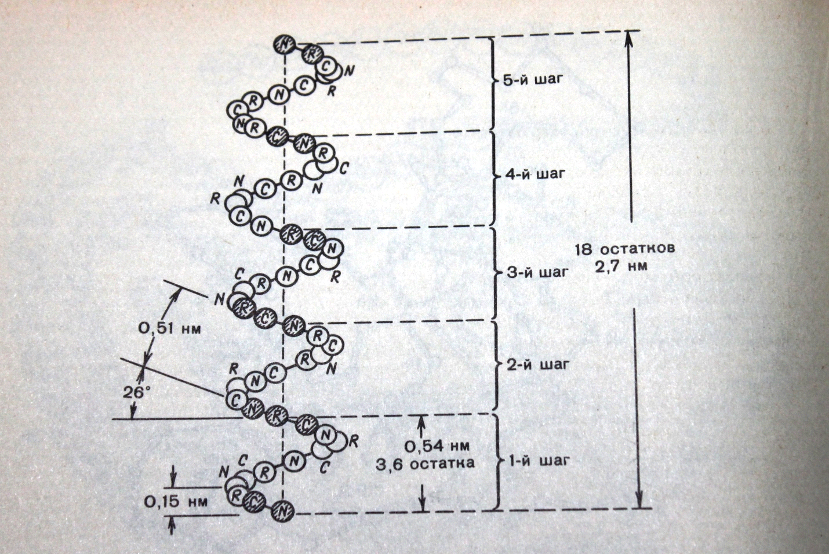
Альфа структура характерна для глобулярных белков (альбумин, глобулин) некоторые фибриллярные белки (фиброны шелка, кератин и другие). Эти белки имеют вытянутую конформацию, представляющую собой как бы последовательный ряд листков, расположенных под углом друг к другу, получившая название
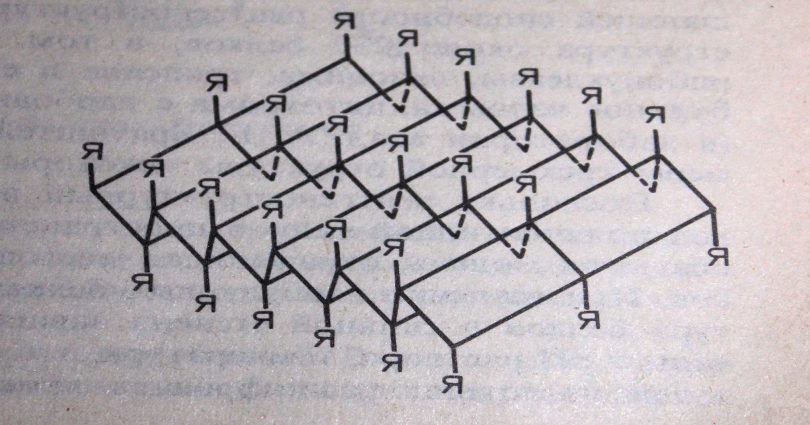
В-конформации. Параллельные цепи, находящиеся в В-конформации связываются между собой поперечными межцепочными водородными связями и образуют структуры, называемые структурами складчатого слоя.
Под третичной структурой подразумевают пространтственную орентацию полипептидной цепи в определенном объеме. Первым белком третичной структуры, которого было выяснено ДЖ Кендрью, на основании рентгеноструктурного анализа явился миоглобин кашалота.
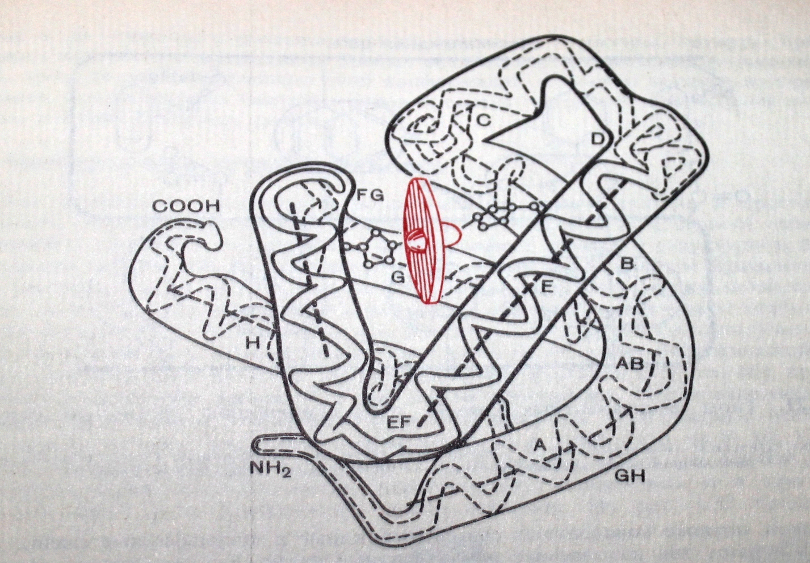
В настоящее время установлено, что третичную структуру стабилизируют некоторые типы нековалентных связей
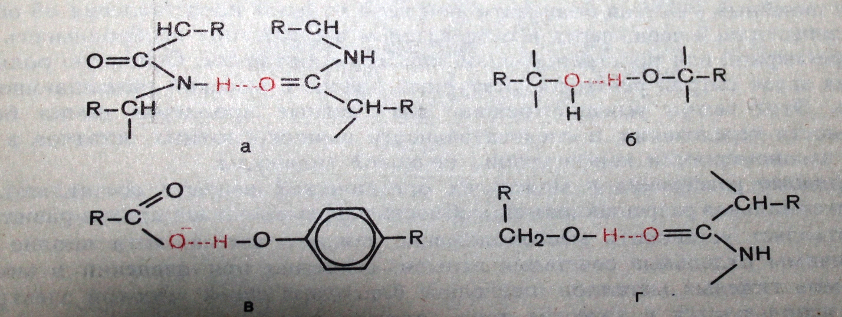
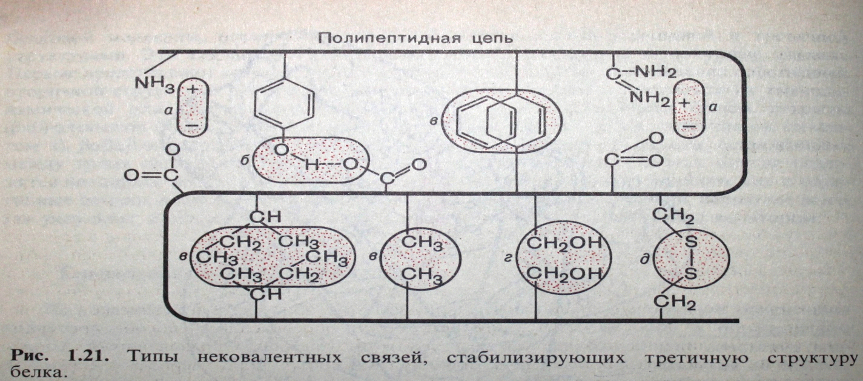 Они возникают между NH и CO группами соединенных цепей. Эти поперечные «Н» связи придают этой структуры большую стабильность энергии этих связей по сравнению с энергий ковалентных таких как -СО – NH –HS – S мала таких как 1-7 ккал/моль, но благодаря своей многочисленности они обеспечивают устойчивость конфигурации макромолекулам.
Они возникают между NH и CO группами соединенных цепей. Эти поперечные «Н» связи придают этой структуры большую стабильность энергии этих связей по сравнению с энергий ковалентных таких как -СО – NH –HS – S мала таких как 1-7 ккал/моль, но благодаря своей многочисленности они обеспечивают устойчивость конфигурации макромолекулам.
В подержании 3й структуры участвую различные типы связей. Рассмотрим связи стабилизирующие структуру белковых молекул. Все эти типы связей (ковалентные и нековалентные) фиксируют пептид пристроенное расположение полипептидной цепи и под воздействием повреждающих факторов нарушают нековалентные связи (денатурация)
Изопептид дисульфидные водородные неполярные ионная
Используя метод рентгеностного анализа Кендрью 1957 установил 3ю структуру
• На этой схеме представлен нековалентной связью, стабилизирующие 3ю структуру белка.
• В настоящее время установлены третичные структуры еще нескольких белков миоглобина, лизоцима, рибонуклеазы и другие, запасают, транспортирую кислород в мышце.
Некоторые белки имеют 4ю структуру, которая возникает путем объединения нескольких субъединиц в одну крупную макромолекулу, являющуюся единым образованием в структурном и функциональном отношении.
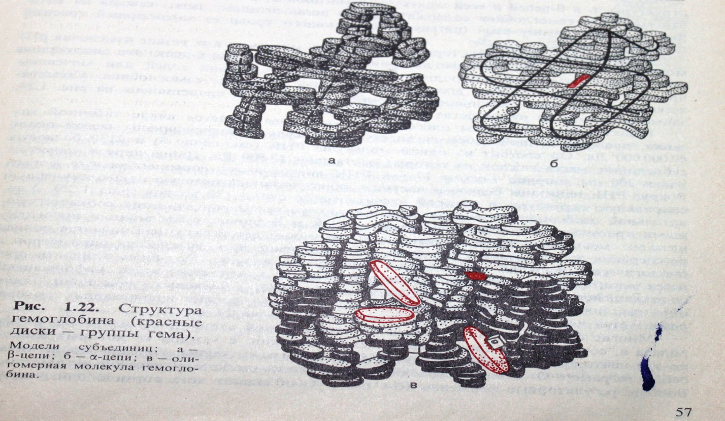 Каждая из субъединиц имеет собственную 1,2,3 структуры. К таким белкам относятся гемоглобин – красный пигмент крови, у млекопитающих состоит из 4х субъединиц (2 альфа и 2 бетта) не содержащий ни одной дисульфидной связи (-S--S-), а удерживаются они друг возле друга с помощью (нековалентых связей) солевых мостиков. При изучении 4й структуры было обнаружено, что объединение отдельных субъединиц в одну маромолекулу происходит самопроизвольно из других белков. Большинство белков имеющих м.в. более 500000 имеют 4ю структуру. К таким белкам относятся ЛДГ.
Каждая из субъединиц имеет собственную 1,2,3 структуры. К таким белкам относятся гемоглобин – красный пигмент крови, у млекопитающих состоит из 4х субъединиц (2 альфа и 2 бетта) не содержащий ни одной дисульфидной связи (-S--S-), а удерживаются они друг возле друга с помощью (нековалентых связей) солевых мостиков. При изучении 4й структуры было обнаружено, что объединение отдельных субъединиц в одну маромолекулу происходит самопроизвольно из других белков. Большинство белков имеющих м.в. более 500000 имеют 4ю структуру. К таким белкам относятся ЛДГ.
Выяснены структуры разнообразных белков может служить источником к познанию природы живых систем и соответственно сущности жизни. В связи с этим могут быть решены многие проблемы наследственных заболеваний человека, связанные с дефектами структуры и биосинтеза белка. Раз исследователи считают о возможности существования 5го уровня структурной организации белков. Здесь имеется ввиду полифункциональных макромолекулярных комплексов из разных форменных (пируват.денатур.комплекс).
Известно одно из заболеваний крови – серповидная анемия. При этой болезни красные кровяные шарики отдавая захваченный в легких кислорода тканям принимают форму серпа НвS. Исследовав аномальный гемоглобин биохимии обнаружили, что одна аминокислота стоящая по счеты 6 (глу) заменимые (вал). Фрагмент цепи
№вал-гис-лей-тре-про-глу-гли-лиз; №ал-гис-лей-тре-про-вал-глу-лиз
Вал не имеет электрического заряда, а 4 глу – отрицателен. В результате потери заряда молекулы аномального гемоглобина снижается и не могут функционировать. Форму серпа – гемоглобин вызывает из строя – наступает анемия. Это примеры показывающие как изменяется последовательности аминокислот, вызывают тяжелые последствия в организме. Эти заболевания получили название «молекулярных болезней», но не всегда замена аминокислот в первичной структуре белка является летальной. В настоящее время известно до 300 аномалий вызванных заменой одной аминокислоты в той или иной цепи гемоглобина. В связи с этим Джеральд и Ингрем в 1961г. Выступили с предложением срочно отказаться от буквенных обозначений новых типов гемоглобина и называется по местожительству их обнаружения (городом) (так стали известны гемм Лондон, Нью-Йорк, Москва) Для гемоглобина Москва характерны замена в В-цепи в положении 24 аминокислоты –асп- на –лей- аномальных свойств Нв не отмечено.
Белки выполняют множество разнообразных функций, характерных для живых организмов. Основные из них:
Каталитическая –все известные в настоящее время ферменты являются белками, эта функция белков является уникальной, определяющая скорость химических реакций в биологических системах.
Питательная или резервная – эту осуществляют резервные белки, являющиеся источником питания, белки яйца, молока (казеин) и др.
Транспортная – перенос кислорода гемоглобином, белок в транспорте липидов принимает участие – альбумин. Ряд других сывороточных белков образуют комплексы с жирами и витамином А, плазмин, церуллоферетин (Fe) и др. обеспечивая их доставку в органы мишени (Сu)
Защитная – синтез специфических белков – антител в ответ на поступление бактерий, вирусов. Белок фибриноген способствует образованию сгустка крови, что предохраняет организм от потери крови.
Сократительная – характерна для белков мышечной ткани актина и миозина, участвующих в мышечном сокращении.
Структурная – коллаген соединительной ткани кератин волос, ногтей, в комплексе с липидами участвует в образовании биомембран клеток.
Гормональная – ряд гормонов представлен белками – гормона поджелудочной железы – глюкагон, инсулин, вазопрессин, окситоцин и другие.
Разные пищевые белки обладают неодинаковой пищевой ценностью, поэтому для удовлетворения пластических потребностей организма требуется детальное количество разных белков пищи. Чем ближе аминокислотный состав пищевого белка к аминокислотному составу белков тела тем больше его биологическая ценность. Биологическая ценность белка определяется присутствием незаменимых аминокислот (вал-иле-лей-лиз-мет-тре-три-фен) арг и гис – полузаменимые. Ряд белков (шерсть, перья и др.) несмотря на близкий аминокислотный состав к белкам тела не гидролизуются ферментами (нет таких ферментов)
Дата добавления: 2017-03-12; просмотров: 2416;











