Коррозия металлов. Сплавы
Поэт В. Шефнер писал: «Коррозия – рыжая крыса, грызёт металлический лом». А также есть народную мудрость: «Ржа ест железо».
Слово коррозия (от лат. сorrosio –разъедание) – это самопроизвольное разрушение металлов и сплавов под влиянием окружающей среды.

Каждый год из-за коррозии теряется около четверти всего произведённого в мире железа. Порча изделий из металла и потеря металлов обходится очень дорого. Затраты на ремонт или замену изделий во много раз превышают стоимость того металла, из которого они изготовлены.
Коррозия вызывает и серьёзные экологические последствия. Если происходит разрушение трубопроводов газа или нефти, то это приводит к загрязнению окружающей среды, а это негативно сказывается на здоровье людей.




Коррозию металлов и сплавов вызывают такие компоненты окружающей среды, как вода, кислород, оксиды углерода и серы, содержащиеся в воздухе, водные растворы солей (морская вода, грунтовые воды).

Различают коррозию:
· химическую
· электрохимическую
При химической коррозии металл разрушается под действием окислителей – неэлектролитов, например газов (кислорода, хлора и др.) при повышенной или даже обычной температурах.
2Fe + 3Cl2 = 2FeCl3
При электрохимической коррозии разрушение металлов происходит в растворах электролитов. Это значит, что в окружающей среде, где находится металл, должны быть вода и окислители: кислород, растворённые кислоты, соли. Так, под действием воздуха и содержащихся в нём паров воды на поверхности медных и бронзовых изделий образуется зелёная плёнка, называемая патиной.
2Cu + O2 + CO2 + H2O = (CuOH)2CO3

Но чаще всего коррозии подвергаются изделия из железа. Особенно сильно коррозирует металл во влажном воздухе и при соприкосновении с водой.
Процесс коррозии железа часто называют ржавлением. Автомобили, сельскохозяйственные машины, стальные балки, кухонная посуда – все эти изделия, будучи новыми, имеют гладкую, блестящую поверхность. Но при хранении во влажной атмосфере и при недостаточном уходе, они покрываются бурыми пятнами ржавчины, состав которой можно выразить обобщённой формулой Fe2O3 · nH2O.



При коррозии металлов и сплавов протекают окислительно-восстановительные реакции, в результате которых атомы металла, взаимодействуя с компонентами окружающей среды, окисляются, а сам окислитель восстанавливается. При этом металл из свободного состояния переходит в химические соединения – оксиды, сульфиды, гидроксиды. 4Fe + 3O2 + 6H2O = 4Fe(OH)3
Химически чистое железо почти не подвержено коррозии, а техническое железо, которое содержит различные примеси, ржавеет. Следовательно, одной из причин коррозии является наличие примесей в металле.

Возле города Дели в Индиинаходится железная колонна с очень маленькими пятнышками ржавчины, хотя её возраст почти 1700 лет. Это знаменитая Кутубская колонна высотой около семь м и массой шесть с половиной т. Согласно одной из гипотез, долговечность и коррозионная устойчивость колонны объясняются очень малым количеством различных примесей в железе и относительно невысокой влажностью, характерной для этой местности.

Например, если два различных металла, которые находятся в контакте между собой, опустить в водный раствор электролита (это могут быть грунтовые воды, сконденсированная влага из атмосферы), то металл более активный, расположенный в электрохимическом ряду напряжений левее, будет разрушаться, и тем самым предохранять менее активный металл от коррозии. Например, при контакте железа с медью в водной среде, железо, как более активный металл, постепенно коррозирует, переходя в воду в виде ионов железа. Таким образом, коррозия металла резко усиливается при соприкосновении его с менее активным металлом.

Образовавшиеся свободные электроны от атомов железа, перейдут к меди и на её поверхности соединяться с ионами водорода, которые образуются из компонентов водной среды (например, серной или других кислот). Этот электрохимический процесс можно представить так:
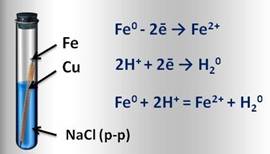
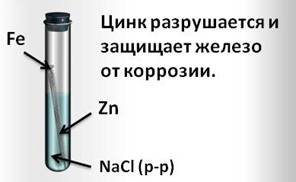
И, наоборот, при контакте железа с более активным цинком, цинк разрушается и защищает железо от коррозии.
Дата добавления: 2021-04-21; просмотров: 599;











