на смещение химического равновесия
Согласно принципу Ле-Шателье, при повышении температуры происходит смещение равновесия в сторону эндотермической реакции, то есть реакции, идущей с поглощением тепла. При понижении температуры равновесие смешается в направлении экзотермической реакции, идущей с выделением тепла.
Пример 8. Для экзотермической обратимой реакции
2SO2(г) + O2(г) Û 2SO3(г) ; DH = -239 кДж/моль
повышение температуры вызовет смешение равновесия влево (в сторону разложения SO3на SO2 и O2); понижение температуры сместит равновесие вправо (в сторону образования молекулSO3). Изменение температуры отразится на величине константы равновесия, т.к. в зависимости от природы веществ увеличение температуры на одинаковое число градусов вызовет неодинаковое увеличение скорости обеих реакций, вследствие чего концентрации веществ изменяются не пропорционально, и константа равновесия, соответственно, увеличивается или уменьшается.
Пример 9. Напишите выражение для константы равновесия системы:N2(г) + 3H2(г)Û 2NH3(г); DH = -92,4 кДж/моль.Изменением какого фактора (концентрации, давления или температуры) можно добиться уменьшения константы равновесия. В какую сторону сместится при этом равновесие системы?
Решение. Константа равновесия этой системы имеет вид:
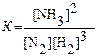
В соответствии с законом сохранения массы веществ, константа равновесия не зависит от концентрации веществ и давления газов (см. Пример 5 на стр.9), следовательно изменение Кравн. Может вызвать лишь изменение температуры реакции (влияние природы веществ; Пример 8, стр.11). Для того, чтобы уменьшить Кравн. надо чтобы концентрация NH3стала меньше концентрацииN2 иH2,т.е. равновесие в системе должно смешатся влево. Такое смещение вызовет повышение температуры в системе, в соответствии с принципом Ле шателье, т.к. обратная реакция эндотермическая.
Возможно одновременное изменение давления и температуры в системе. В этом случае надо отдельно разобрать влияние каждого фактора и на основании разбора сделать вывод о направлении смещения равновесия.
Пример 10.В какую сторону сместится равновесие гомогенной системы 2А  2С+Д; DH<0,если увеличить давление в системе в 2 раза и одновременно понизить температуру на 300. Температурный коэффициент скорости прямой и обратной реакций равен, соответственно, 2,0 и 3,0.
2С+Д; DH<0,если увеличить давление в системе в 2 раза и одновременно понизить температуру на 300. Температурный коэффициент скорости прямой и обратной реакций равен, соответственно, 2,0 и 3,0.
Решение. Разберем влияние изменения давления на скорость каждой реакции. По закону действия масс:
| v1 = k1[A]2, | v2 = k2[С]2[Д] |
Увеличение давления в 2 раза вызывает увеличение концентрации каждого из веществ в 2 раза (все вещества – газы), следовательно, скорости то же увеличиваются:
| v1 =k1(2[A])2=4 k1[A]2,т.е. увеличилась в 4 раза, | v2 = k2(2[С])2(2[Д])=8k2[С]2[Д], |
т.е. увеличилась в 8 раз.
Изменение скоростей реакции, вызванное понижением температуры, рассчитываем на основании правила Вант-Гоффа: 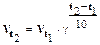 .
.
1. Для прямой реакции: 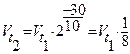 , т.е. скорость уменьшилась в 8 раз.
, т.е. скорость уменьшилась в 8 раз.
2. Для обратной реакции: 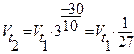 , т.е. скорость уменьшилась в 27 раз. В итоге произведенных действий скорость прямой реакции изменилась в
, т.е. скорость уменьшилась в 27 раз. В итоге произведенных действий скорость прямой реакции изменилась в 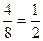 раз, а скорость обратной реакции – в
раз, а скорость обратной реакции – в 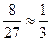 раза, т.е. обе скорости уменьшились, но скорость прямой реакции все же больше скорости обратной реакции, следовательно, равновесие сместится в сторону прямой реакции.
раза, т.е. обе скорости уменьшились, но скорость прямой реакции все же больше скорости обратной реакции, следовательно, равновесие сместится в сторону прямой реакции.
Дата добавления: 2016-12-16; просмотров: 2898;










