Группировка рака пищевода по стадиям.

Клиническая картина и данные объективного обследования
Клинические симптомы рака пищевода можно разделить на три группы: первичные, или местные, симптомы, обусловленные поражением стенок пищевода; вторичные симптомы, возникающие в результате распространения опухолевого процесса на соседние органы и ткани – признаки сдавления или прорастания опухолью пищевода или метастазами соседних органов и тканей; общие симптомы, неспецифичные для опухолевого поражения именно пищевода (паранеопластический синдром) – опухолевая интоксикация и деструкция в виде «капельных» кровотечений, ведущих к постепенной анемизации и формированию в результате распада опухоли околопищеводных микроабсцессов в клетчатке средостения.
К первичным симптомам относятся дисфагия, боли за грудиной, срыгивание пищей (регургитация), гиперсаливация. Практически все эти симптомы свидетельствуют о достаточно большом распространении патологического процесса по пищеводу.
Типичные симптомы рака пищевода обусловлены феноменом обтурации. Наиболее ярким из них является дисфагия – как уже указывалось, затруднение прохождения пищи по пищеводу. Дисфагия обусловлена сужением просвета органа растущей опухолью (механическая дисфагия), но иногда она зависит от спазма в вышележащих отделах пищевода (рефлекторная дисфагия). Механическое нарушение прохождения пищи по пищеводу проявляется чувством комка или «кола» за грудиной, а первые эпизоды нередко сопровождаются ощущением удушья и страхом. При этом ощущаемый больным уровень препятствия нередко не соответствует истинному расположению стеноза в пищеводе. В большинстве случаев дисфагия нарастает постепенно, но всегда отличается неуклонным прогрессирующим течением. Вначале появляется едва заметная задержка при прохождении по пищеводу твердой пищи. Больной как бы ощущает твердый пищевой комок, продвигающийся по пищеводу. Сужение прогрессирует, и вскоре больной вынужден запивать твердую пищу глотком воды или отказываться от приема вторых блюд. В дальнейшем, через несколько недель или месяцев, перестает проходить полужидкая пища, а затем и жидкость. Такое последовательное развитие дисфагии наблюдается не всегда. Иногда в результате распада опухоли или медикаментозного лечения проходимость пищевода частично или полностью восстанавливается. Улучшение состояния длится недолго, и вскоре дисфагия вновь начинает прогрессировать.
Внимательный сбор анамнеза показывает, что появлению дисфагии обычно предшествуют признаки, не вызывающие беспокойства у больного и врача, которые могут быть охарактеризованы как дискомфорт, неловкость при прохождении пищи по пищеводу. Это, прежде всего ощущение прохождения пищевого комка обычных размеров или прилипания пищи к стенке пищевода, чувство царапанья или жжения при проглатывании горячей или острой пищи, периодические поперхивания во время еды, обусловленные рефлекторным спазмом пищевода при раздражении изъязвленной слизистой оболочки.
Прямыми следствиями дисфагии являются отрыжка, регургитация застойного содержимого пищевода в глотку и появление неприятного запаха изо рта. Икота при раке пищевода может отмечаться как на самых ранних стадиях, в виде отдельных эпизодов, еще до появления стойкой дисфагии, так и как тягостное постоянное явление – при вовлечении в процесс в финале заболевания ветвей диафрагмальных нервов.
Боль при глотании (одинофагия) носит распирающий, спазматический или жгучий характер, локализуется за грудиной, в области мечевидного отростка или даже – при локализации опухоли в нижней трети пищевода – в верхних отделах живота. Локализация боли обычно не соответствует уровню поражения пищевода: чаще боль проецируется ниже опухоли. Наличие одинофагии обусловлено, по‑видимому, суперинфекцией или лекарственным эзофагитом. Боль, не связанная с приемом пищи, локализуется в груди, в позвоночнике или в области сердца, нередко иррадиируя в межреберные промежутки, в межлопаточную или надключичную область, в шею по ходу т. sternocleidomastoideus или в нижнюю челюсть. Характерная иррадиация боли иногда дает повод подозревать стенокардитическое происхождение боли. Важно при этом отметить, что применение нитропрепаратов из‑за неспецифичности их релаксирующего действия на гладкую мускулатуру может в ряде случаев рака пищевода не только смягчать болевой синдром, но и уменьшать проявления дисфагии. Такой же дезориентирующий эффект могут давать М‑холинолитики (атропин).
Важными для диагностики симптомами являются регургитация пищи и пищеводная рвота. Регургитация чаще обусловлена спазмом, она возникает сразу после приема пищи. Пищеводная рвота проявляется при выраженном стенозе спустя некоторое время после еды. Регургитация наряду с другими диспепсическими расстройствами (отрыжка, изжога, тошнота) у некоторых больных может явиться первым симптомом заболевания.
В отдельных случаях довольно рано возникает патологически обильное слюноотделение (гиперсаливация, слюнотечение, сиалорея), но чаще оно встречается при выраженном стенозе. Его наиболее распространенное объяснение заключается в том, что пища не поступает в желудок, а потому не прерывается вагусный слюноотделительный рефлекс. Стимулирование секреции слюны связано с рефлекторной активностью nn. vagi, лежащих непосредственно на пищеводе, и, таким образом, способных вовлекаться в опухолевый процесс независимо от обтурации просвета. Возможно, таким образом, что сиалорея является критерием прорастания опухолью адвентиции пищевода или результатом сдавления вегетативных волокон.
Наряду с перечисленными признаками рак пищевода может сопровождаться неприятным или даже зловонным запахом изо рта (какосмия), который зависит от распада опухоли и гнилостных процессов выше сужения и ощущается самим больным или улавливается окружающими.
Вторичные симптомы относятся к поздним проявлениям рака пищевода. Они свидетельствуют об осложнениях болезни, вследствие выхода процесса за пределы пищевода. Вторичные симптомы – это осиплость голоса («открытая гнусавость») имеет место при сдавлении опухолью или ее метастазами возвратного нерва гортани; триада Бернара‑Горнера (миоз, сужение глазной щели (птоз верхнего века), энофтальм на стороне поражения) возникает при поражении опухолью или ее метастазами шейного отдела симпатического ствола; увеличение шейных или надключичных лимфатических узлов; брадикардия , вызванная раздражением n. vagus, преимущественно правого; приступы кашля , который у больного раком пищевода может означать либо развитие аспирационного синдрома, связанного с регургитацией в глотку содержимого супра‑стенотического расширения пищевода, либо прорастание опухоли в бронх, возможно, с развитием ателектаза соответствующей протяженности или бронхопищеводного (трахеопищеводного) свища; изменение звучности голоса, рвота, одышка, удушье со стридорозным дыханием. Поражение легких в большинстве случаев наблюдается на поздних стадиях заболевания и характеризуется рецидивирующими легочными инфекциями, развивающимися вследствие аспирации или образования пищеводно‑бронхиального свища. Рвота кровью возникает в результате распада опухоли (рвота «кофейной гущей») или аррозии сосудов пищевода (наличие неизмененной крови в рвотных массах). Рак пищевода может осложняться образованием параэзофагеального абсцесса и медиастинита, бронхопищеводного свища, ателектаза и пневмонии, гангрены легкого, плеврита и пиопневмоторакса, перикардита, разрушением тел грудных позвонков со сдавлением спинного мозга и нижней параплегией. Известны казуистические наблюдения необычных манифестаций рака пищевода, например, профузным, смертельным кровотечением из разрушенной опухолью аорты.
Из общих симптомов, присущих злокачественным новообразованиям внутренних органов, при раке пищевода наблюдается прогрессирующая потеря массы тела, вплоть до кахексии, нарастающая общая слабость, утомляемость, анемия.
Физикальное обследование обычно малоинформативно. Оно бывает информативным, как правило, при раке IV стадии и невозможности выполнить радикальную операцию. Такими признаками являются:
1. Наличие отдаленных метастазов (в печени, легких, костях, пальпируемого метастаза в подключичной области – метастаз Вирхова).
2. Наличие плеврального выпота.
3. Осиплость голоса, свидетельствующая о прорастании возвратного нерва.
4. Наличие трахеопищеводного свища (поперхивание при проглатывании).
Лабораторная и инструментальная диагностика
Алгоритм инструментальной диагностики рака пищевода включает:
1. Обследование больного с подозрением на рак пищевода, как правило, начинают с фиброэзофагоскопии. Другие эндоскопические методы исследования включают фиброгастроскопию (если возможно провести эндоскоп за место опухолевого сужения) и трахеобронхоскопию.
Фиброэзофагоскопия с биопсией и последующим гистологическим исследованием материала позволяет, при наличии повреждения слизистой оболочки, поставить правильный диагноз практически в 100 % случаев.
Фиброгастродуоденоскопия при ранних карциномах пищевода (когда возможно провести эндоскоп за опухоль) позволяет оценить состояние желудочной стенки и исключить или констатировать наличие сопутствующей патологии (хронических язв желудка, двенадцатиперстной кишки, наличие стеноза выходного отдела и т. д.).
При поражении грудного отдела пищевода на уровне бифуркации трахеи и выше показана фибробронхоскопия с целью исключения прорастания трахеобронхиального дерева (ее выполняют позже, когда уже выполнено рентгенологическое исследование пищевода).
2. Ультрасонография брюшной полости выполняется с целью визуализации очагового поражения печени, оценки состояния абдоминальных лимфоузлов, выявления асцита. Весьма перспективным представляется внедрение в клиническую практику эндоскопической ультрасонографии, представляющее собой внутрипросветное УЗИ стенки пищевода при помощи специального датчика, который вмонтирован в кончик эндоскопа. Эта диагностическая методика пока доступна в нашей стране только в крупных клиниках. Она позволяет определить глубину инвазии стенки пищевода в 83–86 % и поражение медиастинальных лимфатических узлов в 60–76 % случаев.
3. Полипозиционная рентгенография пищевода с использованием контрастирующих веществ позволяет оценить протяженность опухоли и состояние пищевода и желудка ниже опухоли, что часто невозможно сделать эндоскопически, так как аппарат не проходит ниже опухоли и можно осмотреть только ее верхнюю часть. Из контрастных препаратов наиболее часто используется водная взвесь сернокислого бария вначале жидкой, а при хорошей проходимости пищевода – густой консистенции. По лучевым признакам можно выделить эндофитную форму рака пищевода, экзофитную, полипозную или смешанную. В зависимости от формы опухоли определяется различная картина «дефекта наполнения» пищевода как одного из основных лучевых признаков опухоли.
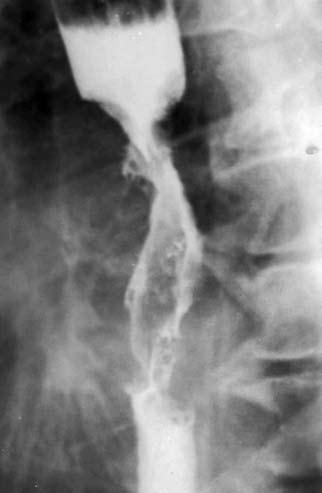
Рис. 41. Рентгенограмма экзофитной опухоли. На рентгенограмме виден дефект наполнения, который более выражен по правой стенке пищевода – контрастное вещество оттесняет растущая в просвет органа опухоль
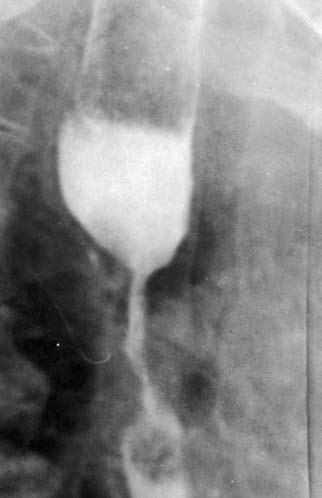
Рис. 42. Рентгенограмма супрастенотического расширения.
На рентгенограмме выше места сужения определяется компенсаторное расширение просвета пищевода, заполненное контрастным веществом Экзофитный рак растет преимущественно в просвет органа, образуя при традиционном рентгенологическом исследовании дефект наполнения с непрерывными бугристыми контурами (рис. 41).
При циркулярном распространении опухоли пищевод на этом участке становится суженным, образуя «раковый канал». Над сужением, как правило, определяется супрастенотическое расширение (рис. 42).
Переход от здорового участка к пораженному бывает обрывистым, ступенеобразным. На уровне опухоли определяется ригидность стенки, отсутствие перистальтики вследствие прорастания опухоли в мышечный слой стенки пищевода. Складки слизистой оболочки в зоне опухоли разрушены, ход их неправильный, имеется так называемый «злокачественный рельеф». На поверхности опухоли могут появляться множественные изъязвления в виде «депо» бария и «ниш». В ряде случаев попутная информация о распространенности рака пищевода может быть получена при компьютерной томографии, которая может свидетельствовать о медиастинальной и абдоминальной лимфоаденопатии.
4. При подозрении на интраторакальную и абдоминальную распространенность ракового процесса с вовлечением окружающих структур, на наличие лимфогенных и гематогенных метастазов проводится компьютерно‑томографическое исследование. Метод характеризуется высокой чувствительностью и специфичностью. КТ‑исследование является обязательным элементом предоперационного стадирования распространенности опухоли.
5. Одним из современных методов предоперационного обследования местной и системной распространенности опухолевого процесса является позитронная эмиссионная томография (ПЭТ), которая позволяет определить состояние первичной опухоли, ее связь с окружающими органами и структурами, наличие регионарных и отдаленных метастазов.
Дифференциальная диагностика
Рак пищевода следует дифференцировать с доброкачественными опухолями пищевода. Самой частой доброкачественной опухолью является лейомиома (подробнее смотри в соответствующем разделе), растущая внутристеночно из гладких мышечных волокон. Она составляет 70 % всех доброкачественных опухолей пищевода. Лейомиома имеет вид одиночного узла, реже состоит из нескольких долей, связанных между собой опухолевидными тяжами. Слизистая оболочка над опухолью в подавляющем большинстве случаев не изменена. Она растягивается над опухолью, вдающейся в просвет органа. Лейомиома чаще располагается в нижней и средней трети пищевода. Дисфагия при этом развивается медленно, на протяжении многих месяцев, а иногда и лет. Заметно она не прогрессирует. Общее состояние, как правило, не страдает. При рентгенологическом исследовании определяется характерный дефект наполнения пищевода с четкими контурами, резкими границами со здоровой частью стенки пищевода и компенсаторным расширением противоположной стенки. При эзофагоскопии обнаруживается опухоль, расположенная в подслизистом слое пищевода и выступающая в его просвет. Слизистая оболочка над опухолью бледная, растянутая, без продольных складок. Биопсию проводить не рекомендуется, результаты ее, как правило, отрицательны. Травма стенки пищевода после биопсии в последующем затрудняет операцию – энуклеацию лейомиомы.
Наиболее трудно отличить начальные стадии инфильтративного рака пищевода в нижнегрудном отделе от кардиоспазма (ахалазии пищевода). Кардиоспазм чаще возникает в более молодом возрасте. Заболеванию больше подвержены женщины, ему нередко предшествует эмоционально‑психическая травма. Характерными симптомами кардиоспазма являются дисфагия, боль и регургитация. Дисфагия при этом непостоянна: светлые промежутки чередуются с выраженным затруднением прохождения пищи. Иногда при глотании хуже проходят жидкие пищевые массы (парадоксальная дисфагия). Болезнь длится многие годы. Наиболее информативным в диагностике кардиоспазма является рентгенологическое исследование с использованием контрастной бариевой взвеси. Для этой патологии характерны четкие и ровные контуры пищевода и сохранение эластичности стенок на всем его протяжении. В начале заболевания (I стадия) выявляется временный спазм кардии, с кратковременной задержкой контрастного вещества в кардиальном отделе. Во II стадии болезни определяется стойкий спазм кардии с умеренным расширением пищевода и выраженным нарушением моторики. В III–IV стадиях болезни сужение кардиального отдела стойкое и значительное. Сочетание существенного расширения пищевода, до 6–8 см и более, с S‑образным искривлением пищевода, характерным сужением кардии в виде «мышиного хвоста» или «писчего пера» и отсутствием «газового» пузыря желудка является типичной рентгенологической картиной кардиоспазма (рис. 43).
В сомнительных случаях для выявления проходимости кардии применяют пробу Кона (дополнительный прием 200–500 мл жидкости) или пробу Херста (заполнение пищевода бариевой взвесью до уровня дуги аорты). Особое диагностическое значение имеет фиброэзофагоскопия, при которой врач видит расширенный пищевод с остатками пищи в его просвете. При этом эндоскоп проходит в желудок. В сочетании с биопсией эндоскопический метод является окончательным в дооперацнонном распознавании ракового перерождения.
Не всегда легко отличить раковую язву от банальной язвы пищевода. Обычные язвы пищевода не бывают большими. Они неглубокие, не имеют грубых подрытых и приподнятых краев. Окончательный диагноз ставится на основании данных биопсии и цитологического исследования.
Клиническая картина эзофагита, кроме дисфагии, в основном проявляется болью в эпигастрии, усиливающейся во время еды и употребления грубой и острой пищи. При фиброэзофагоскопии обнаруживается гиперемированная и отечная слизистая оболочка, иногда с эрозиями на поверхности в период обострения. При хроническом эзофагите слизистая оболочка пищевода атрофична, бледна, отмечается некоторая ригидность стенок в связи с рубцовыми изменениями в мышечном слое.
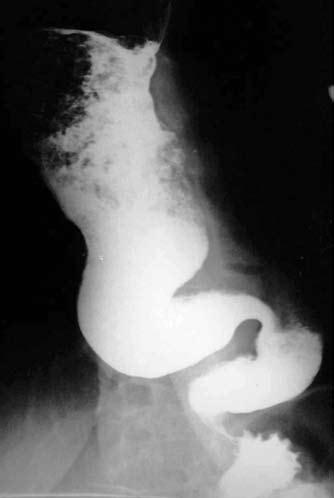
Рис. 43. Кардиоспазм. На рентгенограмме ниже места резкого расширения определяется нитевидное сужение просвета в виде «мышиного хвоста». Тотчас ниже диафрагмы слева в дне желудка газовый пузырь не определяется
Часто встречающиеся рубцовые сужения пищевода после химических ожогов обычно нетрудно отличить от рака пищевода. Гораздо труднее обнаружить на фоне рубцов в пищеводе начинающийся рак. Разрешить сомнения помогает гистологическое исследование тканей, полученных из стенки пищевода при эзофагоскопии. Более редкие заболевания пищевода, такие как первично укороченный пищевод, склерозирующий медиастинит, вовлекающий в процесс пищевод, также надо иметь в виду при дифференциальной диагностике рака пищевода.
Лечение рака пищевода
В развитии хирургии пищевода можно выделить несколько этапов.
Первый из них характеризуется разработкой основ хирургии пищевода. Приоритет в этом отношении по праву принадлежит трем выдающимся хирургам‑исследователям конца XIX – начала XX века: Н. И. Насилову, В. Д. Добромыслову и Францу Тореку.
Н. И. Насилов один из первых, в 1888 году, предложил весьма оригинальный экстраплевральный подход к пищеводу путем резекции или пересечения задних отрезков ребер. И хотя большого распространения в клинической практике он получить не смог вследствие недостаточного удобства для хирурга из‑за ограниченной визуализации, травматичности, реальной опасности повреждения крупных сосудов и плевры, все же работы Н. И. Насилова заложили основу для дальнейших изысканий в области хирургии пищевода.
Спустя 12 лет впервые в мире В. Д. Добромыслов (1900) разработал чрезплевральный доступ к пищеводу. Это послужило новым этапом в развитии хирургии не только пищевода, но и других органов грудной клетки. И затем последовало предложение Ф. Торека (1913), определившее путь развития хирургии пищевода на многие десятилетия вперед. Суть его заключалась в удалении опухоли пеищевода с формированием пищеводного и желудочного свищей, а на втором этапе – пластикой пищевода. Операцию стали называть Добромыслова‑Торека. Ее раньше применяли для удаления рака среднегрудного отдела пищевода. Из правостороннего чресплеврального доступа удаляли грудной отдел пищевода. Через абдоминальный разрез накладывали гастростому. В последующем (спустя 3–6 мес) создавали искусственный пищевод из толстой и тонкой кишки.
Первоначально внимание хирургов было сосредоточено на создании искусственного пищевода из кожного лоскута передней грудной стенки.
Более перспективным направлением в развитии реконструктивной хирургии пищевода оказался метод тонкокишечной предгрудинной эзофагопластики, полностью лишенный всех недостатков, свойственных кожному пищеводу. Идея такой пластики принадлежала Ц. Ру (1906), но в полном объеме осуществил ее в собственной модификации спустя 9 месяцев в клинике наш соотечественник, выдающийся хирург П. А. Герцен (1907). Вследствие этого антеторакальная пластика пищевода тонкой кишкой вошла в историю хирургии, как операция Ру‑Герцена.
Исключительная значимость в разработке этой проблемы принадлежит выдающемуся хирургу, нашему соотечественнику С. С. Юдину. За 20 лет (1928–1948) лично им было произведено 318 операций создания антеторакального пищевода из тонкой кишки. Благодаря внесению целого ряда оригинальных методик, ему удалось снизить летальность при данном вмешательстве до 9 %.
Предел совершенства методики предгрудинной пластики тонкой кишкой был достигнут А. А. Русановым (1974). Используя опыт многих своих предшественников, обладая незаурядными хирургическими способностями и внеся в производство операции ряд оригинальных решений, он сумел достигнуть отличных результатов. Из 200 оперированных больных у 192 течение было гладким и произошло полное приживление трансплантата под кожей. Некроз кишечного трансплантата наступил только у 7 человек (3,5 %).
Параллельно с тонкокишечной пластикой происходило внедрение в практику восстановительной хирургии пищевода толстокишечного трансплантата. Идея толстокишечной эзофагопластики принадлежит Kelling (1911) и Vulliet (1911). В толстой кишке привлекала к себе внимание достаточная длина, хорошее кровоснабжение и сравнительно простая техника ее мобилизации. А. А. Русанов (1974) по этому поводу писал: «Здесь не требуется тонкой скрупулезной аккуратности и такого исключительно острого внимания и точного расчета, как при мобилизации тощей кишки. Для хирурга мобилизовать толстую кишку несравненно легче. Однако, несомненно, что для больного создание пищевода из толстой кишки – операция более тяжелая и более опасная, чем создание пищевода из тонкой кишки». С этим положением трудно не согласиться.
Наибольший расцвет толстокишечной эзофагопластики приходится на 1950–1970‑е годы. К 1970 году самым большим опытом пластики пищевода толстой кишкой обладали сотрудники института им. Н. В. Склифосовского. Их опыт составил почти 250 наблюдений с общей летальностью 6,8 %.
К настоящему времени можно констатировать, что толстая кишка как пластический материал для эзофагопластики выдержала испытание временем и заняла свое место в современной реконструктивной хирургии пищевода.
Использование желудка в качестве пластического материала для замещения резецированного пищевода всегда привлекало к себе пристальное внимание специалистов, занимавшихся этим разделом хирургии. К этому располагают его хорошие пластические свойства, обильное экстра– и интраорганное кровоснабжение, большие размеры и непосредственное расположение вблизи пищевода. По мнению многих авторов, использование желудка для пластики является наиболее физиологичным, а техническое выполнение операции представляется менее громоздким вмешательством, нежели любой вариант кишечной пластики пищевода.
История развития желудочной эзофагопластики на протяжении всего своего периода происходила и продолжает развиваться параллельно по двум принципиально различным направлениям. Сторонники одного из них придерживаются принципа использования целого желудка, второго – части его с моделированием трубкоподобной формы трансплантата с расположением его в изо– или антиперистальтическом направлении.
Впервые указания на возможность использования желудочного трансплантата, сформированного из большой его кривизны в антиперистальтическом направлении, для эзофагопластики содержатся в трудах Beck и Carrel (1905).
Независимо друг от друга румынский хирург Jianu (1912) и русский хирург Я. О. Гальперн (1912) описали технику идентичной операции: из большой кривизны желудка выкраивался трубчатый лоскут с основанием в области его дна и питанием за счет желудочно‑сальниковой артерии. Блестящие результаты Gavriliu послужили основанием к признанию данного вида хирургического вмешательства в качестве перспективного варианта пластики пищевода как у нас в стране, так и за рубежом.
Однако с накоплением клинического опыта было установлено, что наряду с положительными моментами операция Жиану‑Гальперна‑Гаврилиу имеет существенные недостатки. Несмотря на значительное усовершенствование техники операции, она по‑прежнему оставалась чрезвычайно громоздкой и опасной, особенно из‑за недостаточного кровоснабжения дна желудка. Фистула в зоне анастомоза наблюдалась практически у каждого второго больного. Кроме того, удаление не пораженной заболеванием селезенки с целью удлинения трансплантата может рассматриваться как не оптимальный вариант, а как вынужденный при отсутствии альтернативного способа. Далее, сохранение кардиального отдела желудка влечет за собой оставление соответствующего лимфатического коллектора, что при раке пищевода является нарушением принципа онкологического радикализма.
Все изложенное дало основание хирургам в начале 1970‑х годов вновь вернуться к вопросу о методике формирования желудочного трансплантата для эзофагопластики в изоперистальтическом его варианте.
Принципиально новый способ пластики пищевода в виде желудочной трубки, сформированной из большой кривизны желудка в изоперистальтическом направлении, разработан в 1923 г. Rutkowski. Выкраивание трубчатого стебля начиналось им со стороны кардиального отдела желудка с основанием в области привратника. По мнению автора, такое расположение трансплантата обеспечивает лучшее его кровоснабжение, поскольку правая желудочно‑сальниковая артерия крупнее одноименной левой. В клинике эта методика была успешно применена Lortat‑Jacob (1949).
Дальнейшие научные изыскания, направленные на изучение экстраорганной ангиоархитектоники желудка доказали целесообразность эзофагопластики изоперистальтической желудочной трубкой.
В то же время ведущим осложнением после внутриплевральной пластики пищевода по‑прежнему продолжала оставаться несостоятельность пищеводно‑желудочного анастомоза (до 42 %), возникающая вследствие ишемии и некроза проксимального отдела трансплантата.
Стремясь уменьшить летальность вследствие этого грозного осложнения, некоторые хирурги перешли к заднемедиастинальной эзофагопластике с анастомозом на шее. Ключевым моментом методики является вынесение пищеводно‑желудочного анастомоза за пределы плевральной полости, на шею, при любой локализации рака пищевода, вплоть до рака кардии. Предложенная методика позволила значительно улучшить непосредственные результаты одномоментной эзофагопластики, снизив послеоперационную летальность в специализированных стационарах до 3–5 %. В то же время частота развития несостоятельности такого пищеводно‑желудочного анастомоза в некоторых учреждениях достигает 75 %, что не может удовлетворить хирургов.
При этом имеется прямая зависимость частоты развития несостоятельности пищеводно‑желудочного анастомоза от экстраорганной ангиоархитектоники сосудов большой кривизны желудка.
Наряду с пластикой пищевода с помощью желудочной трубки разрабатывались методики его замещения целым желудком. Первую попытку антеторакальной пластики пищевода желудком предпринял Fink (1913), однако операция закончилась летальным исходом.
Следующим заметным событием в хирургии пищевода являются работы Lewis (1946). Он предложил использовать для мобилизации и резекции пищевода правосторонний торакотомический доступ. При этом он разделил операцию на два этапа. Первоначально производилась лапаротомия, мобилизация желудка с тщательным сохранением сосудистых аркад вдоль малой и большой кривизны и формированием гастростомы. Затем спустя 1–2 недели выполнялся второй этап, во время которого перевязывалась непарная вена, выделялся пищевод вместе с окружающей клетчаткой, расширялось пищеводное отверстие диафрагмы, и через него выводился в плевральную полость ранее мобилизованный желудок. Пищевод с опухолью резецировался и накладывался эзофагогастроанастомоз конец в бок.
Операция Lewis в 1950‑е годы приобрела довольно широкое распространение, особенно после того, как McManus (1948) доказал целесообразность ее осуществления в один этап.
Основным недостатком антеторакальной и внутригрудной пластики пищевода желудком оказалось частое развитие свищей анастомоза и желудочных свищей в связи с некрозом перемещенного желудка. Главной причиной наблюдавшихся некрозов являлось прямое нарушение кровоснабжения дна желудка.
В целях снижения частоты развития несостоятельности анастомоза многие хирурги стали прибегать к резекции кардии и дна, как отделов с ущербным кровоснабжением в условиях мобилизованного желудка.
В то же время резекция проксимального отдела желудка влечет за собой уменьшение размеров формируемого трансплантата. Отсюда понятен повышенный интерес хирургов к таким методам эзофагопластики, когда в качестве трансплантата используется «трубка» из большой кривизны.
Лечение больных раком пищевода – одна из самых сложных задач клинической онкологии. Радикальное лечение больных раком пищевода сегодня – это комбинированное (удаление опухоли и лучевая терапия и ЛТ) или комплексное лечение (радикальная операция, химиотерапия, или еще и ЛТ), в которое, помимо хирургического удаления опухоли, включают адъювантные (после операции) или неоадъювантные (до операции) воздействия.
Современные операции при раке пищевода можно разделить на два типа: резекция пищевода и субтотальная эзофагэктомия. При резекции линия пересечения пищевода находится на определенном удалении (обычно 4–6 см) от верхнего края опухоли. Субтотальная эзофагэктомия предусматривает почти полное (за исключением небольшого участка шейного отдела) удаление пищевода, независимо от локализации опухоли.
В зависимости от выбора оперативных доступов выделяются следующие основные виды вмешательств: 1) чрезплевральные (право– или левосторонняя торакотомия) в сочетании с диафрагмо‑или лапаротомией; 2) комбинированные торакоабдоминальные; 3) трехдоступные (торакотомия, лапаротомия и цервикотомия) и 4) трансхиатальные (так называемые операции «без торакотомии»). На современном этапе активно разрабатываются внутрипросветные эндоскопические операции и тораколапароскопические.
В настоящее время общепризнанным является выполнение при раке пищевода одномоментных операций. В качестве пластического материала для эзофагопластики предпочтение отдают использованию желудка, при этом применяется как целый желудок, так и выкроенный лоскут из большой его кривизны. В случаях невозможности осуществить пластику пищевода желудочным трансплантатом в пластических целях используют ободочную или тонкую кишку. Оптимальным и наиболее физиологичным путем проведения трансплантата признано заднее средостение (ложе пищевода). Ретростернальный и антеторакальный пути проведения трансплантата также имеют право на существование, но чаще их используют при невозможности проведения трансплантата через заднее средостение. При резекции пищевода пищеводный анастомоз, как правило, располагается внутриплеврально, а при субтотальной эзофагэктомии – только внеплеврально (на шее). Новой тенденцией стали пластические пересадки свободных трансплантатов с использованием микрососудистых анастомозов. При резекции шейного отдела пищевода, сопровождающейся удалением гипоглотки и ларингэктомией, прибегают к свободной трансплантации двух кишечных сегментов: толстокишечного и толстокишечно‑подвздошного – для восстановления глоточно‑пищеводного дефекта и для возобновления голосовой функции.
Выбор метода лечения зависит от локализации опухоли и ее распространенности. Неоперабельными больные бывают по двум причинам: 1) прорастание опухолью соседних органов и структур – аорты, трахеи, легкого, метастазирование в лимфатические узлы второго, третьего порядка и другие органы (печень, легкие), поэтому возможность удаления опухоли (резектабельность) у большинства больных становится окончательно ясной только во время операции; 2) наличие сопутствующих заболеваний сердца, легких, почек, печени и других органов в стадии декомпенсации.
При раке шейного и верхнегрудного отделов пищевода опухоль быстро прорастает окружающие органы и рано дает метастазы. Рак этой локализации более успешно лечат при помощи лучевой терапии.
При раке грудного отдела пищевода выполняют одномоментную субтотальную резекцию пищевода с пластикой его желудком с внутриплевральным пищеводным соустьем (операция Льюиса). При раке нижнего отдела пищевода производят резекцию нижней трети пищевода, проксимального отдела желудка и малого сальника из левостороннего торакоабдоминального доступа (операция Гарлока).
С целью улучшения результатов лечения, как уже отмечалось, радикальное оперативное вмешательство дополняют лучевой терапией, нередко фармакомодулированной (с одновременным введением противоопухолевых химиопрепаратов).
При неоперабельных опухолях производят паллиативные вмешательства с целью восстановления проходимости пищевода, улучшения питания больного. К ним относят гастростомию (чаще по Кадеру), обходной анастомоз, паллиативные резекции.
Из неоперативных паллиативных методов лечения рака пищевода, направленных на восстановление возможности приема пищи, сегодня широко разрабатываются и используются эндоскопические методы реканализации опухоли. К ним относятся: бужирование, электрокоагуляция, реканализация просвета пищевода высокоэнергетическим лазером, фотодинамическая реканализация низкоэнергетическим лазером, интубация опухоли жесткими протезами, интубация опухоли саморасширяющимися стентами, интратуморальное введение цитостатиков. Выбор того или иного метода определяется возможностями и опытом персонала конкретного лечебного учреждения.
Бужирование опухолевой стриктуры является одним из самых традиционных и доступных методов лечения. Однако его возможности очень ограничены, а риск осложнений слишком высок. Уровень осложнений может достигать 30 %, в том числе перфораций – 10 %.
Аргоно‑плазменная коагуляция или биполярная электрокоагуляция подразумевают прямое разрушение опухоли под эндоскопическим контролем. Лечение бывает эффективным более чем в 80 % случаев при частоте осложнений около 8 % (в основном за счет перфораций).
В последние 10–15 лет широкое распространение получила методика реканализации пищевода посредством лазерной коагуляции опухоли. Главный недостаток лазерной терапии – необходимость частых повторных процедур. Процент перфораций при этом также достаточно высок (8 %).
Некоторое время назад интенсивно развивалась фотодинамическая терапия (ФДТ), которая заключается во внутривенном введении в организм пациента фотосенсибилизаторов, которые накапливаются в ткани опухоли, с последующим воздействием на опухоль низкоэнергетическим лазерным лучом. И хотя при раке пищевода метод применяется в основном для лечения ранних опухолей, появились данные по использованию его также в целях борьбы с дисфагией. Уменьшается и частота перфораций, т. к. не требуется предварительная дилатация. Ограничениями ФДТ являются высокая стоимость оборудования и поверхностная глубина проникновения лучей в опухоль, что часто требует повторных сеансов лечения. После введения фоточувствительных агентов пациенты должны избегать воздействия прямых солнечных лучей.
Главным недостатком всех перечисленных симптоматических
Дата добавления: 2016-12-16; просмотров: 2969;











