Теплоёмкость идеального газа
Основные законы термодинамики были установлены опытным путём. Можно показать, что такие характеристики системы, как теплоёмкость, внутренняя энергия, энтропия и др. могут быть получены методами термодинамики и методами статистической физики.
Число степеней свободы системы i – количество независимых координат, с помощью которых можно полностью описать положение системы в пространстве. Так, для одноатомной молекулы i = 3, т.к. необходимо задать три координаты молекулы, например, координаты x, y, z в декартовой системе. Для двухатомной молекулы i = 3+3-1=5, т.к. число степеней свободы уменьшается на число жёстких связей между атомами, в данном случае на единицу. Если молекула может совершать колебательное и вращательное движения, то число степеней свободы увеличивается: i = nпост+nвращ+2nколеб. Опытным путём в термодинамике было доказано, что на каждую степень свободы приходится энергия 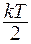 . Рассчитываем, например, внутреннюю кинетическую энергию системы из N молекул идеального газа, учитывая, что поступательному движению отдельной молекулы соответствует 3 степени свободы:
. Рассчитываем, например, внутреннюю кинетическую энергию системы из N молекул идеального газа, учитывая, что поступательному движению отдельной молекулы соответствует 3 степени свободы:
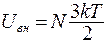 (9.24)
(9.24)
Методами статистической физики было доказано, что внутренняя энергия идеального газа равна суммарной средней кинетической энергии движения молекул:
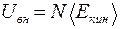 (9.25)
(9.25)
Средняя кинетическая энергия молекул:
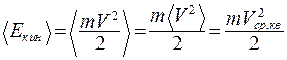 (9.26)
(9.26)
где Vср.кв – среднеквадратичная скорость молекул.
Из распределения Максвелла частиц по скоростям следует, что квадрат среднеквадратичной скорости пропорционален абсолютной температуре:
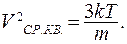 (9.27)
(9.27)
Подставим (9.26) и (9.27) в соотношение (9.25) и находим:
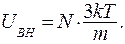 (9.28)
(9.28)
Таким образом, термодинамическими и статистическими методами мы пришли к одинаковому результату. В общем случае внутренняя энергия n молей идеального газа:
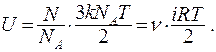 (9.29)
(9.29)
где 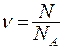 - количество молей газа,
- количество молей газа, 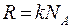 - универсальная газовая постоянная.
- универсальная газовая постоянная.
Применим первое начало термодинамики для получения теплоемкости идеального газа. Пусть имеется 1 моль идеального газа. Теплоемкость, по определению, равна количеству теплоты, необходимому для изменения температуры системы на один Кельвин:
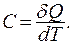 (9.30)
(9.30)
Молярной теплоемкостью называется теплоемкость одного моля вещества. Размерность молярной теплоемкости 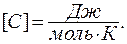 Удельной называется теплоемкость единицы массы вещества:
Удельной называется теплоемкость единицы массы вещества: 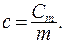 Размерность удельной теплоемкости:
Размерность удельной теплоемкости: 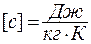 . Между удельной и молярной теплоемкостями существует связь
. Между удельной и молярной теплоемкостями существует связь 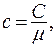 где m - молярная масса вещества.
где m - молярная масса вещества.
При протекании изохорного процесса ( 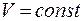 ) теплоемкость одного моля вещества:
) теплоемкость одного моля вещества:
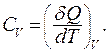
Из первого начала термодинамики следует:
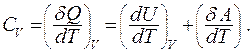
В изохорном процессе газ не совершает работы, 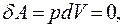 отсюда следует:
отсюда следует:
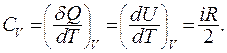 (9.31)
(9.31)
Изменение внутренней энергии в изохорном процессе для произвольного количества вещества:
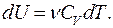 (9.32)
(9.32)
При протекании изобарного процесса (P = const), теплоемкость одного моля вещества:
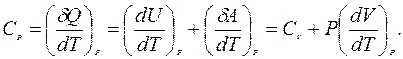 (9.33)
(9.33)
Из уравнения Менделеева – Клапейрона для одного моля газа находим:
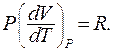 (9.34)
(9.34)
Из (9.33) и (9.34) следует, что теплоемкость идеального газа при постоянном давлении:
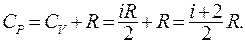 (9.35)
(9.35)
Уравнение, связывающие молярные теплоемкости CP и CV называется уравнением Роберта – Майера:
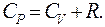 (9.36)
(9.36)
Дата добавления: 2019-09-30; просмотров: 759;











