Электроэнцефалографические исследования при пограничных состояниях
[написано В.К. Бочкаревым и С.В. Панюшкиной]
Электроэнцефалограмма представляет собой запись электрической активности головного мозга, которая является алгебраической суммой возбуждающих и тормозных постсинаптических потенциалов сомы и дендритов нервных клеток, а также, очевидно, связана с проявлениями активности глиальных элементов и сдвигами метаболических процессов мозга.
Выделяют несколько типов ЭЭГ. Автор наиболее современной и признанной ЭВМ-классификации типов ЭЭГ Е.А. Жирмунская (1980) считает, что понятие типа относится только: 1) к электроэнцефалограмме покоя и не включает в себя реактивные сдвиги и особенности, связанные с изменением уровня бодрствования; 2) к ЭЭГ взрослых людей с закончившимся процессом созревания стволово-корковых взаимоотношений; 3) к так называемой фоновой активности, зарегистрированной вне фокуса патологических и пароксизмальных феноменов; 4) к достаточно общим и наиболее существенным характеристикам электрической активности, что позволяет ослабить «зашумляющее» влияние межиндивидуальных вариаций ЭЭГ.
Тип I — организованный во времени и пространстве (прежнее название «нормальная ЭЭГ»). Высокая степень регулярности колебаний биопотенциалов. Доминирует зонально-дифференцированный α-ритм (8—13/с) с затылочно-лобным градиентом параметров и средней амплитудой 25—55 мкВ. Низкоамплитудная β-активность (5—15 мкВ) умеренно выражена; τ- и δ-активность имеет низкую амплитуду (15—20 мкВ) и минимальную представленность (τ-, δ-индекс в 5—10 раз ниже, чем α-индекс).
Констатируя «нормальную» ЭЭГ, следует помнить о том, что «нормальная» ЭЭГ и ЭЭГ «здорового» (практически здорового) человека — понятия не всегда идентичные. В 5—15 % случаев энцефалограмма здоровых (с точки зрения неврологии и психиатрии) людей значительно отличается от I типа ЭЭГ и содержит феномены, характерные для определенных органических или функциональных нарушений деятельности мозга. Иногда это удается связать с отягощенной наследственностью или объяснить высокими компенсаторными возможностями мозга вне нейрофизиологических механизмов. В то же время включением нейрофизиологических компенсаторных механизмов можно объяснить обратное соотношение фактов: нередко встречающуюся «нормальную» или «гипернормальную» энцефалограмму у субъектов с хроническим заболеванием мозга.
Тип II — синхронный моноритмичный (гиперсинхронная ЭЭГ). Высокая степень регулярности колебаний биопотенциалов сочетается с повышенностью амплитуды волн (α — до 100 мкВ, β — до 70 мкВ). В различных подтипах этого типа могут быть различные виды активности: гиперсинхронный α-ритм, низкочастотный β-ритм, гиперсинхронный α-подобный β-ритм.
Тип III — десинхронный (десинхронная ЭЭГ). Доминирует β-активность средней и высокой частоты (20—30/с) с амплитудой до 30 мкВ. Резко снижен α-индекс (в 5—20 раз по сравнению с I типом). Несколько повышено (по сравнению с I типом) содержание медленных волн и их амплитуды (до 25—35 мкВ).
Тип IV — дезорганизованный с преобладанием α-активности (дезорганизованная ЭЭГ). Нерегулярный α-ритм со сглаженными межзональными различиями несколько более выражен, чем примерно одинаково представленная нерегулярная электрическая активность всех остальных частотных диапазонов как по индексу, так и по амплитуде (25—40 мкВ).
Тип V — дезорганизованный с преобладанием τ- и δ-активности (грубо нарушенная ЭЭГ). Доминирование высокоамплитудных (90—125 мкВ) медленных τ- и δ-ритмов (в 5—10 раз больше, чем в I типе). Появление локальных и диффузных патологических феноменов и пароксизмальных разрядов чаще сопровождает именно этот тип ЭЭГ, хотя может иметь место и на фоне любого другого типа энцефалограммы.
Известно, что обладатели α-типа ЭЭГ располагают максимальными адаптивными возможностями. При снижении уровня адаптации роль основного организующего ритма последовательно переходит к τ- и δ-ритму.
Типы ЭЭГ в определенной степени обусловлены генетически. На это указывают сравнительные исследования ЭЭГ у моно- и дизиготных близнецов (Vogel F., 1970, 1986; Young J.P. et al., 1972; Vogel F. et al., 1980), выявившие генетическую детерминированность межиндивидуальной вариабельности ЭЭГ и ее наиболее общих вариантов: ЭЭГ с мономорфным α-ритмом, ЭЭГ, содержащая наряду с α-ритмом диффузную β-активность, и ЭЭГ с низкоамплитудной нерегулярной активностью. У больных с пограничными невротическими состояниями встречаются все, за исключением V, типы ЭЭГ, по классификации Е.А. Жирмунской. Отмечается бОльшая, чем в популяции здоровых лиц, частота краевых вариантов ЭЭГ — десинхронизированной, дезорганизованной, гиперсинхронной. Учитывая данные генетических исследований, можно предположить, что ряд особенностей ЭЭГ при неврозах обусловлены индивидуально-типологическими особенностями больных. С этим согласуется более высокая встречаемость ЭЭГ с α-ритмом средней амплитуды в группе больных с преобладанием гиперстенических черт личности, а гиперсинхронных ЭЭГ — у больных с гипостеническими чертами, а также наблюдаемое у этих больных различие клинических и ЭЭГ-эффектов при действии транквилизаторов (Александровский Ю.А., Незнамов Г.Г., Хруленко-Варницкий И.О., 1989). Тревожность как личностная черта обнаруживает отрицательную корреляцию с выраженностью α-ритма, максимально проявляясь у лиц со слабо выраженным α-ритмом (Калашникова И.Г., Сорокина Н.Д., 1995).
Анализ ЭЭГ при неврозах показывает связь ее особенностей с формой невроза (Карвасарский Б.Д., 1990). Так, для неврастении (Бобкова В.В., 1971) характерен тип ЭЭГ-изменений, проявляющийся преобладанием τ-, δ-активности и недостаточной выраженностью α-ритма. У больных неврозом навязчивых состояний ЭЭГ часто представлена доминирующей быстрой активностью, α-ритм низкоамплитудный и мало выражен. В то же время ЭЭГ с редуцированным низкоамплитудным α-ритмом достоверно чаще встречается у тревожных больных с паническими расстройствами и генерализованной тревогой (Вейн A.M. и др., 1971, 1997; Куликовский В.В., 1980; Моллазаде А.Н., 1990; Enoch M.A. et al., 1995). Хотя по другим данным у больных с паническими расстройствами во время приступа тревоги или в межприступном периоде выявляется усиление медленноволновой активности (Knott V.J., 1990). Ряд авторов изменения типа десинхронизации ЭЭГ считают достаточно характерными вообще для тревожных расстройств (Fink M. et al., 1969; Horvath Т., 1980). У больных истерией наблюдается ЭЭГ с преобладанием синхронизированного, распространенного на передние области коры α-ритма. Больные с выраженными вегетативными расстройствами часто обнаруживают в центральных областях коры τ-активность и генерализованные медленноволновые или α-вспышки.
Онтогенетическое развитие электрической активности мозга, идущее в нескольких направлениях, вносит свой вклад в индивидуальные различия ЭЭГ.
При поэтапном визуальном анализе разновозрастных энцефалограмм удалось выделить по крайней мере два основных типа ЭЭГ: 1) кривые с формирующимся регулярным, доминирующим и имеющим признаки зональной дифференцированности α-ритмом; 2) ЭЭГ с относительно большой выраженностью медленных волн и нерегулярным, неравномерным по частоте и амплитуде α-ритмом.
Следует отметить, что на формировании индивидуального паттерна ЭЭГ, определяющего его принадлежность к конкретному типу, сказываются различные факторы и прежде всего органические поражения мозга и психические заболевания. Если они возникают в раннем постнатальном периоде и детском возрасте, то происходит более или менее выраженная задержка развития электрической активности мозга. Признаки этой задержки нередко сохраняются на всю жизнь, и психопатическое развитие личности в таких случаях сочетается с признаками инфантилизма ЭЭГ.
Следствием многообразия факторов, обусловливающих особенности ЭЭГ и ее типы, является отсутствие установленных специфических изменений ЭЭГ при пограничных состояниях. G. Winterer и W.M. Herrmann (1995) на основе анализа 500 литературных источников, касающихся изучения ЭЭГ при психических расстройствах, пришли к заключению о том, что в целом фоновая ЭЭГ больных с тревожными расстройствами не содержит каких-либо типичных отклонений от нормы. Не найдено также характерных изменений ЭЭГ у больных с непсихотической тревогой в сопоставлении с другими больными психиатрического профиля (Ogiso Y. et al., 1993). Отсутствие специфических особенностей ЭЭГ при пограничных состояниях может быть обусловлено также многообразием механизмов формирования тревоги (Шиньон Ж.М., 1991).
В исследованиях тревожных расстройств в силу неоднозначности результатов прямых клинико-электроэнцефалографических сопоставлений и частой их противоречивостью приобретает большое значение изучение ЭЭГ в связи с состоянием рецепторных систем мозга и влиянием на них препаратов с анксиолитическим действием. При обследовании больных с постстрессовыми невротическими и соматоформными расстройствами выявлена положительная корреляция между оцениваемой по шкале Гамильтона тревогой и дефицитом бензодиазепинового рецепторного связывания (Torizuka K. et al., 1996). Аналогичный дефицит связывания наблюдается в задних отделах мозга с преобладанием в затылочной и височной областях правого полушария у больных с фобиями в экспериментальной ситуации провоцирования страха (O'Carroll R.E. et al., 1993). Уменьшение плотности бензодиазепиновых рецепторов мозга обнаружено у экспериментальных животных при хроническом стрессе (Вальдман А.В., Александровский Ю.А., 1987; Яркова М.А., 1996; Seredenin S.B., Blednov Yu.A., 1993) и у «высокотревожных» животных (Harro J. et al., 1990). Вместе с тем влияние бензодиазепиновых транквилизаторов, восполняющих рецепторный дефицит, отражается хорошо воспроизводимыми паттернами реакций ритмов ЭЭГ. Поэтому ЭЭГ-анализ динамики состояния больных при действии транквилизаторов может оказаться адекватной моделью для выяснения ЭЭГ-коррелятов тревоги, ведущего расстройства при пограничных невротических состояниях.
Энцефалографическая картина сна не менее многообразна, чем спонтанные проявления электрической деятельности бодрствующего мозга. В процессе сна ЭЭГ закономерно изменяется, что позволяет выделить определенные стадии сна. Рассмотрим классификацию стадий сна (Loomis A., 1937), используемую в настоящее время.
Стадия I (дремота, засыпание): на фоне низковольтной, относительно быстрой активности встречаются группы нерегулярных α-колебаний.
Стадия II (поверхностный сон): на уплощенном фоне кривой, содержащей низковольтные τ- и δ-колебания, появляются «сонные веретена» (12—18/с), билатеральные «острые» волны и К-комплексы (группа острых волн с последующим веретеном частотой α- и β-диапазона).
Стадия III (углубление сна): «сонные веретена» на фоне высокоамплитудных медленных волн δ-диапазона.
Стадия IV (глубокий сон): ЭЭГ представлена генерализованной, высокоамплитудной (100 мкВ и больше) δ-активностью (1—1,5/с).
Указанные стадии сна характеризуют так называемый медленный (ортодоксальный) сон. Эти термины возникли после того, как было сделано сообщение (Aserinsky E., Kleitman N., 1953) о существовании особых периодов естественного сна, сопровождающихся быстрыми движениями глазных яблок (БДГ, REM — rapid eyes movements) и возникающих несколько раз в течение ночи. Отмечалось, что именно на эти периоды приходится бОльшая часть сновидений. Энцефалограмма во время БДГ-периодов сна характеризуется исчезновением медленных волн и «сонных веретен», доминированием низковольтных быстрых колебаний потенциала, т.е. сходством с «активированной» ЭЭГ бодрствования или начальными периодами засыпания. Такая особенность ЭЭГ определила название БДГ-периодов («быстрый» сон, «парадоксальный» сон) и способствовала их первоначальной квалификации как периодов «поверхностного» сна, близкого к пробуждению. Однако резкое снижение мышечного тонуса и порогов пробуждения, наблюдавшееся во время «быстрого» сна, свидетельствовало в пользу противоположного мнения — о более глубоком снижении уровня бодрствования при БДГ, чем при «медленном» сне. Данные о динамике вегетативных реакций, сопровождающих переход от «медленного» сна к «быстрому», поддерживали то одно, то другое представление о «быстром» сне.
В последнее время многие исследователи склонны рассматривать «быстрый» сон как «бодрствование, обращенное внутрь», т.е. особое активное функциональное состояние мозга, связанное с оценкой и переработкой информации, поступившей во время бодрствования, переводом части информации из краткосрочной памяти в долгосрочную (информационная теория сна).
«Быстрому» сну придается значение одного из основных механизмов психологической адаптации, в процессе которой «вытесняется» информация, конфликтная по отношению к жизненному опыту и морально-этическим установкам индивидуума. Согласно гипотезе об анаболической функции сна, III и IV стадии «медленного» сна обеспечивают процессы ассимиляции (анаболизма) в организме в целом, а периоды «быстрого» сна связаны с восстановительными (анаболическими) процессами в тканях самого мозга. С этой гипотезой согласуется представление о том, что во время «быстрого» сна происходит упорядочение временных отношений в организме и прежде всего периодики циркадных (околосуточных) ритмов, присущих десяткам функций организма.
Особенности частотно-амплитудных характеристик основных ритмов ЭЭГ и представленности этих ритмов во время сна имеют неоспоримое значение для исследования феноменологии, природы и патологии сна, поскольку ЭЭГ является надежным маркером его стадий. Структура сна при различных видах пограничной психопатологии, для которой диссомния является одним из ведущих синдромов, подробно описывается в работах А.М. Вейна и соавт. (1983, 1989). Использование ЭЭГ в качестве маркера стадий сна позволяет целенаправленно исследовать нейрохимию каждой из стадий, оценивать психотропные препараты с точки зрения их воздействия на конкретную его стадию и перспектив фармакологической коррекции выявленных парциальных нарушений структуры сна.
В отличие от ЭЭГ-изменений во время сна, четко характеризующих переход из одного функционального состояния мозга в другое, изменения частотно-амплитудных характеристик ЭЭГ бодрствующего мозга оказались неспецифичными для конкретных функциональных состояний как в норме, так и при психопатологических расстройствах, и в этой связи были практически неинформативными для клинической электроэнцефалографии. Иллюстрацией к сказанному является существование нескольких типов спонтанной ЭЭГ при одном и том же состоянии бодрствующего покоя. Однако расширение нашего представления о частотном составе электрической активности мозга во время бодрствования способствовало пониманию целого ряда теоретических проблем. Среди них такие небезынтересные для клиники пограничной психиатрии проблемы, как значение типа ЭЭГ для реализации процессов возбуждения и торможения в коре, физиологический смысл ЭЭГ-ритмики, роль ритмических процессов в психической адаптации и дезадаптации.
Так, изучение частотно-амплитудной структуры ЭЭГ при психопатиях показало, что электроактивность возбудимых больных содержит условия для возникновения и распространения по коре возбуждения и для взрыва коркового возбуждения при раздражении. Таковыми являются гиперсинхронизация ритмики, способствующая иррадиации нервных процессов, и ускорение α- и β-ритма, свидетельствующее о повышенном уровне возбудимости коры. ЭЭГ тормозимых психопатических личностей характеризуется признаками активации (десинхронизации) и снижением возбудимости коры. Сочетание этих признаков создает условия для возникновения застойных очагов возбуждения. ЭЭГ при истерии включает в себя особенности того и другого паттерна, поэтому очаги возбуждения в коре легко возникают, быстро иррадиируют, но и быстро гаснут.
Функциональное значение ЭЭГ-ритмики исследовалось на модели условных рефлексов. Было показано, что успешная выработка условного рефлекса происходит тогда, когда возникает ритмическое сходство ЭЭГ областей мозга, участвующих в формировании условнорефлекторной деятельности. Такое сходство достигалось ритмическим единством (или ритмической кратностью) раздражающего и подкрепляющего стимулов. В противном случае условный рефлекс вырабатывался в 10 раз медленнее, и за это время у животных появлялись признаки дезадаптации и последующей тяжелой невротизации, которая сопровождалась грубыми диффузными нарушениями ЭЭГ. Способствующая выработке условного рефлекса изоритмия раздражителей становилась невротизирующим моментом при выработке дифференцировки, когда экспериментаторы пытались вопреки целесообразности действия объединить одним и тем же ритмом функционально различающиеся участки коры. Приведенные экспериментальные данные трактовались как указание на то, что ритмические процессы мозга являются существенным фактором в механизме установления корковых связей — основополагающей физиологической функции коры головного мозга.
Именно изучение пространственных взаимосвязей электроактивности коры позволило нейрофизиологам выявить не обнаруживаемые при спектральном анализе переходы бодрствующего мозга из одного функционального состояния в другое. Инструментом количественной оценки этих взаимосвязей стал корреляционный анализ. По мнению М.Н. Ливанова (1989), корреляционные взаимосвязи, характеризуя степень сходства электрических процессов мозга, являются показателями функционального единства тех областей мозга, которые участвуют в формировании конкретного функционального состояния.
У здоровых людей в состоянии покоя наблюдается небольшое количество точек (2,8 % пар отведений) с высокой корреляцией, причем это, как правило, близко расположенные области. Направление достаточно выраженных корреляционных связей совпадает с направлением ассоциативных волокон. При интеллектуальном напряжении усиливаются функциональные связи переднелобных областей мозга, что согласуется с представлением о лобных долях как о «компьютере мозга». У людей с профессиональными навыками ритмических движений выявляется тонкая и четкая динамика образования системы связей электрической активности определенных областей мозга в процессе формирования и закрепления этих навыков.
При исследовании особенностей пространственного распределения связей спонтанной электрической активности мозга у больных неврозами с обсессивным синдромом в состоянии покоя наблюдается картина усиления внутрилобных поперечных корреляционных связей, подобная той, которая имеет место при усилении интеллектуального напряжения у здоровых людей. Другие невротические проявления в клинике сопровождаются преимущественным изменением внутриполушарных связей: при истерии в наибольшей степени изменяются теменно-височные и теменно-затылочные корреляционные связи, а при неврастении — центрально-теменные, центрально-височные и центрально-лобные связи. По мере редукции психопатологических проявлений при неврозах все виды нарушения корреляционных связей спонтанной ЭЭГ нормализуются в процессе терапии.
Изучение спонтанной ЭЭГ корреляционным методом при всех положительных результатах и возможности их физиологической интерпретации имеет один, но существенный для клинической ЭЭГ недостаток: в силу специфики самого метода из анализа исключаются частотные характеристики и показатель представленности ритмов ЭЭГ, т.е. за рамками исследования остается собственно феномен спонтанной ЭЭГ. В то же время изучение количественных характеристик спонтанной ЭЭГ изолированно от анализа ее пространственной организации не может удовлетворить клинических нейрофизиологов, стремящихся найти ЭЭГ-корреляты различных патологических функциональных состояний. Помимо этого, большие сомнения вызывают сами традиционные принципы проведения клинико-электрофизиологических сопоставлений. Если считать, что особенности ЭЭГ отражают характерные признаки функционального состояния мозга, то поиски ЭЭГ-коррелятов шизофрении, неврастении, истерии и т.п. теряют смысл, поскольку каждое из этих понятий включает множество разнообразных патологических функциональных состояний.
Преодоление указанных и некоторых других противоречий, затрудняющих электрофизиологическое изучение психических заболеваний, становится возможным благодаря использованию системного подхода в клинико-электроэнцефалографических исследованиях. Теоретический базис таких исследований, принципы математического анализа и результаты изучения системной пространственной организации ЭЭГ у больных с эндогенной психопатологией подробно описаны в монографии К.К. Монахова и соавт. (1981).
Адекватным объектом исследования при таком подходе является не нозологическая форма, а психическое состояние больного во время нейрофизиологического обследования, детерминированное синдромальной структурой в большей мере, чем заболеванием в целом. Зарегистрированная в нескольких областях мозга ЭЭГ подвергается первичному ЭВМ-анализу (спектральный анализ, период-метрический анализ), в результате которого нейрофизиолог получает набор частотно-амплитудных характеристик всех ритмов ЭЭГ во всех исследуемых отведениях. Эти элементарные характеристики ЭЭГ становятся материалом для вторичного ЭВМ-анализа (факторный анализ и другие методы многомерной статистики), в процессе которого происходит сжатие информации, выявляются взаимосвязи элементов системной пространственной организации ЭЭГ и описывается ЭЭГ-паттерн, соответствующий исследуемому клиническому синдрому.
При исследовании системной организации ЭЭГ у больных с эндогенными психическими нарушениями были получены ЭЭГ-характеристики циклотимической и выраженной депрессии. Оказалось, что при легкой депрессии происходит разрушение пространственного ЭЭГ-паттерна, присущего здоровым людям. По мере утяжеления депрессии формируется новый паттерн пространственной организации ЭЭГ-ритмики, в котором наиболее информативна система ЭЭГ-связей правого полушария.
При изучении параноидных расстройств были получены компоненты канонической корреляции, имеющие сложную пространственную структуру, которая характеризовала в основном не частотный состав ЭЭГ, а соотношение частот, зарегистрированных в различных областях мозга. Особенности структуры конкретных компонент тесно коррелировали с выраженностью одного из основных клинических проявлений параноидной шизофрении (аффективные расстройства, псевдогаллюцинации, бред воздействия) и позволили диагностировать на статистически достоверном уровне выраженность у больных перечисленных психических нарушений.
Рассмотренные данные с достаточной определенностью указывают на то, что особенности системной пространственной организации спонтанной электрической активности мозга тесно связаны с особенностями психопатологических состояний.
Такой вывод справедлив, очевидно, не только в отношении больных с эндогенными расстройствами, но и в отношении психических нарушений пограничного уровня при отсутствии психотических нарушений. Об этом, в частности, свидетельствуют результаты исследования системной пространственной организации ЭЭГ у больных с психогенными субдепрессивными расстройствами. Факторизованные ЭЭГ-показатели больных с астеноадинамическими субдепрессиями были сопоставлены с аналогичными показателями, полученными при психотической депрессии. Оказалось, что из 15 факторов, характеризовавших особенности ЭЭГ при психотической депрессии, 4 фактора вошли в ЭЭГ-характеристику субдепрессии. Это позволило считать, что имеется частичное сходство изменений пространственной организации ЭЭГ при субдепрессии с изменениями ЭЭГ, свойственными больным с психотической депрессией. Полное описание ЭЭГ-особенностей субдепрессии составили 25 факторов, достоверно отличавшихся от ЭЭГ-факторов нормы. При этом лишь немногие паттерны пространственного изменения ЭЭГ, представленные изученными факторами, были характерны для отдельных симптомов (в основном тревога, депрессия) (табл. 7). В большинстве же случаев группы факторов коррелировали с определенными симптомокомплексами. Состояние адинамии нашло свое отражение в трех факторах, что свидетельствует, вероятно, о ее разнообразной нейрофизиологической основе.
Таблица 7. Структура ЭЭГ-факторов, достоверно отличающих больных с субдепрессией от здоровых обследуемых
| Параметры ЭЭГ | Структура факторов | Клинические признаки |
| Частота | О1(↓β, ↑δ), ↓δP3 | Тревога |
| » | О1 (↓β, ↑δ), ↑τР4 | Астенические расстройства Депрессия |
| Индекс | β (↓О1, Р3, ↑4) | Адинамия |
| » | F4 (↓α, ↑τδ) | Астенические расстройства |
| Амплитуда | β (↓О1, ↑F3) | Адинамия |
| P3↓ (τδ) | Депрессия | |
| Индекс | F3 (↓α, ↑τδ), ↑τР4 | |
| » | δ (↓P3, ↓F3) | Адинамия |
| Частота | τ (↑C3, F3, ↓О2) | |
| » | δ (↑C3, ↓P4), ↑τF4 | Тревога |
| Амплитуда | F4↓ (β, α, τ), ↑O2 (β, α) | Астенические расстройства |
| Индекс | C3 (↑α, ↓τ), ↑τР4 | |
| » | C4 (↑α, ↓τ, δ) | Депрессия |
Примечание: греческие буквы обозначают ритмы ЭЭГ, латинские буквы — отведения ЭЭГ по международной схеме 10—20 (Frontal, Central, Parietal, Occipital; нечетные числа — левое полушарие, четные — правое полушарие). Стрелки вверх и вниз — усиление или ослабление признака относительно нормы. За скобки вынесены общие члены структуры данного фактора.
Выявление дифференцированных клинико-ЭЭГ-коррелятов на уровне системной организации электрических процессов мозга сопряжено с рядом трудностей, возникающих в процессе их поиска и изучения. Прежде всего необходим высокий уровень технического оснащения и математического обеспечения исследований. Не меньшее значение имеют и специальные статистические процедуры формирования «рафинированных» подгрупп изучаемых больных. При этом необходимо учитывать влияние на ЭЭГ-показатели психофармакотерапии, как правило, назначаемой подавляющему числу больных, обращающихся к врачу-психиатру. В связи с последним обстоятельством особое значение в настоящее время приобретает новое направление электроэнцефалографии, которое имеет уже достаточно устоявшееся название (нейропсихофармакология) и хорошо разработанный метод анализа — количественную фармакоэлектроэнцефалографию (quantitative pharmacoelectroencephalography, QPEEG). Исследователи, являющиеся ведущими в этой области, определяют QPEEG как «процесс, который включает в себя использование ЭВМ-анализа спонтанной ЭЭГ и серию статистических процедур, направленных на выявление центрального действия новых препаратов, предсказание их клинического (психотропного) действия, оценку их эффективной дозы и продолжительности действия после приема разовой пероральной дозы препарата» (Itil T.M., 1974).
Основным моментом количественной фармако-ЭЭГ является получение компьютеризованного ЭЭГ-профиля (КЭЭГ-профиля) исследуемого препарата. КЭЭГ-профиль представляет собой статистическую оценку реакции ЭЭГ-ритмов на воздействие психофармакологического средства. Изображается ЭЭГ-профиль в виде графика, по оси абсцисс которого располагаются частотные показатели ЭЭГ-диапазона (от 0 до 35 Гц), а по оси ординат — величины Т-критерия, характеризующие закономерность изменения частотных показателей ЭЭГ после введения психотропного препарата (рис. 10). Для построения КЭЭГ-профиля обычно используют данные электроэнцефалограммы, зарегистрированной от правой затылочной области, в которой представлены в основном все виды ритмической активности.
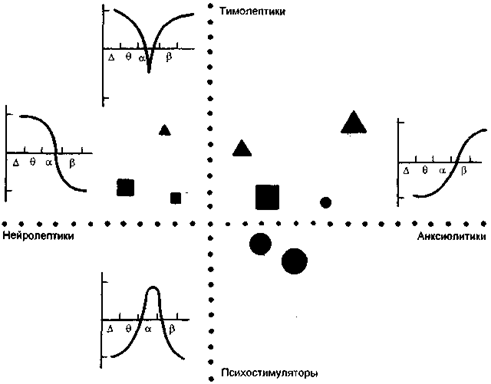
Конфигурацией значка закодирован определенный препарат; величиной значка закодирована большая или меньшая доза. Возле каждой из осей координат схематически изображены ЭЭГ-профили соответствующего класса препаратов, описанные в тексте.
Рис. 10. Компьютерная ЭЭГ-классификация психотропных препаратов (по Itil T.M., 1982).
Воздействие различных психотропных средств вызывает весьма специфичные изменения основных ритмов ЭЭГ. Препараты со сходным клиническим действием имеют сходные КЭЭГ-профили. Наиболее ярким подтверждением этого факта являются данные об успешном ЭЭГ-предсказании психотропных свойств новых фармакологических препаратов и биологических субстанций, например гормонов (Itil T.M., 1982).
Квалификация психотропных свойств препаратов производится при сопоставлении КЭЭГ-профиля данного препарата с эталонными КЭЭГ-профилями всех основных классов психотропных веществ (нейролептики, тимолептики, анксиолитики, психостимуляторы). Степень сходства исследуемого КЭЭГ-профиля с каждым из эталонов определяет место данного препарата в системе координат, что позволяет описать его психотропные свойства.
Нейролептический КЭЭГ-профиль характеризуется усилением медленной части спектра (δ, τ) и замедленные (α-волны) и ослаблением быстрых β-волн и быстрой α-активности. Анксиолитики вызывают ослабление δ-τ-диапазона и усиление всего β-диапазона. Для КЭЭГ-профиля тимолептиков характерно усиление δ-, τ- и β-активности и ослабление α-ритма. КЭЭГ-профиль психостимуляторов свидетельствует о том, что под воздействием психоактивирующих средств происходит угнетение δ-, τ- и быстрой β-активности при усилении α-ритма и медленной части β-диапазона. КЭЭГ-профиль ноотропов близок по своей структуре к КЭЭГ-профилю психостимуляторов.
Изучение системной пространственной реорганизации ЭЭГ, вызванной введением психотропных препаратов, обнаружило, что психотропное воздействие затрагивает различные уровни интеграции электрических процессов мозга (от уровня общемозговой интеграции до уровня межполушарной, внутриполушарной и локальной организации электроактивности). Представленные выше классические ЭЭГ-профили описывают наслаивающиеся друг на друга генерализованную реакцию и локальные изменения в правой затылочной области.
Значение количественной фармако-ЭЭГ не ограничивается областью ЭЭГ-анализа психотропных свойств препаратов и экспериментально-теоретическими изысканиями в области нейрофизиологических механизмов психотропного воздействия. Этот метод (и в классическом варианте, и при системном подходе к анализу ЭЭГ-реакции на психотропные препараты) раскрывает новые возможности для предикции эффективности курсовой терапии по характеру ЭЭГ-реакции на первую пробную разовую дозу препарата, выбранного врачом в качестве основного лечебного средства. Использование ЭЭГ-предикторов в клинической практике способно существенно повысить целенаправленность и индивидуальную адекватность фармакотерапии.
Классическими предикторами эффективности терапии являются достаточная выраженность ЭЭГ-реакции и типичность ЭЭГ-профиля тестируемого препарата, т.е. показатели общей и специфической реактивности.
При специально проведенном анализе системноорганизованной ЭЭГ-реакции на пробную дозу препарата были получены ЭЭГ-паттерны, обладающие свойствами предикторов эффективности курсовой терапии нейролептиками и антидепрессантами. В первом случае это были ЭЭГ-факторы, описывавшие в основном внутриполушарные перестройки β- и α-активности, а во втором случае — ЭЭГ-реакции, отражающие сглаживание межполушарной асимметрии ритмов. Кроме того, были выделены ЭЭГ-реакции, свойственные только больным с отрицательным или незначительным эффектом курсовой терапии. Они касались изменения тех сторон пространственной организации ЭЭГ, которые отличались большой стабильностью при эффективной терапии. Такие факты, очевидно, могут свидетельствовать о том, что при неэффективном лечении психофармакологическое воздействие, адресованное определенным механизмам нарушения психической деятельности, не достигает цели. Оно как бы переадресовывается мозговым процессам, не имеющим прямого отношения к нарушенной психической функции.
Исследование влияния транквилизаторов также выявило ЭЭГ-реакции, содержащие прогностическую информацию об отдаленном терапевтическом эффекте. Как выяснилось, слабые фармакологические воздействия на ЭЭГ разовой дозы анксиолитика имеют прогностическую значимость не только на временных срезах, характеризующихся максимальной выраженностью изменений ЭЭГ (через 1 и 4 ч после введения препарата), но и при угасании этих изменений (через 24 ч). Наибольшей прогностической информативностью обладали перестройки ЭЭГ-ритмики правого полушария в целом и центрально-теменных отделов обоих полушарий мозга. Были выделены пространственные паттерны ЭЭГ-реакции, зарегистрированной через 1 ч после введения однократной дозы транквилизаторов, и обнаружена их избирательная связь с нормализацией к 14-му дню терапии таких психических нарушений, как эмоциональная напряженность, депрессия, расстройства психической активности, вегетативные расстройства, дневная сонливость.
Дальнейшее развитие количественной фармакоэлектроэнцефалографии открывает новые перспективы для понимания самого феномена спонтанной ЭЭГ и использования ее показателей в клинической практике. Психофармакологические воздействия из фактора, затрудняющего ЭЭГ-анализ психопатологического состояния, могут перейти в ранг специфических маркеров нарушения психической деятельности. Традиционная клиническая электроэнцефалография позволяла успешно интерпретировать признаки активации и торможения коры только в рамках представлений о регуляции уровня бодрствования, чем и обусловлено безоговорочное значение клинической ЭЭГ лишь для изучения сна. Однако в настоящее время известны не только неспецифические активирующие системы, функциональное значение которых определяется регуляцией уровня бодрствования, но и специфические нейромедиаторные активирующие системы (дофаминергическая, адренергическая, холинергическая, гамкергическая и т.д.). Поскольку каждый психотропный препарат достаточно узкого спектра действия целенаправленно активирует и угнетает какую-либо из этих систем, данные количественного фармако-ЭЭГ-анализа, очевидно, могут отражать изменения психического состояния и особенности нейромедиации, определяющие конкретное состояние.
До недавнего прошлого роль электроэнцефалографии, располагавшей только общепринятыми методами анализа, ограничивалась в психиатрической клинике выявлением диффузных и очаговых органических поражений головного мозга. Компьютеризация ЭЭГ-исследований превращает ЭЭГ в ценный комплексный параклинический показатель, дающий дополнительную объективную оценку исходного психического состояния и динамики психопатологических проявлений во время терапии. Компьютеризованная ЭЭГ открывает новые перспективы для предикции свойств психотропных препаратов и эффективности фармакотерапии, а также для углубленного анализа нейрофизиологических закономерностей в развитии и редукции психических нарушений.
Дата добавления: 2016-09-06; просмотров: 2960;











