Кристаллическое строение металлов
Из встречающихся на Земле 92 элементов около 80 являются металлами. Все металлы имеют общие характерные свойства: пластичность, высокие тепло- и электропроводность, металлический блеск и т.д. Подобными свойствами обладают и металлические сплавы – вещества, состоящие из двух или более элементов.
Свойства металлов, отличающие их от других веществ, обусловлены особенностями их внутреннего строения. Любой металл можно представить состоящим из большого числа атомов, в которых положительно заряженные ядра (ионы) окружены электронами. Эти электроны легко смещаются с орбиты одного из атомов на орбиту другого. Число таких коллективизированных электронов в металлах разное. Этим объясняет различие в электропроводности металлов.
Металлам характерен металлический тип связи, обусловленный электростатическим притяжением между ионами и свободными электронами. Металлы имеют кристаллическое строение. Оно характеризуется закономерным расположением атомов в пространстве и образованием кристаллической решетки.
Типы кристаллических решеток.Кристаллическое строение металлов условно можно представить как упорядоченное расположение атомов в пространстве. Каждый из атомов имеет определенное количество соседей, расположенных на одинаковых расстояниях от него. Представить объёмное строение металлов позволяет пространственная кристаллическая решетка, формируемая многократным воспроизведением плоской кристаллической решетки параллельно самой себе (рис. 2.1).

Рис. 2.1. Схема пространственной кристаллической решетки
Для удобства кристаллическое строение обычно изображают, показывая кружками только центры тяжести атомов и соединяя их прямыми линиями, которые символизируют межатомные связи. Наименьшая часть объёма кристаллической решетки, которая определяет её систему, называется элементарной кристаллической ячейкой.
Для описания формы и размеров элементарной кристаллической ячейки используют следующие величины: три расстояния от атомов в узлах решетки до их ближайших соседей по осям координат – параметры решетки a, b, c и три угла между этими осями – α, β, γ. Кроме того, каждая элементарная кристаллическая ячейка имеет свои характеристики: координационное число – числоатомов, расположенныхна ближайшем одинаковом расстоянии от любого атома и плотность упаковки – отношение объема, занятого атомами, к объему ячейки.
Большинству металлов свойственно образование высокосимметричных решеток с плотной упаковкой атомов.
Наиболее распространены следующие типы кристаллической решетки.

Рис. 2.2. Схема объемно-центрированной кубической (а) и гранецентрированной кубической (б) решетки
Объемно-центрированная кубическая решетка (ОЦК), представляющая собой куб с дополнительным атомом, расположенным в центре. У такой решетки параметр a = b = c, угол α = β = γ = 90° (рис. 2.2а).
Такую решетку имеют Fe, Cr, W, V, Mo и др.
Гранецентрированная кубическая решетка (ГЦК), также представляющая собой куб с дополнительными атомами, расположенными в центре каждой грани. У такой решетки также параметр a = b = c, угол α = β = γ = 90° (рис. 2.2б).
Такую решетку имеют Fe, Cu, Al, Ni, Au.
Гексагональная плотноупакованная решетка (ГПУ) с шестиугольниками в верхнем и нижнем основании, образуемыми расположенными там атомами и одним атомом в центре каждого шестиугольника. Внутри каждой фигуры расположены три атома (рис. 2.3а).
Такую решетку имеют Zn, Mg, Cd (кадмий) и др.

Тетрагональная решетка получается при растягивании куба вдоль одной оси. У такой решетки параметр с> а, с > b, а = b. Такая решетка может быть объёмноцентрированной (рис. 2.3б) и гранецентрированнной. Подобную решетку имеют индий и радий.
У некоторых металлов кристаллическая решетка может изменяться при изменении температуры. Это явление называется полиморфизмом или аллотропией. Полиморфизм может вызывать изменение свойств. Он характерен для Fe, Ti, Sn, Zr, C.
Кристаллизация металлов.Процессы плавления и кристаллизации металлов и сплавов происходят в соответствии со ΙΙ законом термодинамики. Согласно этому закону, все процессы в системе происходят в направлении уменьшения её свободной энергии.
Изменение величины свободной энергии в зависимости от температуры для твердого и жидкого состояний приведено на рис. 2.4.
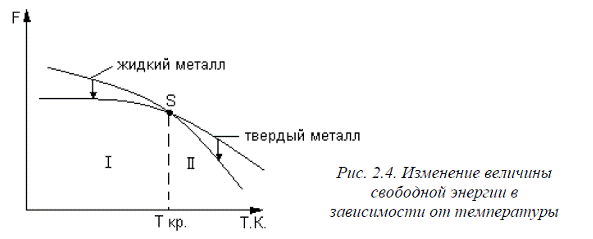
При температурах ниже Ткр(область Ι) свободная энергия твердого металла меньше свободной энергии жидкого, поэтому протекает процесс кристаллизации,и металл затвердевает. При температурах выше Ткр(область ΙΙ) жидкий металл обладает меньшей свободной энергией, поэтому в данной области протекает процесс плавления, и металл находится в жидком состоянии.
При нагреве кристаллического тела (металла) наблюдается граница перехода из твердого состояния в жидкое. То же самое наблюдается при охлаждении, то есть при переходе из жидкого состояния в твердое (рис. 2.5).
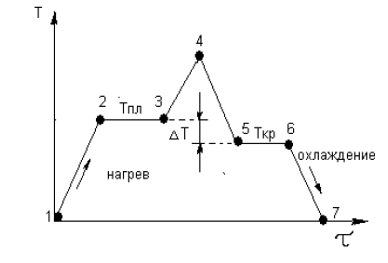
Рис. 2.5. График нагрева и охлаждения металла
На участке 1 – 2 подвод тепла к металлу сопровождается повышением его температуры. За счет поглощения тепловой энергии увеличивается амплитуда колебаний атомов кристалической решетки.
На участке 2 – 3 подвод тепла не приводит к повышению температуры, а подводимая энергия расходуется на разрушение кристаллической решетки и перевод атомов в неупорядоченное состояние, то есть переход из твердого состояния в жидкое. На участке 3 – 4 подвод тепла вызывает повышение температуры уже жидкого металла. На участке 4 – 5 идет охлаждение жидкого металла. На участке 5 – 6 происходит кристаллизация металла. При этом выделяется тепло, которое называют скрытой теплотой кристаллизации. Кристаллизация металла происходит не при температуре плавления, а при переохлаждении на величину ΔТ. Величина ΔТ называется степенью переохлаждения и является разностью между теоретической температурой плавления (кристаллизации) и фактической температурой кристаллизации.
Механизм кристаллизации металла состоит в том, что при понижении температуры жидкого металла в нем начинают образовываться мелкие кристаллы, называемые центрами кристаллизации (или зародышами). Вокруг этих образовавшихсяцентров начинают расти кристаллы (рис. 2.6). Процесс кристаллизации металла состоит из 2-х элементарных процессов: 1) зарождение центров кристаллизации; 2) рост кристаллов из этих центров.
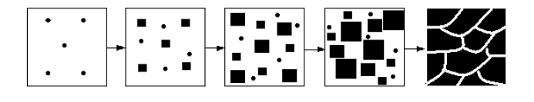
Рис. 2.6. Схема процесса кристаллизации металла
По мере роста кристаллов в жидком металле продолжают возникать новые центры кристаллизации. Растущие из них кристаллы ориентированы произвольно, и при столкновении с соседними правильная форма кристаллов нарушается, становится произвольной. Металл, состоящий из большого количества таких кристаллов, называется поликристаллическим.
Строение реальных металлов.Металлы и сплавы, полученные в обычных условиях, состоят из большого количества кристаллов, то есть имеют поликристаллическое строение. Эти кристаллы называют зернами. Они обычно имеют неправильную форму (рис. 2.7). Каждое из этих зерен имеет свою ориентировку кристаллической решетки, отличающуюся от соседних.

Рис. 2.7. Металлографическое изображение технически чистого
титана марки ВТ1-0
Изучение строения металлов с помощью электронной микроскопии и рентгеноструктурного анализа показало, что внутреннее кристаллическое строение зерен не является правильным. В кристаллической решётке металла существуют различные дефекты несовершенства). Эти дефекты нарушают связи между атомами и оказывают влияние на свойства металлов.
Различают три вида структурных несовершенств: точечные, линейные и поверхностные. Все эти несовершенства характеризуются малыми – соизмеримыми с межатомным расстоянием – размерами. Точечные дефекты малы в трех измерениях; линейные дефекты малы в двух измерениях, а в одном велики – составляют десятки микрометров; поверхностные дефекты малы в одном измерении, а в двух – велики.
Точечные дефекты кристаллической решетки.Это вакансии, межузельные атомы, примесные атомы (рис. 2.8).
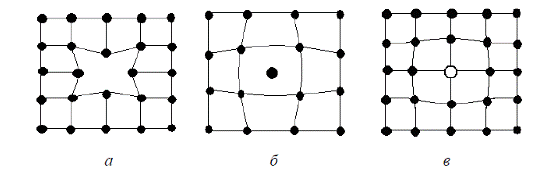
Рис. 2.8. Схемы точечных дефектов кристаллического строения:
а – вакансия; б – межузельный атом; в – примесный атом
Вакансия – это отсутствие атома в узле кристаллической решетки (рис. 2.8а). Вокруг вакансии возникает искажение кристаллической решетки и напряжения. Наличие вакансий в решетке сообщает атомам подвижность. При нагреве металла атомы перемещаются в процессе диффузии и самодиффузии (рис. 2.9). Число вакансий зависит от температуры металла. С повышением температуры число вакансий сильно увеличивается. Скопление вакансий может привести к образованию пустот и пор.

Рис. 2.9. Мигрирование вакансии в кристаллической решетке:
а – первоначальное местоположение вакансии; б – смещение атомов;
в – новое местоположение вакансии
Межузельный атом – это атом, вышедший из узла кристаллической решетки и занявший место в междоузлии (рис. 2.8б). Вокруг такого атома также возникает искажение кристаллической решетки. Величина искажений больше, чем при образовании вакансии. Межузельные атомы вызывают упрочнение металла. Вакансии и межузельные атомы могут аннигилировать.
Примесный атом – атом, занимающий в кристаллической решетке металла место основного атома (рис. 2.8в). Примесный атом всегда отличается по размеру от основных атомов.
Линейные дефекты кристаллической решетки.К линейным дефектам относятся дислокации (рис. 2.10).
Дислокация – это особая конфигурация расположения атомов в кристаллической решетке. Дислокации бывают двух основных видов: краевые и винтовые. Краевую дислокацию образует лишняя атомная полуплоскость, образованная в части кристалла. Эта полуплоскость называется экстраплоскостью.

Рис. 2.10. Схемы линейных дефектов кристаллического строения:
а – краевой дислокации; б – винтовой дислокации
Винтовая дислокация получается при частичном сдвиге кристаллической решетки. При этом образуется ступенька, проходящая по части кристалла. В металлах могут возникать также смешанные дислокации, которые состоят из краевых и винтовых дислокаций.
Образование дислокаций повышает энергию кристалла. Плотность дислокаций зависит от состояния металла. После отжига плотность дислокаций составляет 104 – 108 см-2. После холодной деформации плотность дислокаций увеличивается с 107 – 108 см-2 до 1011 – 1012 см-2. Изменение плотности дислокаций сильно влияет на свойства металлов. Повышение плотности дислокаций увеличивает прочность.
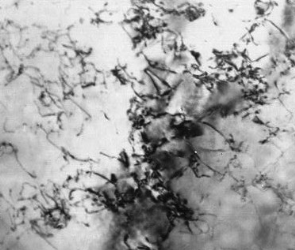
Рис. 2.11 Дислокационная структура в ферритном звене стали 20
Анализ дислокационной структуры проводят с помощью электронной микроскопии. На рис. 2.11. представлено светлопольное изображение зерна феррита в малоуглеродистой стали. Дислокации наблюдаются в виде нитевидных включений, декорированных атомами легких элементов: углерода, азота, водорода и т.п. Просвечивающая электронная микроскопия позволяет не только увидеть дислокации, но и рассчитать их количество, а так же оценить морфологию.
Поверхностные дефекты кристаллического строения.Эти дефекты имеют малую толщину при значительных размерах в двух измерениях. Примерами поверхностных дефектов являются границы зерен и дефекты упаковки.
При поликристаллическом строении зерна в металлах повернуты одно относительно другого, и на границах между ними атомы не имеют правильного расположения (рис. 2.12).
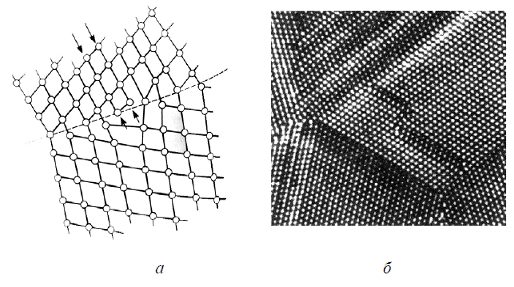
Рис. 2.12. Схема границы между кристаллитами (а) и атомно-силовое изображение границ зерен (б)
Внутри зерен также выявляются нарушения правильного кристаллического строения. Дефекты упаковки возникают при сдвиге, внедрении или удалении плотноупакованной плоскости.
Поверхностные дефекты, так же как точечные и линейные оказывают влияние на механические свойства металлов, упрочняя их.
Объемные дефекты.В металлическом материале встречаются так называемые объемные дефекты. Они имеют значительные размеры в трех измерениях и образуются в процессе производства металла, либо при изготовлении заготовки или готового изделия. Это поры, раковины, пустоты, включения шлаков, окислов и т.д. Так, в газотермических покрытиях, наносимых на детали для их восстановления и упрочнения, объемными дефектами являются границы между напыляемыми частицами, внутренняя пористость, сформировавшаяся при кристаллизации частиц и др. (рис. 2.13). Объемные дефекты снижают прочность металлов.

Рис. 2.13 Микроструктура газотермического покрытия из сплава на основе никеля ( 200)
Дата добавления: 2020-11-18; просмотров: 607;











