Перегонка с дефлегмацией
Основные понятия ректификации
В настоящее время для выделения пищевого спирта из спиртсодержащих жидкостей (спиртовой бражки, плодовых или виноградных вин) применяют два основных способа:
перегонку или дистилляцию[1],в этом случае полученный напиток называют дистиллированным, это виски, коньяк, текила, граппа, кальвадос. Крепость полученного в результате перегонки дистиллята редко превышает 60-70% об.;
ректификацию используют для почти полной очистки спирта от примесей с одновременным концентрированием спита до 92-93% об. Полученный продукт по ГОСТ Р 52190-2003[2] называется ректификованным спиртом (термин спирт-ректификат признан устаревшим). Ректификованный спирт редко используется в качестве конечного продукта (за исключением питьевого спирта крепостью 95% об., производимого для районов Крайнего Севера), а является спиртовой основой для других напитков: водок, ликероводочных изделий и ликеров.
Несмотря на существенное отличие в аппаратурном оформлении обоих способов их физические основы одинаковы и базируются на молекулярно-кинетической теории.
Молекулярно-кинетической теорией называют учение о том, что все вещества состоят из молекул, которые находятся в вечном хаотическом движении. Основоположником молекулярно-кинетической теории в России является Ломоносов.
Основные положения:
1. Все вещества дискретны, состоят из молекул и атомов. Молекула – мельчайшая электрически нейтральная частица вещества, сохраняющая его химические свойства. Атом – мельчайшая частица данного химического элемента.
2. Все молекулы и атомы находятся в вечном хаотическом движении,
3. Между молекулами всех веществ всегда присутствуют силы притяжения и отталкивания, имеющие электромагнитное происхождение.
Наблюдая хаотичное движение микроскопических спор растений под действием ударов молекул, ботаник Броун в 1827 году открыл броуновское движение – движение мельчайших частиц твердого вещества под действием молекул жидкости, в которой эти частицы находятся.
Броуновское движение свидетельствует о том, что между молекулами всех веществ имеется свободное пространство. Опытным подтверждением этого факта является диффузия веществ[3] – проникновение молекул одного вещества между молекулами другого при их соприкосновении. Наиболее медленно диффузия протекает в твердых веществах (опыты со срастанием сжатых полированных металлических пластинок через 20 лет). Межмолекулярные промежутки у жидкостей значительно больше и диффузия быстрее (опыт с медным купоросом и водой – скорость диффузии около 3 суток). Еще быстрее она протекает у газов (опыт с эфиром – распространение запаха по комнате за несколько минут).
Чем выше температура, тем быстрее движутся молекулы, а, значит, скорость диффузии выше. Физический смысл температуры – это мера средней кинетической энергии теплового движения молекул, при этом абсолютный ноль (по шкале Кельвина, по Цельсию - 273°С) – это температура, при которой прекращается тепловое движение частиц. Температура ниже абсолютного нуля не существует – она не имеет физического смысла.
Изобретателем технологии получения спирта из сброженного виноградного вина дистилляцией считается монах-алхимик из Прованса (по другой версии - врач городка Монпелье во Франции) Арнольд (Арно?) де Вилльнев (ок. 1333 – 1334 гг.). Описание конструкции этого аппарата не сохранилось.
Для выделения спирта был использован известный, вероятно, с древнейших времен факт о различной крепости спиртсодержащей жидкости и паров над ней. Разделение при этом основано на различной температуре кипения отдельных веществ, входящих в состав смеси (раздельно кипящие смеси).
Для простоты дальнейшего изложения примем, что смесь состоит только из двух компонентов: спирта и воды. Такие смеси называются бинарными.
Молекулы поверхностного слоя жидкости испытывают меньшее давление, чем молекулы в толще, т.к. с одной стороны находится газ с большими расстояниями между молекулами. Такой частный случай диффузии был назван парообразованием – переход жидкого вещества в газообразное состояние. Обратный процесс называется конденсацией. Поэтому некоторые молекулы отрываются с поверхности жидкости, а некоторые, в том числе и молекулы внешнего газа (растворение газа), могут возвращаться обратно. Поскольку при испарении жидкость покидают молекулы с наибольшей кинетической энергией, то суммарная кинетическая энергия жидкости снижается – она охлаждается.
Образовавшийся пар содержит большее количество молекул спирта, чем их было в испаряемой жидкости, поскольку спирт, имея более низкую температуру кипения, чем вода, обладает более высокой энергией броуновского движения.
Если число молекул, вылетевших из жидкости при испарении, превышает число молекул возвращенных в жидкость, то такой пар называется ненасыщенным. Пар, находящийся в состоянии динамического равновесия с жидкостью (число молекул, вышедших из жидкости, равно числу, возвратившихся), называется насыщенным.
Это положение, непосредственно вытекающее из молекулярно-кинетической теории, сформулировал Д.П. Коновалов в своем первом законе: насыщенный пар бинарной смеси обогащается тем компонентом, прибавление которого к раствору понижает температуру кипения. Так при содержании спирта в смеси 80 мас.%, в паре спирта будет 85,6 мас.%.
Полученные пары конденсируются в холодильнике, образуя так дистиллят; неиспаренная жидкость называется остатком (или, поскольку для перегонки традиционно использовали т.н. перегонные кубы – кубовым остатком). Таким образом, в результате перегонки спирт переходит в дистиллят, а вода – в остаток.
Описанный процесс, называемый простой перегонкой, не дает, однако, возможности произвести полное разделение компонентов смеси и получить их в чистом виде. Оба компонента являются летучими и потому оба переходят в пары, хотя и в различной степени. Поэтому образующиеся при перегонке пары не представляют собой чистый спирт, однако в дистилляте содержание спирта выше, чем в исходной смеси, а в остатке, наоборот, ниже, чем в исходной смеси. В описанном явлении и заключается основное отличие перегонки от выпаривания. При выпаривании, один из компонентов (растворенное вещество) нелетуч, и в пары переходит только летучий компонент (растворитель).
При обычной температуре скорость молекул в броуновском движении невелика и процесс перегонки может растянуться на недели. Испарение (букв. – превращение в пар) это парообразование с открытой поверхности жидкости, происходящее при любой температуре.
Для придания молекулам большей энергии применяют нагревание жидкости внешним источником тепла. Однако в этом случае скорость выхода молекул из жидкости уже начинает лимитироваться поверхностью испарения. Возможно, увеличить скорость, разливая жидкость тонким слоем по горячей поверхности, однако для практического применения такой способ неприемлем.
Дальнейший нагрев жидкости приводит, как известно, к ее кипению. Кипение это парообразование не только с открытой поверхности, но и внутри жидкости, происходящее при одной, определенной для данной жидкости температуре. Кипение не только повышает энергию молекул, но и приводит к значительной турбулизации, важной для интенсификации процессов массо- и теплопередачи. Кипение, впрочем, может быть вполне полноценно заменено на интенсивное смешение пара и жидкости, что используется в ректификационных колоннах.
Пусть концентрация спирта в кипящей жидкой смеси – X, а концентрация в насыщенном паре над кипящей жидкостью – Y. (Напомним, что насыщенным называется такой пар, для которого количество возвратов и вылетов молекул из жидкости в газовую среду, в данном случае - спирта будут равны, жидкость перестает испаряться, наступает динамическое (т.е. подвижное – зависящее от температуры и давления) равновесие). При установившемся процессе (постоянной температуре (кипения), давлении, концентрации спирта в кипящей жидкости) отношение X/Y = K будет величиной постоянной, характерной для данной пары жидкости, и именуется коэффициентом испарения. Графическое изображение функции 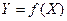 (для установившегося процесса и насыщенных паров) называется кривой фазового равновесия (диаграмма X – Y).
(для установившегося процесса и насыщенных паров) называется кривой фазового равновесия (диаграмма X – Y).
Для так называемых «правильных» или «идеальных» смесей эта зависимость графически выражается плавной кривой (рис. 3).
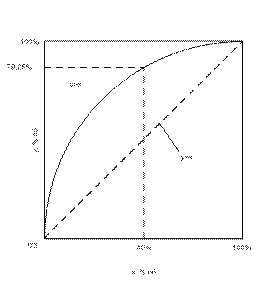
| Рис. 3. Кривая фазового равновесия для идеальной смеси |
Разница между прямой Y=X и кривой  показывает насколько содержание спирта в парах выше его содержания в испаряемой жидкости. Естественно: при отсутствии спирта в жидкости она отсутствует и в парах (х=0), при чистом спирте (х=100%) - содержание в паре спирта равно давлению насыщенного пара спирта при данных условиях.
показывает насколько содержание спирта в парах выше его содержания в испаряемой жидкости. Естественно: при отсутствии спирта в жидкости она отсутствует и в парах (х=0), при чистом спирте (х=100%) - содержание в паре спирта равно давлению насыщенного пара спирта при данных условиях.
Однако пара вода - этиловый спирт не является идеальной, имеет место образование гидратов этанола, процесс растворения идет с выделением тепла, кривая зависимости температуры кипения смеси имеет вид кривой с точкой минимума при 97,2° (рис. 4).
Таким образом, при температурах меньших точки С прибавление спирта к раствору понижает температуру кипения, поэтому из первого закона Коновалова пар обогащается спиртом, т.е. молекулы спирта имеют более высокую, чем вода, кинетическую энергию. Однако после точки С наоборот: чем выше содержание спирта, тем выше температура кипения, а значит, пары начинают обогащаться водой (обедняться спиртом).
Анализируя испарение водно-спиртовой смеси в точке С, мы можем прийти к выводу, что в ней испарение происходит без изменения состава: концентрация спирта в жидкости и парах равная 97,2% об. Такое состояние называют азеотропией (кинетические энергии молекул воды и спирта равны – значит и количество молекул выходящих с поверхности одинаковы), жидкости становятся нераздельнокипящими и состав пара становится равным составу жидкости, разделение смесей становится невозможным.
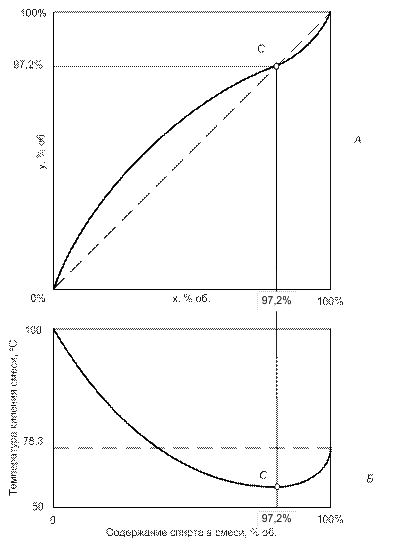
| Рис. 4. Кривая фазового равновесия бинарной системы спирт-вода (А) и зависимость температуры кипения смеси от ее состава (Б), точка С - точка азеотропии (для наглядности масштаб не соблюден) |
Положение азеотропной точки может быть определено по второму закону Д.П. Коновалова: в точках экстремума функции зависимости температуры кипения смеси от ее состава жидкость становится нераздельнокипящей. Смесь состава от 0% до точки С называется доазеотропной, после нее - заазеотропной. Для смеси спирт-вода и атмосферном давлении азеотропия наступает при содержании спирта в растворе 97,2% об., следовательно, путем перегонки (даже многократной) максимальная концентрация этилового спирта в парах (и дистилляте) не может выше концентрации смеси в азеотропной точке, т.е. 97,2 % об., поскольку в заазеотропной области происходит обогащение паров не спиртом, а водой.
Положение точки азеотропии на кривой диаграммы X-Y меняется в зависимости от давления. Для кривых температуры кипения пара с минимумом (спирт-вода) при повышении давления она снижается по диагонали вниз, при понижении – вверх (для кривых с максимумом повышение давления действует противоположным способом – законы азеотропного равновесия Вревского М.С.). Смесь спирт-вода начинает вести себя как правильный раствор (т.е. азеотропная точка смещается вверх до Х=100%) при давлении 70 мм рт. ст. (температура кипения спирта 27°С), на чем основаны ректификационные схемы, работающие под разрежением.
Построение равновесных диаграмм расчетным путем возможно только для идеальных смесей или нерастворимых жидкостей, в остальных случаях (в том числе и для смеси спирт-вода) равновесные концентрации определимы только опытным путем.
Все известные сопутствующие примеси спирта по летучести можно сгруппировать в четыре вида: головные, хвостовые, промежуточные и концевые. Зная зависимость температуры их кипения от состава смеси, и применяя 1-ый закон Д.П. Коновалова, мы легко можем построить кривые равновесия.
При очистке спирта от сопутствующих летучих примесей их летучесть оценивается в сравнении с летучестью этилового спирта. Для этого введено понятие коэффициент ректификации примесей:
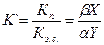 ,
,
где Кп - b/a – коэффициент испарения примеси;
a и b – содержание примеси в жидкости и паре;
Кэ.с. – коэффициент испарения спирта;
Х и Y– содержание спирта в жидкости и паре.
Коэффициент ректификации показывает, насколько больше или меньше в паре содержание примеси по отношению к этиловому спирту в сравнении с жидкостью. Коэффициенты испарения и ректификации примесей зависят от концентрации этилового спирта в водном растворе, из которого выделяются примеси.
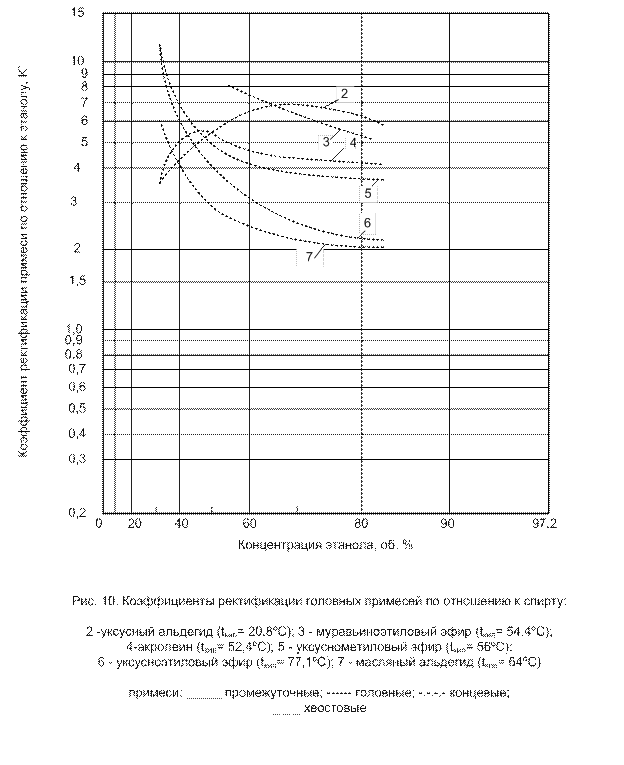
К головным примесям относят те, которые обладают большей летучестью, чем этиловый спирта при всех концентрациях его в растворе, т.е. они при любых условиях будут первыми выходить из смеси (рис. 5). Коэффициент ректификации всегда К' > 1.
Основными представителями головных примесей являются: уксусный и масляный альдегиды, акролеин, муравьино-этиловый, уксусно-метиловый, уксусно-этиловый, диэтиловый эфиры и др. (В смеси спирт-головная примесь добавление спирта всегда повышает температуру кипения смеси).
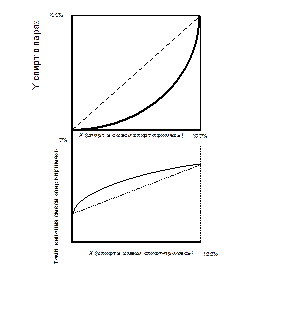
|
| Рис. 5. Головные примеси (более летучи, чем спирт) |
Летучесть хвостовых примесей всегда меньше летучести этилового спирта (К` < 1), поэтому хвостовые примеси в смеси со спиртоводным раствором могут всегда будут оставаться в кубе (рис. 6). Типичными хвостовыми примесями являются уксусная кислота, фурфурол и вода. (В смеси спирт-хвостовая примесь добавление спирта всегда уменьшает температуру кипения смеси).

|
| Рис. 6. Хвостовые примеси (менее летучи, чем спирт) |
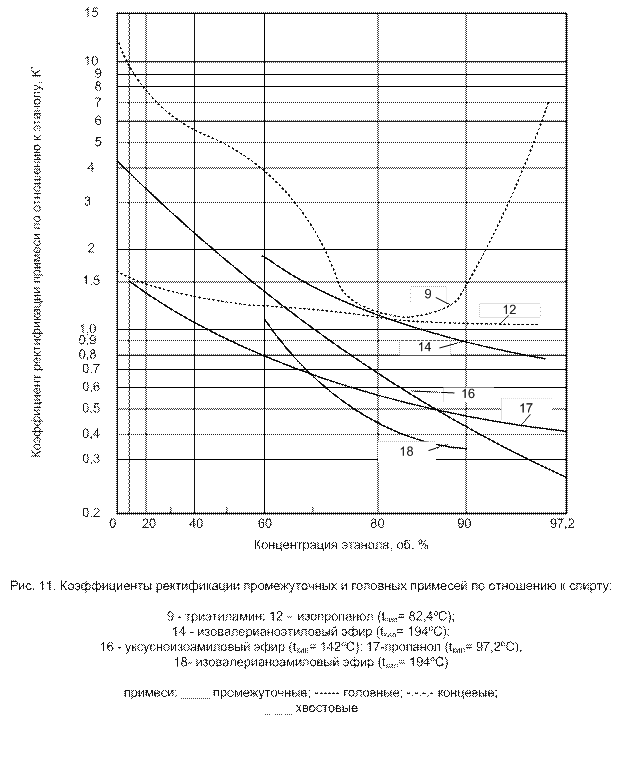
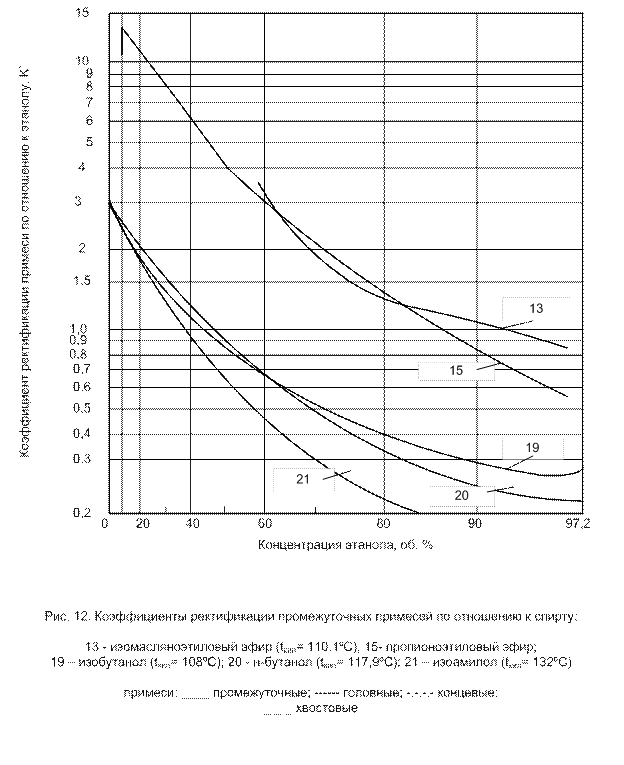
Промежуточные примеси обладают двоякими свойствами: при высоких концентрациях спирта они имеют характер хвостовых примесей (К'< 1); при низких концентрациях, напротив, – характер головных примесей (К' > 1). При определенной концентрации спирта, промежуточные примеси и этиловый спирт имеют одинаковую летучесть, т.е. имеет место состояние азеотропии (К' = 1) (рис. 7).
Основные представители промежуточных примесей – изоамиловый, изобутиловый, пропиловый спирты; изовалерианово-изоамиловый, уксусно-изоамиловый, изовалерианово-этиловый эфиры.
Промежуточные примеси, которые имеют точку азеотропии при концентрации этанола > 70 % об., условно называют верхними, при меньшей концентрации этанола – нижними промежуточными примесями, к верхним промежуточным примесям относят изовалерианово-этиловый, изомасляно-этиловый, изовалерианово-изоамиловый эфиры, изопропанол. К нижним промежуточным примесям относят все спирты сивушного масла (кроме изопропанола), изовалерианово-этиловый и уксусно-изоамиловый эфиры. (В смеси спирт-промежуточная примесь кривая температуры кипения имеет максимум).
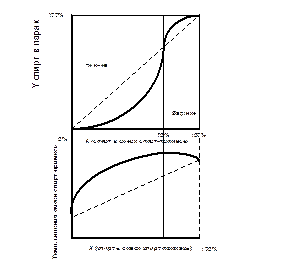
|
| Рис. 7. Промежуточные примеси (менее летучи, чем спирт при его высоких концентрациях) |
Для концевых примесей, как и для промежуточных, характерна неодинаковая летучесть в локальных условиях, однако в противоположность им концевые примеси обладают свойствами головных при высоких концентрациях спирта (К'> 1) и хвостовых при низких концентрациях (К' < 1) (рис. 8). Характерной концевой примесью является метиловый спирт.
(В смеси спирт-концевая примесь кривая температуры кипения имеет минимум).

|
| Рис. 8. Концевые примеси (более летучи, чем спирт при его высоких концентрациях) |
Знание характера распределения примесей и их коэффициентов ректификации дает возможность обоснованно подойти к созданию схем ректификационных установок.
Коэффициенты ректификации некоторых примесей по отношению к спирту представлены на рис. 9-12.
Из сказанного можно сделать вывод, что испарение спиртсодержащих примесей не является процессом подобным фильтрации, т.е. при температуре кипения в кубе 78,3°С испаряться будет только спирт. Речь должна идти о преимущественном испарении спирта, как имеющего молекулы с более высокой энергией, что позволят им легче покидать поверхность раздела фаз под действием броуновского движения.
Однако вместе со спиртом будут испаряться и молекулы воды с температурой кипения 100°С, и акролеин (52,4°С), и уксусноизоамиловый эфир (142°С). Их следы будут отмечаться на хроматограммах от начала перегонки до полного исчерпания летучих веществ, различаться будет только концентрация с учетом аналитических возможностей химических анализов.
Процесс кипения при дистилляции необходимо рассматривать как один из возможных, но не единственный, как будет показано далее, способ развертывания поверхности раздела жидкость-пар, а температуру - как универсальный, но также не единственный (перегонка под вакуумом при комнатных температурах), способ интенсификации броуновского движения. Следует также следить за состоянием пара, не допуская его полного насыщения, т.к. в этом случае движущая сила массопередачи становится равной нулю, что предотвращается постоянным отбором из аппарата образующейся паровой смеси.
Простая перегонка
Понятие дистилляция или простая перегонка означает процесс разделения взаиморастворимых жидкостей путем испарения жидкости и конденсации паров, обогащенных легколетучих компонентов. С физической точки зрения перегонка не обязательно является процессом разделения жидкостей. Например, перегонкой называют также процесс, в ходе которого жидкое вещество испаряют, образовавшиеся пары конденсируют с получением дистиллята (дистиллирование воды). В последнем случае от жидкости отделяют сухие, неиспаряющиеся вещества (соли, растворенные в неочищенной воде).
Главное условие устойчивой работы перегонного аппарата - кипение жидкости внутри для получения развернутой поверхности контакта фаз. Для подогрева используют:
поверхность теплообмена (иногда выносные кипятильники), нагреваемую электрическими устройствами (ТЭНами), перегретым водяным паром, газом - получение коньячных спиртов из бражек с малым содержанием сухих веществ (вина). Применение данного способа имеет ряд ограничений по подводимой мощности: пригорание нагреваемых веществ с образованием дурно пахнущих продуктов распада, "пленчатое" кипение (см. выше);
непосредственный ввод водяного пара внутрь аппарата ("острый" пар) через открытую трубу или более сложные устройства - барботеры, кольцевые или лучевые трубы с отверстиями для лучшего распределения пара по сечению аппарата. Последний способ рекомендуют для бражек с большим количеством сухих веществ и склонных к пригоранию - зерновых при производстве зернового спирта или виски. Недостаток - необходимость дополнительных устройств - парогенераторов, барботеров.
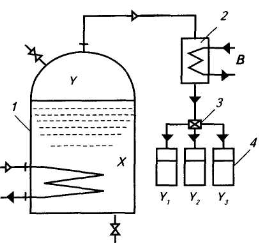
На рис. 13 представлена схема установки для проведения процесса перегонки; она состоит из куба 1, холодильника 2, делительного (сортировочного) крана 3 и сборников отгона (дистиллята) 4. При кипении в кубе жидкости с содержанием спирта, равным X, образуется пар с содержанием спирта, равным Y. Этот пар непрерывно отводится в холодильник, где конденсируется, образуя дистиллят (отгон).
|
| Рис 13. Схема установки для простой перегонки: 1 – перегонный куб; 2 – холодильник; 3 – делительный кран; 4 - сборники |
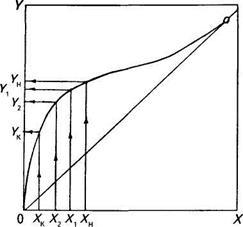
На основании материального баланса легко установить, что по мере испарения жидкости будут уменьшаться концентрация спирта в ней (т.к. Y>X) и его концентрация в парах, а, следовательно, и в дистилляте, что наглядно представлено на рис. 14.
|
| Рис. 14. Изменение концентрации спирта в кубовой жидкости и дистилляте по мере перегонки |
При частичном испарении кубовой жидкости будет получаться дистиллят, обогащенный спиртом, и остаток в кубе, обедненный спиртом, т.е. будет происходить частичное разделение летучей смеси на спирт и воду по сравнению с исходной смесью. Такой процесс разделения летучих смесей именуется простой перегонкой. Если испарить всю исходную смесь, то концентрация спирта в дистилляте будет равна концентрации в исходной смеси.
При проведении процесса простой перегонки наперед задаются концентрацией спирта в кубовом остатке или в дистилляте, и на оснований расчета материального баланса определяют долю частичного испарения, с учетом формы кривой фазового равновесия.
В практике часто осуществляют фракционную перегонку. При такой перегонке первые порции дистиллята будут иметь максимальную концентрацию спирта – около YH, а следующие – меньшую концентрацию, например Yx, Yr…, и далее концентрация дистиллята будет снижаться. Фракционная перегонка дает возможность получать дистиллят различной концентрации и собирать его в отдельные сборники с помощью распределительного крана 4 (рис. 13).
Так, например, при его концентрации в исходной смеси 8 % об. первые порции дистиллята будут иметь концентрацию спирта 49,6 % об. По мере перегонки и снижения концентрации спирта в кубовой жидкости до Хк = 1 % об. концентрация спирта в конечной порции дистиллята снизится примерно до 9 % об.
При содержании в бражке 10% об. спирта после нескольких перегонок получают следующую концентрацию спирта:
1-ая 32,7% об.;
2-ая 58,3% об.;
3-я 74,8% об.;
4-ая 83,2% об.;
5-фя 87,3% об.
Перегонка с дефлегмацией
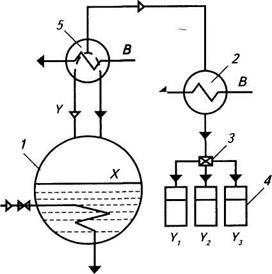
Простая перегонка дает возможность только частично разделить смесь летучих веществ и на практике простая перегонка используется только в лабораторных условиях. Для более полного разделения применяют перегонку с дефлегмацией. Суть ее состоит в том, что выходящий из куба пар (рис. 15) предварительно частично конденсируется в специальном теплообменнике – дефлегматоре 5 и полученный при этом конденсат (флегма[4]) возвращается в куб 1, а оставшаяся часть несконденсированного пара поступает в холодильник 2, где конденсируется, образуя дистиллят.
При частичной конденсации пара оставшаяся часть пара обогащается водой, концентрация спирта (Y`) в оставшейся части пара больше, чем его концентрация в исходном паре (Y). Например, при концентрации спирта в исходном паре Y= 42 % мас. при частичной конденсации пара образуется L = 0,5 кг флегмы с концентрацией около 17 % мас. и D = 0,5 дистиллята с концентрацией около 67 % мас., в то время как при простой перегонке концентрация спирта в дистилляте будет 42 % мас.
|
| Рис 15. Схема установки для перегонки с дефлегмацией: 1 – перегонный куб; 2 – холодильник; 3 – делительный кран; 4 – сборники; 5 - дефлегматор |
Таким образом, перегонка с дефлегмацией обеспечивает более глубокое разделение летучих смесей по сравнению с простой перегонкой, но все равно не позволяет получать чистые компоненты.
При перегонке с дефлегмацией отношение количества флегмы L (при температуре кипения) к количеству дистиллята D именуется флегмовым числом (или числом флегмы) R = L/D. Чем больше R, тем выше концентрация спирта в дистилляте, но при этом будет больше и расход энергии на перегонку. Флегмовое число выбирают по технико-экономическим соображениям в пределах 0<R<¥. При R=0, происходит простая перегонка – возврата флегмы нет, при R=¥ вся флегма конденсируется в дефлегматоре и возвращается в перегонный куб – разделение отсутствует.
Считается, что флегмовое число не должно быть менее 3.
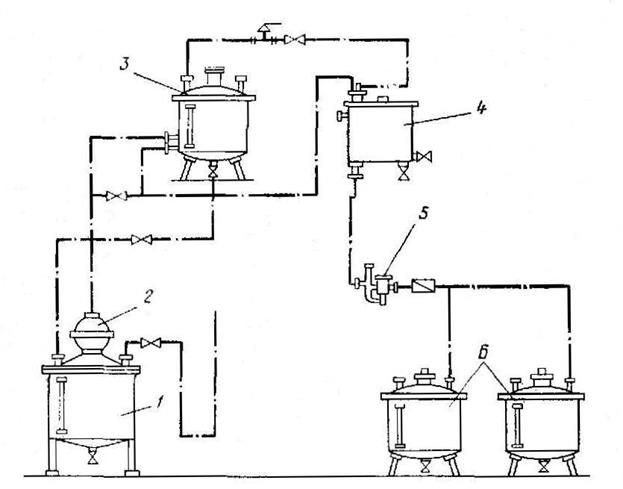
Перегонка с дефлегмацией используется в коньячном производстве при получении коньячных и плодовых спиртов с концентрацией 65-75 % об. из виноматериалов с содержанием спирта 9-11% об. (см. рис. 16).
|
| Рис. 16. Внешний вид установки двойной сгонки коньячного спирта УПКС: 1 - перегонный куб; 2 - шаровой дефлегматор; 3 - подогреватель вина; 4 - холодильник; спиртовый смотровой фонарь; 6 - сборники спирта |
Ректификация
Простая перегонка и перегонка с дефлегмацией – периодические процессы, проходящие в условиях стационарного массообмена, если пренебречь в силу небольшой скорости уменьшением содержания спирта в жидкости, пар над жидкостью в любой момент времени близок к состоянию насыщения, а движущая сила массообмена (в предельном случае - разница между прямой у=х и равновесным состоянием) создается за счет отбора пара и его дистилляцией.
Отличительная особенность ректификации в том, что поток жидкости (исходной бражки или специально сконденсированной флегмы) направляется навстречу восходящим потокам жидкости. Наиболее удобно это проводить в т.н. "колоннах", представляющих вертикальные аппараты с большим соотношением высота/диаметр и с установленными внутри контактными устройствами.
При ректификации процессы испарения и конденсации дополняются также массо- и теплообменом в специальных контактных устройствах (тарелках или насадках). При достаточно разумном оформлении последних устройств состояние кипения уже не является обязательным для испарения жидкости, оно вполне полноценно заменяется испарением через поверхность раздела фаз, хотя температуру внутри колонны выгодно поддерживать близкой к кипению для интенсификации испарения.
Дата добавления: 2019-02-08; просмотров: 2071;











