Вопрос 2: Роль металлов в современной технике.
Ответ. Роль металлов в современной технике очень велика. Они широко используются во многих областях народного хозяйства, в том числе в тяжёлой отрасли промышленности, станкостроение, в производстве машин и механизмов, в авиационной и автомобильной отраслях промышленности, в космической технике. Наиболее широкое применение имеют железо и алюминий.
Применение алюминия
1.При получение лёгких сплавов (дюралюминий- в авиа-и ракетостроении, в строительстве).
2. В металлургии: для восстановления металлов из их оксидов ( алюминотермия).
3. При изготовлении электрических проводов и кабелей ( легче, чем провода из меди).
4.В производстве бытовых предметов.
Применение железа
1.При изготовлении электромагнитов, трансформаторов, электромоторов, мембран микрофонов ( благодаря способности в быстрому намагничиванию и размагничиванию).
2.Основная масса железа используется в виде железоуглеродистых сплавов – чугуна и стали, широко используемых в промышленности.
Применение меди
1.При изготовлении электрических проводов и кабелей ( хороший проводник тока).
2. Как компонент сплавов ( латуней, бронзы и др.).
Применение цинка
1.Как антикоррозионное покрытие от электрохимической коррозии ( благодаря химической активности).
2. Получение технически важных ( высокопластичных) сплавов: с Cu ( латуни), с AI и Ni.
3.Производство гальванических элементов ( цинковоугольных).
Применение титана
1.При получении сплавов (титан и его сплавы обладают большой легкостью, прочностью , термической и коррозионной устойчивостью).
2.В авиа- и ракетостроении ,при строительстве подводных лодок.
3.В морском судостроении для изготовлении обшивки корпусов судов ,обладающих высокой прочностью и стойкостью в морской воде.
4.Как конструкционный материал при изготовлении оборудования для химической ,текстильной и бумажной отраслей промышленности.
Применение хрома
1.В производстве высококачественных твердых сталей (феррохром).
2.При изготовлении металлорежущих инструментов.
3.Как компонент нержавеющих сталей и сплавов.
4.Как антикоррозионное покрытие (хромирование стальных изделий для предотвращения коррозии).
Применение никеля
1.Как компонент легированных сталей ,а так же жаростойких ,сверхтвердых антикоррозионных и других сплавов.
2.Никелирование поверхностей предметов (от коррозии).
3.Как конструкционный материал при изготовлении химической аппаратурой и ядерных реакторов.
Вопрос 3.Сколько литров кислорода и воздуха нужно для полного сгорания 100 л смеси ,состоящий из 10 % метана , 20% пропана и 70% оксида углерода (II)?
Ответ.
Дано: Найти:
V(смеси)= 100 л, V (O2) = ?
ω (CH4 )= 10 %, V (возд.)= ?
ω (C3 H8)= 20%,
ω (CO) = 70%.
Решение
V (CH4) = 100 *10 /100 = 10 л,
V (C3 H8) =100*20/100= 20 л,
V (CO) = 100*70/100= 70 л.
10 л Х1 л
CH4 + 2O2 = CO2 ↑+2H2O.
V : 1 моль 2 моль
V: 22,4 л 44,8 л
20 л X2 л
C3H8 + 5O2= 3CO2↑+ 4H2O.
v: 1 моль 5 моль
V: 22,4л 112 л
70л x3 л
2CO + O2 =2CO2
v: 2 моль 1 моль
V: 44,8 л 22,4 л
X1 = V1 ( O2)= 10*44,8/22,4= 20 л,
X2 = V2 ( O2) = 20*112/22,4 = 100л,
X3= V3 (O2 ) = 70* 22,4/ 44,8 = 35 л,
Vобщ ( O2) = 20+100+35=155 л,
V( возд.) = 155*100/21=738 л ( в воздухе по объему содержится ̴ 21% кислорода).
Ответ: Vобщ ( O2)= 155 л, V( возд.) = 738 л.
Билет № 7
Вопрос 1.Этиленовые углеводороды. Их строение , свойства , получение и применение.
Ответ. Этиленовые углеводороды , или алкены , или олефины ,- органические вещества с общей формулой Cn H2n ,в молекулах которых содержится одна двойная связь между атомами углерода.
Представитель алкенов- этилен C2H4.
Графическая формула: СH2=CH2.
Номенклатура
1. Выбирают главную цепь- цепь, содержащую двойную связь.
2. Алкен называют, производя его название от названия алкана, соответствующего ему по числу атомов углерода, и изменяя окончание –ан алкана на –ен.
3. Нумеруют главную цепь с того конца, к которому ближе расположена двойная связь.
4. Цифрой указывают номер атома углерода, находящегося при двойной связи( наименьший из двух номеров, для пропена -1 два номера при двойной связи – это 1 и 2).
1 2 3
СH2=CH-CH3.
пропен-1
Изомерия
1. Структурная изомерия:
а) углеродного скелета ( начиная с бутена C4 и более);
б) положение двойной связи или функциональных групп.
2. Пространственная изомерия.
Физические свойства
Алкены C2-C4- газы, C5-C18- жидкости, C19 и более- твёрдые. Имеют низкие температуры кипения и плавления, в воде плохо растворимы, диэлектрики. Плотность меньше 1г/см3. Чем больше молекулярная масса алкен , тем выше его температура кипения.
Химические свойства
Активны из-за наличия непрочной 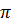 - связи( двойная связь алкена состоит из
- связи( двойная связь алкена состоит из 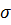 - связи и
- связи и 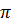 - связи).
- связи).
1. Окисление:
а) горение:
С2H4+3O2=2CO2↑+2H2O+Q;
б) окисление водным раствором KMnO4:
3СH2=CH2+2KMnO4+4H2O=3CH2OH-CH2OH+2MnO2↓+2KOH;
в) окисление органической надкислотой ( образование эпоксидов):
2СH2=CH2+O2 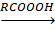 2CH2-CH3.
2CH2-CH3.
O
эпоксид
2. Присоединение:
а) водорода:
CH3-CH=CH2+H2 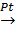 CH3-CH2-CH3;
CH3-CH2-CH3;
пропан
б) галогена:
CH3-CH=CH2+Br2=CH3-CHBr-CH2Br;
1,2-дибромпропан
в) галогеноводорода (по правилу Марковникова):
CH2=CH2+HBr=CH3-CH2Br;
бромэтан
г) воды:
CH2=CH2+H2O 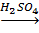 CH3-CH2-OH;
CH3-CH2-OH;
этиловый спирт
д) кислот:
CH3-CH=CH2+H2CO4 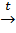 CH3-CH(HSO4)-CH3.
CH3-CH(HSO4)-CH3.
пропилсерная кислота
3. Полимеризация:
n(CH2=CH2) 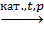 ( -CH2 –CH2 -)n.
( -CH2 –CH2 -)n.
Получение
1. Дегидрация спиртов (по правилу Зайцева):
C2H5OH 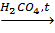 CH2=CH2↑+H2O.
CH2=CH2↑+H2O.
Правило Зайцева: при дегидратации спиртов водород отщепляется от наименее гидрогенизированного атома углерода.
2. Из галогенпроизводных алканов:
а) CH3-CH2-Cl+KOH=CH2=CH2↑+KCl+H2O;
спиртовой раствор
б) СН2Br-CH2Br+Zn=CH2=CH2↑+ZnBr2.
3. Дегидрирование алканов:
CH3-CH3 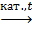 CH2=CH2↑+H2.
CH2=CH2↑+H2.
4. Из газов крекинга нефти
C4H10 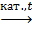 C2H4+C2H6.
C2H4+C2H6.
алкен
5. Крекинг жидких нефтепродуктов:
C16H34 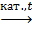 C8H16 + C8H18.
C8H16 + C8H18.
алкен
C8H16 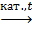 C4H8 + C4H10.
C4H8 + C4H10.
алкен
Применение
1. Как основные исходные реагенты при синтезе многих органических соединений.
2. В производстве синтетических каучуков.
3. В производстве пластмасс (полиэтилен), полимеров и эластомеров.
4. Как присадки к маслам и герметики.
5. В производстве антифризов.
Вопрос 2.Окислительно-восстановительные реакции.
Ответ. Окислительно - восстановительные реакции – реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ. При этом происходит смещение валентных (связывающих) электронов от атомов с меньшей электроотрицательностью к атомам с большей электроотрицательностью.
0 +5 +2 +4
Cu + 4HNO3 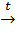 Cu(NO3)2 + 2NO2
Cu(NO3)2 + 2NO2 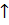 + 2H2O.
+ 2H2O.
Если атом, ион или молекула в процессе реакции оттягивает на себя дополнительную электронную плотность( присоединение электронов), то этот атом, ион или молекула называется окислителем, а сам процесс присоединение электронов – восстановлением.
В нашем случае: +5 +4
N+1e= N,
то есть происходит процесс восстановления.
Если атом, ион или молекула в процессе реакции отдает электроны другим частицам, то этот атом, ион или молекула называется восстановителем, а сам процесс отдачи электронов – окислением.
0 +2
Cu- 2e = Cu – этот процесс окисления.
В окислительно – восстановительной реакции число электронов, полученных окислителем, равно числу электронов, отданных восстановителем.
Таким образом, в процессе реакции будет соблюдаться электронный баланс.
Алгоритм для составления уравнения окислительно – восстановительной реакции по методу электронного баланса
1. Написать схему реакции.
2. Расставить степени окисления всех элементов во всех веществах.
3. Определить, какой элемент является восстановителем, а какой – окислителем.
4. Написать электронные уравнения полуреакций окисления и восстановления.
5. Найти наименьшее общее кратное для числа принятных и отданных электронов.
6. Найти коэффициенты в каждом электронном уравнении.
7. Поставить найденные коэффициенты (с учетом количества атомов в молекуле) в исходную схему реакции.
8. Проверить количества атомов в исходных веществах и продуктах реакции.
Вопрос 3.Провести реакции, подтверждающие качественный состав NH4Cl.
Ответ.Определение иона хлора:
AgNO3+NH4Cl=AgCl↓+ NH4NO3
AgCl-белый творожистый осадок, нерастворимый
в кислотах и щелочах.
Определения катиона аммония:
а)возгонка:
NH4Cl=NH3↑+HCl;
газ с резким запахом
б)взаимодействие со щелочью :
NH4Cl +NaOH=NH3↑+NaCl + H2O
Билет № 8
Вопрос 1.Бензол .Его строение, свойства , получение и применение .
Ответ.Бензол- простейший представитель класса ароматических углеводородов (аренов).
Арены – сложные органические вещества ,в молекулах которые есть бензольное кольцо (ядро).
В молекуле бензола все связи между атомами углерода равноценны , это полуторные связи.
Физические свойства
Бесцветная жидкость с характерным запахом , в воде не растворяется , легче воды ,температура кипения
80 0С,температура плавления 5,5 0С, хороший растворитель, ядовит .
Химические свойства
1.Горение ( сильный коптящее пламя):
2C6H6 + 15O2=12CO2↑ + 6H2O.
Сходство с предельными углеводородами
2.Устойчив к действию окислителей, в обычных условиях не обесцвечивает раствор перманганта калия и бромную воду, не присоединяет галогеноводороды и воду.
3.Замещение атомов водорода протекает легче, чем у алканов:
а) нитрование:
C6H6 + HNO3=C6H5NO2 + H2O;
нитробензол
б)галогенирование:
C6H6 + Br2=C6H5Br + HBr;
бромбензол
в)алкилирование:
C6H6 + C2H5CI 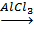 C6H5C2H5 + H6CI.
C6H5C2H5 + H6CI.
этилбензол
Сходства с непредельными углеводородами
4.Присоединение по углеродным связям протекает с большим трудом, так как ароматическая система устойчива:
а) гидрирование ( П. Сабатье и Ж.Б.Сандеран,1900 г.
C6H6 + 3H2 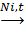 C6H12;
C6H12;
циклогексан
б) галогенирование:
C6H6 + 3CI2 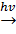 C6H6CI6.
C6H6CI6.
гексахлор-циклогексан
Получение
1.Дегидрирование циклопарафинов ( Зелинский, 1912 г.):
C6H12 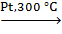 C6H6 + 3H2.
C6H6 + 3H2.
2.Дегидрирование алканов:
C6H14 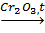 C6H6 + 4H2.
C6H6 + 4H2.
3.Тримеризация ацетилена:
актив. уголь
3C2H2 C6H6.
600 °С
Применение
1.Как исходный реагент при синтезе многих органических соединений(фенол,циклогексан,анилин и др.)
2.В производстве красителей (анилиновых и др.)
3.В производстве пестицидов и полимеров.
4.В синтезе фармацевтических препаратов.
5.При изготовлении взрывчатых веществ.
6.Как растворитель лаков.
7.Как добавка к моторному топливу (для повышения октанового числа).
8.Для получения душистых веществ.
9.При изготовлении капрона и фенолформальдегидных смол.
Вопрос 2. Изомерия органических соединений. Ее виды.
Ответ.Изомерия – существование соединений, имеющих одинаковый состав и одинаковую молекулярную массу, но различное строение молекул. Такие соединения, обладающие различными физическими и химическими свойствами, называют изомерами.
1.Структурная изомерия – результат различий в химическом строении.
а) Изомерия углеродного скелета обусловлена различным порядком соединения атомов углерода в молекуле. Изомеры могут принадлежать одному классу соединений:
CH3-CH2-CH2-CH3,
н-бутан
tкип = -0,5 0C, tпл = -138,4 0C
CH3-CH(CH3)-CH3 ;
изо-бутан
tкип = -11,70C, tпл = -159,4 0C
и к разным классам:
CH≡C-CH2-CH3, CH2=CH-CH=CH2.
б)Изомерия положения обусловлена различным положением функциональных групп или кратных связей при одинаковом углеродном скелете:
CH2=CH-CH2-CH3, CH3-CH=CH-CH3
бутен-1 бутен-2
2.Пространственная изомерия – явление существования молекул с одинаковой последовательностью и одинаковым типом химических связей, но с их различным пространственным расположением.
а)Геометрическая изомерия (цис-,трансизомерия). Наблюдается у соединений с двойной связью и у малых циклов. В случае соединений с двойной связью два одинаковых заместителя, связаны с различными атомами углерода ,в цисизомерах расположены по одну сторону плоскости связи C=C, а в трансизомерах- по разные стороны:
CH3 CH3 CH3 H
\ / \ /
C=C С=С
/ \ / \
H H H CH3
цис-бутен – 2 транс-бутен -2
В случае малых циклов цис- и трансизомеры различаются взаимным расположением заместителей по отношению к плоскости цикла:
R1 R1 R1 R2
R2 R2 R2 R1
цисизомер трансизомер
б)Оптическая изометрия(энантиометрия,зеркальная изометрия ). Проявляется в способности некоторых соединений вращать плоскость поляризованного света в противоположные стороны. Это следствие хиральности молекул(несовместимость объекта с его отображением в идеальном плоском зеркале).
При наличии в молекуле асимметрического атома углерода (атом с четырьмя различными заместителями)молекула может существовать в виде двух изомеров(энантиомеры),относящихся друг к другу как несимметричныйпредмет и его зеркальное отображение.
H H
CI-C-I, I-C-CI.
Br Br
Вопрос 3.В трёх пробирках находятся вещества: KNO3, NaCl, Na2SO4. С помощью реакций определите каждое из веществ.
Ответ:
KNO3:
t
2KNO3+2H2SO4+Cu=2NO2 + CuSO4+K2SO4+2H2O,
(бурый газ)
t
2KNO3=2KNO2+O2 ;
NaCl:
AgNO3+NaCl=AgCl +NaNO3;
(белый творожистый осадок)
Na2SO4:
Ba2++SO42- = BaSO4 .
(белый осадок)
Билет № 9
Вопрос 1.Амины. Их строение и свойства. Получение анилина и применение.
Ответ.Амины-производные аммиака, в молекуле которого атомы водорода (частично или полностью) замещены углеводородными радикалами.
В зависимости от числа радикалов различают амины первичные (с одним радикалом), вторичные ( с двумя) и третичные (с тремя).
R-N-H, R1-N-R2, R1-N-R2,
│ │ │
H H R3
первичный амин вторичный амин третичный амин
Названия аминов производят от названия радикалов, входящих в их молекулы, добавляя окончание –амин:
CH3NH2, CH3-NH-CH3,
метиламин диметиламин
CH3-CH2-N-CH2-CH2-CH3.
│
CH3
метилэтилпропиламин
Физические свойства
Простейшие амины – газы, имеющие запах аммиака. Средние амины – жидкости со слабым запахом рыбы, хорошо растворимые в воде. Высшие амины – твёрдые вещества без запаха. В воде нерастворимы.
Химические свойства
Свойства, сходные со свойствами аммиака
Сходства свойств аминов и аммиака объясняется их электронным строением. Молекулы аммиака и аминов содержат атомы азота, имеющий свободную не поделенную пару электронов (точками указаны электроны атома азота):
H H H R
x • x • x • x •
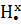
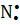 ,
, 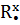
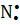 ,
, 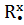
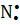 ,
, 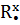
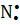 .
.
x • x• x• x•
H H R R
а) Взаимодействие с водой (образуется основание, раствор имеет щелочную реакцию):
CH3NH2 + HOH = [CH3NH3]+OH- .
гидроксид метиламмония
( слабое основание)
б) Взаимодействие с кислотами ( амины обладают основными свойствами: они присоединяют протон H+):
CH3NH2 + HCI = [ CH3NH3]CI.
хлорид метиламмония
Особые свойства:
1.Окисление ( горение на воздухе):
4CH3NH2 + 9O2 = 4CO2↑+ 2N2↑ + 10H2O.
2.Бромирование:
C6H5NH2 + 3Br2 = C6H2Br3NH2↓ + 3HBr.
2,4,6 - триброманилин
3.Присоединение алкилгалогенидов:
C6H5NH2 + C2H5CI = [C6H5NH2C2H5]+CI-.
Получение анилина
Получение анилина C6H5NH2 – восстановление нитросоединения до амина ( реакция Зинина,1842 г.):
C6H5NH2 + 3(NH4)2S = C6H5NH2 + 3S+ 6NH3+ 2H2O.
Современный метод:
Fe + 2HCI = FeCI2 + 2H,
атомарный
водород
C6H5NO2 + 6H = C6H5NH2 + 2H2O.
Наиболее перспективен контактный способ - пропускание смеси паров нитробензола и водорода над катализатором:
кат.
C6H5NO2 + 3H2 ═ C6H5NH2 + 2H2O.
300 °C
Восстановители: (NH4)2 S,H2, Fe (в виде чугунных стружек) в присутствии HCI.
Применение анилина:
1.Как сырье в производстве анилиновых красителей.
2.В фармацевтической отрасли промышленности ( для получения сульфаниламидных препаратов).
3.В производстве анилинформальдегидных смол.
4. В производстве взрывчатых веществ.
Вопрос 2. Генетическая связь между неорганическими и органическими веществами.
Ответ.
1. Получение (COOH)2 ( Ф.Вёлер, 1824 г.):
t
2C + N2 = C2N2,
дициан
C2N2 + 4H2O=(COONH4)2,
оксалат аммония
(COONH4)2 + H2SO4=(COOH)2 + (NH4)2SO4.
2.Синтез мочевины:
а) (CN)2 + 2NH3 + H2O = CO(NH2)2 + NH4 CN (Вёлер,1824 г.);
t
б)2C + N2 = C2N2,
C2N2 + H2 = 2HCN,
синильная кислота
HCN + NH3 = NH4 CN,
цианид аммония
2NH4CN + O2 = 2NH4CNO,
цианат аммония
NH4 –O-C≡N 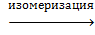 NH2 –CO-NH2(Вёлер,1828 г.).
NH2 –CO-NH2(Вёлер,1828 г.).
В результате этих синтезов ученые пришли к важному выводу о том, что органические вещества могут образовываться из неорганических. Таким образом была доказана связь между этими веществами.
Вопрос 3. Получить AI(OH)3 и выполнить реакции, характеризующие его свойства.
Ответ.
Получение
AICI3 + 3 KOH = AI(OH)3↓ + 3KCI,
AI3+ + 3OH- =AI(OH)3↓.
Свойства
AI (OH)3 – амфотерный гидроксид:
а) свойство основания:
AI(OH)3 + 3HCI = AICI3 + 3H2O;
хлорид
алюминия
б)свойство кислоты:
AI(OH)3 + NaOH + 2H2O = [AI(OH)4(H2O)2]Na.
алюминий натрия
БИЛЕТ №10
Вопрос 1. Карбоновые кислоты. Их строение, свойства, получения и применение.
Ответ. Карбоновые кислоты- органические соединения, в молекулах которых содержаться одна или несколько карбоксильных групп (СООН),
соединенных углеводородным радикалом ( или атомом водорода).
Гомология
Общая формула: CnH2n+1 COOH, или R-COOH (у первого гомолога вместо R- атом водорода).
Номенклатура
Название кислот производят от названий соответствующих углеводородов с прибавлением окончания «-овая» и слово «кислота».
Например:
СН4 - HCOOH,
метан метановая( муравьиная) кислота
С2H6 - CH3COOH,
этан этановая (уксусная) кислота
С3H8 - CH3CH2COOH.
пропан пропановая( пропионовая) кислота
Изомерия
а) Изомерия углеродного скелета (С 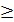 4) :
4) :
СH3-CH2-CH2-COOH,
бутановая (масленая) кислота
CH3-CH(CH3)-COOH.
2-метилпропановая (изомасляная) кислота
б) Межклассовая изомерия :
CH3CH2COOH,
пропановая кислота
CH3COOCH3.
метиловый эфир уксусный кислоты (метилацетат)
Физические свойства
Карбоновые кислоты с С1 по С8 – бесцветные жидкости с резким запахом, более С9 – твердые; с С1 по С3 – хорошо растворимы в воде, с С3 по С8 – малорастворимые, более С9 – нерастворимые. Все карбоновые кислоты – слабые электролиты.
Химические свойства
Многие свойства карбоновых кислот обусловлены наличием в их молекулах карбоксильных групп. В карбоксильной группе атом кислорода, связанный с атомом углерода двойной связью, оттягивает электроны на себя. При этом атом углерода приобретает положительный заряд и притягивает электроны второго атома кислорода ( из группы ОН). Это приводит к сдвигу электронного облака связи О-Н в направлении атома кислорода, так что атом водорода становится подвижным и реакционноспособным.
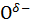

О-Н
В результате взаимного влияния атомов связь О-Н в карбоновых кислотах менее прочная, чем в спиртах.
Карбоновые кислоты обладают высокими температурами кипения, что связанно с образованием водородных связей между молекулами:
••• О=С- ОН•••О=С-ОН•••О=С-ОН•••
R R R
Свойства минеральных кислот
1. Диссоциация в водном растворе:
CH3COOH=H++ CH3COO- .
2. Взаимодействие с металлами, основными оксидами, основаниями, солями:
CH3COOH+K( K2O, KOH,K2CO3)→
→CH3COOK+H2( H2O, H2O, H2O+CO2).
Свойства органических кислот
3. Этерификация :
CH3COOH+CH3OH 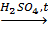 CH3COOCH3+H2O.
CH3COOCH3+H2O.
метиловый эфир уксусной кислоты
4. Образование ангидридов кислот :
R-COOH+HOOC-R 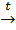 R-COOOC-R+H2O.
R-COOOC-R+H2O.
ангидрид
5. Галогенирование :
CH3COOH+Cl2=CH2(Cl)COOH + HCl.
монохлоруксусная кислота
Атомы водорода в молекулах карбоновых кислот, стоящие при атоме углерода, соседнем с карбоксильной группой, легко замещаются на атомы хлора или брома, т.к. их подвижность увеличивается под влиянием карбоксильной группы.
6. Реакция серебряного зеркала :
HCOOH+Ag2O=CO2↑+H2O+2Ag↓.
Реакция идет только с HCOOH,так как только в ее молекуле присутствует альдегидная группа.
О
-С
Н.
7. Разложение:
HCOOH 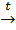 CO↑+H2O.
CO↑+H2O.
H2SO4
Получение
1. Из соли:
2CH3COONa+H2SO4=2CH3COOH+Na2SO4.
2. Окисление алкана:
2СH4+3O2=2HCOOH+2H2O.
3. Окисление спирта:
R-CH2OH+O2=R-COOH+H2O.
4. Окисление альдегида:
R-CHO+[O]=R-COOH
альдегид окислитель
5. Из оксида углерода( II) и гидроксида натрия:
CO+NaOH 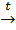 HCOONa,
HCOONa,
p формиат натрия
2HCOONa+H2SO4=2HCOOH+Na2SO4.
6. Из спирта и оксида углерода( II) :
СH3OH+CO 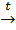 CH3COOH.
CH3COOH.
p
7. Гидролиз нитрилов:
CH3C≡N+2H2O=CH3COOH+NH3.
Применение
1. HCOOH – в синтезе органических веществ ( как восстановитель), в пищевой отрасли промышленности (как антисептик и консервант), в текстильной отрасли промышленности (при крашении тканей), в медицине (как средстве для растирания).
2. CH3COOH – для получения пластмасс, красителей, лекарственных веществ, искусственного волокна (ацетатный шелк), невоспламеняющейся кинопленки. Ее соли – гербициды. Ее сложные эфиры используются в парфюмерии и медицинской отрасли промышленности.
3. C15H31COOH и C17H35COOH – для получения мыл.
Вопрос 2. Сравнительная характеристика окислительных и восстановительных свойств неметаллов.
Ответ.Неметаллы располагаются в основном в конце малых и больших периодов (в правом верхнем углу периодической таблицы), а число внешних электронов у их атомов равно номерам их групп.
Для завершения своих внешних электронных уровней атомы неметаллов присоединяют электроны и являются окислителями. Таким образом, у неметаллов преобладают окислительные свойства. Особенно сильные окислительные свойства(т.е. электроотрицательность – способность притягивать к себе электроны)проявляют неметаллы 2-го и 3-го периодов VI и VII групп.
Окислительная способность неметаллов увеличивается в следующем порядке:
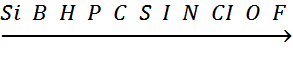
Самый сильный окислитель – фтор, менее энергично взаимодействует с веществами кислород.
Фтор - самый типичный неметалл, для которого нехарактерны восстановительные свойства. Кислород же, судя по его соединениям со фтором (OF2, O2F2),может иметь положительную степень окисления, то есть может быть восстановителем.
Восстановительные свойства неметаллов постепенно возрастают от кислорода к кремнию в порядке, обратном проявлению окислительных свойств:
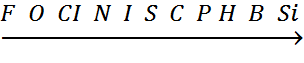
Косвенным путем можно получить оксиды хлора:
+1 +4 +7
CI2O, CIO2, CI2O7
Азот также является восстановителем:
t
N2 + O2 = 2NO↑.
восстановитель окислитель
Сера проявляет и восстановительные, и окислительные свойства:
t +4 t -2
S + O2 = SO2↑, H2 + S = H2S↑.
Вопрос 3. Даны KCI, NH4 CI, K2CO3. Распознайте соли с помощью индикаторов и объясните результаты исследований.
Ответ.В водной среде происходит гидролиз солей. Гидролиз – химическая реакция ионного обмена между водой и растворенным в ней веществом. Гидролиз солей всегда происходит с тех случаях, когда ионы, образующиеся в результате диссоциации, способны давать с водой слабые (малодиссоциированные ) электролиты.
1.Хлорид калия KCI образован катионом сильного основания KOH и анионом сильной кислоты HCI. Ионы таких солей не могут давать с водой слабых электролитов. Поэтому соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются. Их растворы имеют нейтральную реакцию.
2.Хлорид аммония NH4CI образован катионом слабого основания NH4OH и анионом сильной кислоты HCI.
Уравнение гидролиза:
NH4CI + H2O = NH4OH + HCI.
В результате гидролиза образуется слабый электролит NH4OH, при этом часть ионов OH- связывается ионами NH4+, а ионы H+ остаются в избытке.
Таким образом, [H+]>[OH-], и реакция раствора соли кислая. Лакмус – красный.
3.Карбонат калия K2CO3 образован катионом сильного основания KOH и анионом слабой кислоты H2CO3.
Уравнение гидролиза:
K2CO3 + H2O = KHCO3 + KOH.
В этом случае степень диссоциации KOH выше, чем степень диссоциации KHCO3. Поэтому в растворе соли преобладают ионы OH-.
Таким образом, [Н+]<[ОН-], и реакция раствора соли щёлочная. Фенолфталеин- малиновый.
Билет №11
Вопрос 1. Жиры. Их строение, свойства и способы технической переработки.
Ответ.Жиры- сложные эфиры, образованные карбоновыми кислотами и глицерином.
Французский учёный М. Э. Шеврель в начале ХIХ в. установил формулу жиров.
СН2(ОН)-СН(ОН)-СН2(ОН),
глицерин ( пропантриол-1,2,3)
С15Н31СООН,
пальмитиновая кислота (предельная)
С17Н35СООН,
стеариновая кислота (предельная)
С17Н33СООН,
олеиновая кислота
(непредельные, с одной двойной связью)
С17Н29СООН.
линолевая кислота
(непредельная, с двумя двойными связями)
Общая формула жиров:
СН2(ОСО-R)-СН(ОСО-R)-СН2(ОСО-R),
где R- радикал кислоты ( углеводородный).
Твёрдые жиры- говяжий, бараний и др. (кроме рыбьего жира)- состоят из триглицеридов предельных ( твёрдых) кислот ( пальмитиновой, стеариновой).
Жидкие жиры- подсолнечное масло и др. (кроме кокосового масла)- состоят из триглицеридов непредельных (жидких) кислот (олеиновой, линолевой).
Физические свойства
Агрегатное состояние- жидкое или твёрдое, легче воды, в воде нерастворимы, но хорошо растворяются в органических растворителях (бензин и пр.)
Химические свойства
1. Щёлочный гидролиз:
СН2(ОСОС17Н35)- СН(ОСОС17Н35)-СН2(ОСОС17Н35)+ 3NaОН =
= CH2(OH)-CH(OH)-CH2(OH) + 3C17H35COONa.
теарат натрия
(мыло)
2.Гидрирование:
CH2 (OCOC17H33)-CH(OCOC17H33)-CH2(OCOC17H33) + 3H2 =
триглицерид олеиновой кислоты
= CH2 (OCOC17H35) – CH(OCOC17H35)- CH2(OCOC17H35).
триглицерид стеариновой кислоты
Получение
CH2(OH)-CH(OH)-CH2(OH) + 3RCOOH =
= CH2(OCO-R)-CH(OCO-R)-CH2(OCO-R) + 3H2O.
Применение
1.В производстве мыл и синтетических моющих средств.
2.В производстве маргарина ( гидрирование), глицерина, жирных кислот. Жиры выполняют множество функций в живых организмах ( энергетическая, теплоизоляционная, механическая и др.), хорошо усваиваются организмом, высококалорийны.
Вопрос 2.Взаимное влияние атомов в молекулах органических веществ.
Ответ. Рассмотрим вещества, молекулы которых содержат бензольное кольцо.
1.Производные бензолы:
C6H5OH, C6H5NH2, C6H5CH3.
фенол анилин толуол
Эти вещества легко вступают в реакции замещения.
В молекуле фенола имеет место взаимное влияние гидроксильной группы ( OH) и бензольного ядра:
а) π-Электроны бензольного ядра частично вовлекают в свою сферу неподеленные электронные пары атома кислорода гидроксильной группы, в результате чего электронная плотность у атома кислорода уменьшается. Это вызывает смещение электронной плотности связи O-H от водорода к кислороду, водород становится подвижным и реакционноспособным. Поэтому фенол проявляет свойства слабой кислоты.
б) Гидроксильная группа в свою очередь оказывает влияние на бензольное кольцо, в результате чего водородные атомы бензольного кольца в положениях 2,4 и 6 становятся более подвижными и легко замещаются на другие атомы или радикалы.
3 2
4 1 O H
5 6
Например, фенол без нагревания и катализаторов взаимодействуют с бромом или азотной кислотой, образуя 2,4,6 –трёх-замещённые производные:
C6H5OH + 3NHO3 = C6H2(NO2)3OH + 3H2O.
2,4,6-тринитрофенол
Группы OH, NH2,CH3 (и другие алкилы) подают электроны в бензольное кольцо и облегчают замещение ( вступление нового заместителя) в молекуле. Это электронодороные заместители. Наличие таких групп в феноле C6H5OH,анилине C6H5NH2 и толуоле C6H5CH3 делает это соединения более активными, чем бензол.
Существуют также заместители, способные оттягивать на себя электронную плотность бензольного кольца. Это электроноакцепторные заместители. К ним относятся группы: NO2, COOH,CHO, COR. Эти заместители затрудняют вступление нового заместителя в молекулу. Поэтому, например, реакции замещения нитробензола C6H5NO2 и бензойной кислоты протекают труднее, чем реакции замещения бензола.
2.Галогенопроизводные карбоновых кислот, например монохлоруксусная кислота CH2(CI)COOH.
В молекуле монохлоруксусной кислоты электронная плотность смещена в сторону атома хлора, вследствие чего атом водорода карбоксильной группы становится более подвижным, чем в уксусной кислоте. Поэтому CH2CICOOH обладает более сильными кислотными свойствами, чем СH3COOH.
3.Галогеналканы, например хлорметан СH3CI.
В молекуле хлорметана хлор, обладая большей, чем у углерода, электроотрицательностью, оттягивают на с
Дата добавления: 2016-07-18; просмотров: 9730;











