Вопрос 2. Обратимость химической реакции. Химическое равновесие. Условия его смещения.
Ответ. Необратимая реакции - реакции, идущие в одном направлении и до конца , то есть до полного израсходования одного из реагирующих веществ.
При протекании необратимых реакций образуется газ, осадок нерастворимого вещества или малодиссоциированное соединение (например, вода):
CaCO3 + HCl = CaCl + H2O + CO2↑,
AlCl3 + 3AgNO3 = 3AgCl (осадок)↓ + Al(NO3)3,
HCl + NaOH = NaCl + H2O.
Обратимые реакции - химические реакции. Одновременно протекающие в двух взаимно противоположных направлениях. Образующиеся в ходе реакции продукты снова вступают друг с другом в реакцию, продуктами которой являются исходные вещества первой реакции:
CH3OOH + C2H5OH CH3COOC2H5 + H2O,
N2 + 3H2 2NH3 + Q
Если скорость прямой и обратной реакции оказывается равными, то о системе говорят, что она находится в состоянии химического равновесия.
К системе, находящейся в состоянии равновесия, применим принцип А. Ле Шателье (принцип подвижного равновесия): если к системе, находящейся в состоянии равновесия, приложено внешнее воздействие (изменяются концентрация, температура, давление), то система реагирует таким образом, чтобы уменьшить это воздействие.
1. Если удаляется продукт реакции, положение равновесия системы сдвигается вправо, частично компенсируя уменьшение концентрации продукта.
2. Если добавляется реагент, положение равновесия системы также смещается вправо, что ускоряет расходование реагента.
3. Если систему нагреть, это приведет к смещению ее положения равновесия в сторону протекания эндотермической реакции, способной поглотить часть поступающего в систему тепла.
Эндотермическая реакция – реакция, идущая с поглощением тепла. Экзотермическая реакция – реакция, идущая с выделением тепла.
Реакция
CO2 + C = 2CO↑ - Q
эндотермическая, поэтому при повышении температуры равновесие сместиться вправо (в сторону образования продукта).
4. При увеличении давления в газовой системе ее положение равновесия будет смещаться в сторону образования меньшего числа молекул газа, уменьшая тем самым давление в системе
N2 + 3H2 2NH3↑
В приведенную реакцию вступают четыре молекулы азота и водорода, а образуются только две молекулы аммиака. Следовательно, при повышении давления положение равновесия сместиться вправо (в сторону образования аммиака), так как объем продукта в 2 раза меньше объемов реагентов.
5. При добавлении катализаторов или ингибиторов равновесие не смещается; они только ускоряют наступление равновесия или замедляют его.
Вопрос 3. На 200г 10-% серной кислоты подействовали 24г Mg. Сколько литров водорода при этом выделяется, если выход реакции 90%?
Ответ.
Дано:
m (H2SO4) = 200г, Найти:
ω (H2SO4) = 10%, V (H2) = ?
m (Mg) = 24г
Решение
m (H2SO4) = 200 *10/100 = 20г
20г (x1 г) 24г x2 л
H2SO4 + Mg = Mg SO4 + Н2↑.
v: 1 моль 1 моль 1 моль
M: 98 г/моль 24 г/моль –
Vм: - - 22,4 л/моль
X1= 24(г) * 98(г/моль)/24(г/моль)=98 г, значит, H2SO4 содержится в недостатке.
X2= V(H2) = 22,4 * 20/98=4,57 л.
Vпракт. (H2) 4,57* 0,9= 4,11 л.
Ответ: V(H2) = 4,11 л.
Билет № 6
Вопрос 1: Предельные углеводороды. Их строение и свойства. Основные направления промышленного использования метана.
Ответ. Предельные (ненасыщенные) углеводороды, или алканы,- органические вещества с общей формулой CnH2n+2, в молекулах которых атомы углерода соединены между собой одинарной связью ( 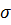 – связь), а все остальные валентности насыщены атомами водорода.
– связь), а все остальные валентности насыщены атомами водорода.
Представители алканов - этан C2H6.
Молекулярная формула: C2H6.
Графическая формула:CH3-CH3.
Номенклатура
Построение названий алканов с разветвленной цепью.
1. Выбирают самую длинную цепочку атомов углерода.
2. Номеруют ее с того конца, к которому ближе стоит углеводородный радикал.
3. Цифрами указывают номера углеродных атомов, с которыми связаны радикалы. А приставками («ди-», «три-» и т.д.)-количество радикалов.
4. К названиям радикалов приписывают названия алкана. Которому соответствует длинная цепочка атомов углерода.
Пример:
1 2 3 4 5
CH3-CH-CH-CH2-CH3.
│ │
CH3CH3
2,3-диметилпентан
Изомерия углеродного скелета
CH3-CH2-CH2-CH2-CH3,
бутан
CH3-CH(CH3)-CH3, С4H10 – брутто- формула.
2-метилпропан
Физические свойства
C1- C4- газы, C5- C16- жидкости, C17 и более- твердые вещества, в воде нерастворимы, могут растворяться в органических растворителях. Температура кипения неразветвленных алканов выше, чем у разветвленных. Температура кипения тем выше, чем больше масса молекулы.
Химические свойства
1. Окисление:
а) горение:
CH4+2O2=CO2 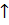 +2H2O+Q;
+2H2O+Q;
б) каталитическое окисление:
CH4+O2 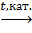 CH2O+ H2O.
CH2O+ H2O.
формальдегид
2. Дегидрирование:
а) крекинг:
2CH4 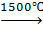 C2H2↑ + 3H2↑;
C2H2↑ + 3H2↑;
б) разложение:
CH4 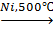 С+ 2H2↑.
С+ 2H2↑.
3. Изомеризация:
CH3-CH2-CH2-CH2-CH3 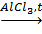 CH3-CH(CH3)CH2-CH3.
CH3-CH(CH3)CH2-CH3.
n- пентан 2- метилбутан
4. Замещение:
а) нитрование( реакция Коновалова):
CH4+HNO3 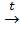 CH3NO2+H2O.
CH3NO2+H2O.
нитрометан
б) замещение галогенами (происходит по свободнорадикальному механизму):
CH4+Cl2 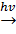 CH3Cl↑+HCl↑.
CH3Cl↑+HCl↑.
монохлорметан
Под действием света молекула хлора распадается на два радикала Cl:
Сl2 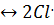 .
.
Реакционная способность этих радикалов обусловлена наличием у них неспаренного электрона, т.е. ненасыщенной валентности. Один радикал 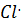 Взаимодействует с молекулой углеводорода, отрывая от неё
Взаимодействует с молекулой углеводорода, отрывая от неё 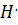 . При этом образуются химически активная частица- радикал
. При этом образуются химически активная частица- радикал 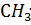 – и HCl:
– и HCl:
CH4+ 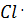 →
→ 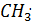 + HCl.
+ HCl.
Радикал 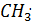 далее взаимодействует с новой молекулой Cl2 , образуя галогенно производное и радикал
далее взаимодействует с новой молекулой Cl2 , образуя галогенно производное и радикал 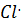 :
:
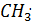 + Cl:Cl→CH3: Cl+
+ Cl:Cl→CH3: Cl+ 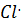 .
.
Радикал 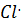 продолжает далее цепь превращений. Полное хлорирование метана :
продолжает далее цепь превращений. Полное хлорирование метана :
CH4+4Cl2 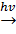 CCl4+4HCl .
CCl4+4HCl .
тетрахлор-метан
Получение
1. Реакция Вюрца:
2C2H5I+2Na 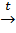 C4H10+2NaI.
C4H10+2NaI.
2. Синтез из солей карбоновых кислот:
CH3COONa+NaOH 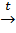 Na2CO3+CH4↑.
Na2CO3+CH4↑.
3. Синтез из простых веществ:
C+2H2 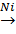 CH4↑.
CH4↑.
4. Разложение карбида алюминия водой:
Al4C3+12H2O=4Al(OH)3+3CH4↑.
5. Гидрирование циклоалканов на катализаторе.
6. Из природных источников (природного и попутного газов, нефть, каменного угля).
7. Электоролиз по Кольбе:
2R-COONa+2H2O 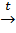 R-R+2NaOH+2CO2↑+H2↑.
R-R+2NaOH+2CO2↑+H2↑.
8. Синтез из угарного газа и водорода:
nCO+(2n+1)H2 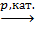 CnH2n+2+nH2O.
CnH2n+2+nH2O.
Дата добавления: 2016-07-18; просмотров: 2283;











