Электрокатализ и фотокатализ.
Гетерогенный электрокатализ представляет собой явление каталитического ускорения электродных реакций материалом электрода. Соответствующая область науки находится на стыке гетерогенного катализа и электрохимии. Скорость электрокаталитических реакций и их селективности можно контролировать путем управления величиной электродного потенциала. В последние десятилетия интерес к электрокатализу значительно возрос в связи с осознанием необходимости разработки новых, экологически безопасных источников энергии. Во всем мире проводятся работы, направленные на создание различных типов топливных элементов, в том числе с полимерной протонпроводящей мембраной (ТЭППМ), в которых топливом является водород, и прямых метанольных топливных элементов (ПМТЭ). Однако коммерциализация топливных элементов тормозится их высокой стоимостью и недостаточно высокими экспериментально достигнутыми коэффициентами полезного действия. Успех в области разработки топливных элементов в значительной мере определяется прогрессом в создании активных и стабильных наноматериалов для катодов и анодов. Можно полагать, что в последующие десятилетия роль электрокатализа будет неуклонно возрастать как в связи с введением в практику топливных элементов, так и с развитием новых экологически чистых электрокаталитических процессов для электросинтеза ценных химических и фармацевтических продуктов, очистки воды от вредных примесей и др.
VIII) Катализ для топливных элементов (Fuel Cell Catalysis).
Например, наноструктурные платиноуглеродные катализаторы для низкотемпературных топливных элементов.
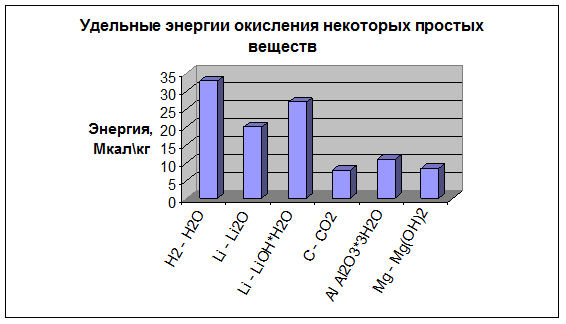
Веществом, эффективным с точки зрения энергоемкости (в расчете на единицу массы) является водород (рисунок).
Рисунок - Удельные энергии окисления некоторых простых веществ
В цикле получения энергоносителя водород легко может быть получен из воды, запасы которой практически неисчерпаемы, а при сгорании (в цикле производства энергии) вновь образует воду – экологически безопасное вещество.
С точки зрения устройства низкотемпературные топливные элементы представляют собой совокупность мембранно-электродных блоков, каждый из которых включает газопроницаемые (пористые) катодный и анодный слои, газоподводящий (газораспределяющий) слой и полупроницаемую мембрану, разделяющую катодное и анодное пространство топливного элемента. На рис. 5 схематично изображен мембранно-электродный блок водородно-кислородного (воздушного) топливного элемента с полимерной протонопроводящей мембраной. Кислород (воздух) и водород подаются, соответственно, в катодное и анодное пространство, где происходят токообразующие реакции:
Анод: H2 – 2ē = 2H+
Катод: O2 + 4ē + 4H+ = 2H2O
Образующиеся на аноде протоны мигрируют через протонопроводящую мембрану в катодное пространство, где участвуют в реакции электровосстановления кислорода. Акт переноса электронов осуществляется на поверхности электрода, материал которого должен быть устойчив в реакционной среде, обладать высокой электропроводностью и обеспечивать высокую скорость окисления или восстановления. Скорость многих электрохимических реакций очень сильно зависит от материала электрода.
Например, на платине окисление водорода и восстановление кислорода происходит в сотни и тысячи раз быстрее, чем на многих других металлах. С учетом высокой химической стойкости это делает платину наилучшим материалом для изготовления электродов топливного элемента.
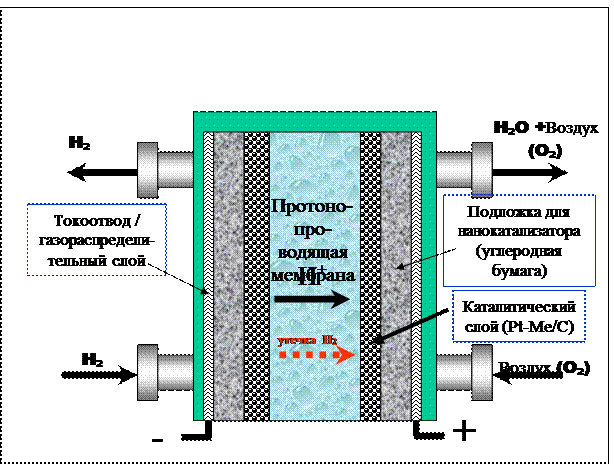
Рисунок - Схема водородно-кислородного Топливного Элемента с протонопроводящей мембраной [Proton Exchange Membrane Fuel Cell (PEMFC)]
При разработке электродов необходимо учитывать и то обстоятельство, что электрохимические реакции с участием газообразных веществ протекают лишь в так называемой трехфазной зоне – тонком слое электролита, одновременно контактирующем с поверхностью электрода и с газовой фазой. Для достижения высокой мощности необходимо создать в компактном устройстве, каковым является топливный элемент, развитую трехфазную зону. Поэтому поток газа направляют в пористый электропроводный каталитический слой, в котором катализатором являются наночастицы платины, нанесенные на высокоразвитую поверхность углеродного носителя (рисунок).
Наличие углеродного носителя в качестве компонента электрокатализатора обусловлено несколькими причинами. В частности, наночастицы металлов склонны к образованию агрегатов, поэтому их состояние стабилизируют «закрепив» на поверхности носителя. Каталитический слой, состоящий из частиц углерода, покрытого наночастицами платины, обладает пористостью и проницаемостью достаточной для обеспечения доступа реагентов (отвода продуктов) к (от) частицам металла. Углерод обладает высокой электропроводностью, обеспечивая подвод и отвод электронов к/от наночастиц металла, а также достаточной коррозионной стойкостью в условиях эксплуатации ТЭ. Удельная площадь поверхности платины в каталитическом слое может достигать 60-90 м2/г(Pt).

Рисунок - Электронно-микроскопические фотографии платиноуглеродного наноструктурного катализатора.
Возможность широкого использования топливных элементов, определяется, на сегодняшний день, стоимостью производимой ими энергии. В настоящее время, она примерно в 3-4 раза выше, чем у альтернативных устройств. Для малогабаритных низкотемпературных ТЭ (метанольные ТЭ, ТЭ с полимерной мембраной, фосфорнокислотные водородно-кислородные ТЭ) стоимость производимой энергии во многом определяется количеством платины, содержащейся в каталитическом слое. К сожалению, менее дорогостоящие системы на основе бесплатиновых катализаторов на сегодняшний день существенно уступают платиноуглеродным и в лучшем случае рассматриваются в качестве перспективных материалов «послезавтрашнего» дня. Реальным путем оптимизации каталитического слоя является уменьшение содержания в нем Pt при сохранении активности катализатора. Казалось бы, такой результат может быть достигнут путем уменьшения размера наночастиц металла, что приведет к увеличению суммарной площади его поверхности. Однако оказалось, что удельная каталитическая активность Pt (в расчете на единицу истинной поверхности) снижается при уменьшении размера частиц. В результате учета действия двух противоположных факторов – роста площади поверхности и снижения удельной каталитической активности, возникло представление о существовании оптимального размера наночастиц, обеспечивающего максимальную суммарную скорость реакции (рисунок).
В действительности, получение Pt/C нанокатализатора с оптимальной структурой и заданной загрузкой (массовой долей) платины весьма непростая задача. Отметим, что различные методы синтеза подобных систем не являются упорядоченной сборкой, а так или иначе связаны с процессами самоорганизации вещества. Поэтому практически невозможно создать однородный по размеру и по поверхностному распределению частиц Pt/C материал.
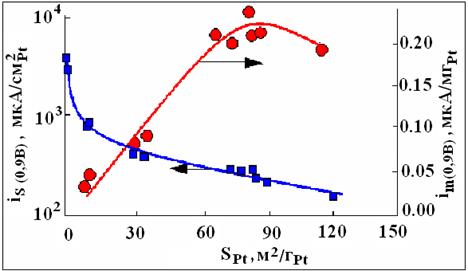

 Рисунок - Зависимость скорости (плотности тока) реакции электровосстановления кислорода при потенциале 0,9 В от удельной площади поверхности наночастиц платины на Pt/C электроде. В расчете на единицу массы и единицу истинной площади поверхности платины.
Рисунок - Зависимость скорости (плотности тока) реакции электровосстановления кислорода при потенциале 0,9 В от удельной площади поверхности наночастиц платины на Pt/C электроде. В расчете на единицу массы и единицу истинной площади поверхности платины.
Дата добавления: 2020-07-18; просмотров: 1159;











