От концентрации реагентов.
Скорость химических реакций.
Кинетика ― учение о скорости различных процессов, в том числе химических реакций. Одним из основных понятий в химической кинетике является скорость реакции.
Скоростью химической реакции V называют изменение количества реагирующего вещества за единицу времени в единице реакционного пространства.
 В гомогенной системе реакционным пространством служит объем сосуда, в котором протекает взаимодействие, а количество вещества в единице объёма называется концентрацияС и выражается в моль/л.
В гомогенной системе реакционным пространством служит объем сосуда, в котором протекает взаимодействие, а количество вещества в единице объёма называется концентрацияС и выражается в моль/л.
Поэтому с случае гомогенного процесса, протекающего при постоянном объёме, скорость гомогенной химической реакции измеряется изменением концентрации какого-либо из реагирующих веществ за единицу времени.
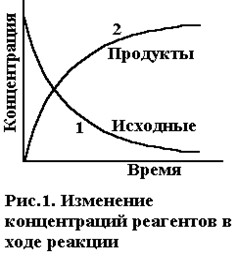
Обычно время τ выражается в сек, поэтому размерность скорости реакции как правило, моль/л·сек. При химическом взаимодействии концентрация каждого из исходных веществ уменьшается во времени (С2<С1, ΔС<0), а концентрация каждого из продуктов реакции возрастает (С2>С1, ΔС>0). Изменение концентраций исходных веществ и продуктов реакции во времени приведено на рис.1. В химической кинетике различают среднюю и истинную (или мгновенную) скорость реакции. Средняя скорость v равна отношению ΔС/Δτ (ΔС = С2-С1, Δτ = τ2-τ1). Чтобы величина скорости была всегда положительной, перед дробью ставят знаки ''±''. ΔС
V = ± —–—
Δτ
Истинная скорость химической реакции Vист определяется пределом, к которому стремится отношение ΔС/Δτ при τ→ 0, т.е. производной концентрации по времени:
dС
Vист = ± —–—
dτ
Зависимость скорости реакции
от концентрации реагентов.
Необходимым условием для осуществления акта химического взаимодействия между молекулами должно быть их столкновение. Столкновение молекул в некотором реакционном пространстве при заданной температуре происходят тем чаще, чем больше этих молекул. Поэтому скорость химической реакции зависит от концентрации реагирующих веществ. По мере уменьшения концентрации исходных веществ во времени (рис.1, кривая 1) скорость реакции падает.
Количественно зависимость скорости реакции от концентрации реагирующих веществ выражается законом действующих масс, который в современной формулировке выглядит так:
при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Для реакции аА +bВ → mМ + nN
математическое выражение закона действующих масс имеет вид:
V = kСАа·СВb (1)
где V ― скорость реакции; САиСВ― концентрации реагентов А и В; а, b ― стехиометрические коэффициенты в уравнении реакции; k― коэффициент пропорциональности, называемый константой скорости химической реакции. Размерность константы скорости определяется величинами стехиометрических коэффициентов аи b и остается такой, чтобы скорость V имела размерность моль/л∙сек. Если нет точных данных, размерность k принимают сек―1. ПриСА = СВ= 1 моль/лk численно равнаV. Выражение (1) называют также кинетическим уравнением реакции.
Константа скорости химической реакции k определяется природой реагирующих веществ и зависит от температуры, от присутствия катализатора, но не зависит от концентрации веществ, участвующих в реакции.
Пример 1. В реакционный сосуд объемом 2 л помещены 0,06 моль вещества А и 0,02 моль вещества В. При определенной температуре протекает реакция А + 2В = АВ2 Найти значение константы скорости реакции при этой температуре, если при заданных концентрациях веществ А и В скорость реакции равна 6·10―7 моль/(л·сек).
Решение: Зная количества реагирующих веществ и объем системы, найдем молярные концентрации реагентов:
СА = 0,06/2 = 0.03 = 3·10―2 моль/л; СВ = 0,02/2 = 0.01 = 10―2 моль/л
Запишем выражение кинетического уравнения, связывающего скорость реакции с концентрациями реагирующих веществ: V=kСА·СВ2
V6.10―7
Отсюда: k = ————— = ——————— = 0,2 л2/(моль)2∙сек
СА·СВ2·3·10―2 (10―2)2
Закон действующих масс справедлив только для наиболее простых по своему механизму взаимодействий, протекающих в газах или в разбавленных растворах. Сложные реакции могут быть совокупностью параллельно или последовательно протекающих процессов. Закон действующих масс справедлив для каждой отдельной стадии реакции, но не для всего взаимодействия в целом. Та стадия процесса, скорость которой минимальна, лимитирует скорость реакции в общем. Поэтому математическое выражение закона действующих масс, записанное для самой медленной (лимитирующей) стадии процесса, приложимо одновременно и ко всей реакции в целом.
Если в реакции участвуют два или более веществ, то скорость реакции может зависеть от концентрации только одного из них, участвующего в самой медленной стадии процесса и не зависеть от концентрации других.
Дата добавления: 2020-07-18; просмотров: 199;










